Нитрат висмута
 Из Википедии, бесплатной энциклопедии
Из Википедии, бесплатной энциклопедии
| Нитрат висмута | |
|---|---|
 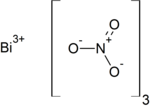 | |
| Общие | |
| Систематическое наименование | Нитрат висмута |
| Традиционные названия | Азотнокислый висмут |
| Хим. формула | Bi(NO3)3 |
| Физические свойства | |
| Молярная масса | 394,99 г/моль |
| Плотность | гидр. 2,83 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | гидр. 75 °C |
| Классификация | |
| Рег. номер CAS | 10361-44-1 гидр. 10035-06-0 |
| PubChem | 107711, 16682959 и 16695048 |
| Рег. номер EINECS | 233-791-8 |
| SMILES | |
| InChI | |
| ChemSpider | 96880 и 27473137 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат висмута — неорганическое соединение, соль металла висмута и азотной кислоты с формулой Bi(NO3)3, бесцветные кристаллы, гидролизуются водой, образует кристаллогидрат.
Получение[править | править код]
- Растворение висмута, оксида висмута, гидроксида висмута или основного карбоната висмута в разбавленной азотной кислоте:
- Безводную соль можно получить реакций висмута и оксида азота в ацетонитриле:
- или обменной реакцией в ацетоне:
Физические свойства[править | править код]
Нитрат висмута образует бесцветные кристаллы, гидролизуются водой, устойчив в подкисленных растворах.
Образует кристаллогидрат состава Bi(NO3)3•5H2O, который плавится при 75°С в собственной кристаллизационной воде. Кристаллогидрат имеет строение [Bi(H2O)3(NO3)3]•2H2O.
Химические свойства[править | править код]
- Безводная соль разлагается при нагревании:
- Кристаллогидрат при хранении на воздухе медленно разлагается:
- При нагревании кристаллогидрат гидролизуется собственной водой:
- В разбавленных водных растворах при кипячении подвергается полному гидролизу:
- Реагирует с концентрированной холодной соляной кислотой:
- Реагирует с щелочами:
- Под действием окислителей образуются висмутаты:
- В кислой среде с фторидами вступает в обменные реакции:
- Вступает в другие обменные реакции:
Применение[править | править код]
- В фармакологии при болезнях желудочно-кишечного тракта, при кожных заболеваниях, как антисептический препарат.
- Вводится в состав отбеливающих кремов, кремов от веснушек, в краски для волос.
- Пигмент — жемчужные или испанские белила.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |












![{\displaystyle {\mathsf {Bi(NO_{3})_{3}+4HCl\ {\xrightarrow {0^{o}C}}\ H[BiCl_{4}]+3HNO_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/97fdcd348c52e1cfeb12c6cf4cbe0849a9c88228)






