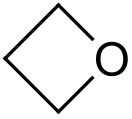
Оксетан

| Оксетан | |||
|---|---|---|---|
| |||
| Общие | |||
| Хим. формула | C3H6O | ||
| Физические свойства | |||
| Молярная масса | 58,08 г/моль | ||
| Плотность | 0,8930 г/см³ | ||
| Энергия ионизации | 9,67 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −97 °C[1] | ||
| • кипения | 49–50 °C | ||
| Структура | |||
| Дипольный момент | 6,5E−30 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | 503-30-0 | ||
| PubChem | 10423 | ||
| Рег. номер EINECS | 207-964-3 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 30965 | ||
| ChemSpider | 9994 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Оксетан (1,3-пропиленоксид, триметиленоксид, 1-оксациклобутан) — четырёхчленный кислородсодержащий насыщенный гетероцикл, содержащий один атом кислорода. Бесцветная жидкость, хорошо растворимая в воде, этаноле, диэтиловом эфире и полярных органических растворителях.
Реакционная способность
[править | править код]Оксетан является циклическим простым эфиром и обладает сходной реакционной способностью. Молекула оксетана плоская, электронная плотность на атоме кислорода выше, а на α-атомах углерода ниже, чем у ненапряжённых простых эфиров.
Вместе с тем, за счёт напряжённости четырехчленного цикла и повышенной, по сравнению с ненапряженными простыми эфирами, электрофильности α-углеродных атомов и нуклеофильности кислорода, для оксетана и его гомологов характерны реакции раскрытия цикла:
- (CH2)3O + RNH2 RNH(CH2)3OH
- (CH2)3O + RMgX R(CH2)3OH
- (CH2)3O + HCl Cl(CH2)3OH
В присутствии кислот Льюиса в неполярных растворителях оксетан полимеризуется:
- n(CH2)3O (CH2CH2CH2O)n
Синтез
[править | править код]Оксетаны получают действием щелочей на 3-галоген-1-пропанолы (или их сложные эфиры), при этом происходит внутримолекулярное алкилирование с замыканием оксетанового цикла. Так, незамещённый оксетан может быть синтезирован циклизацией 3-хлорпропилацетата под действием гидроксида калия при 150 °C, выход при этом составляет ~40 %[3]:
- ClCH2CH2CH2OCOCH3 + 2KOH (CH2)3O + CH3COOK + KCl + H2O
Другим методом синтеза оксетанов является фотохимическое 1,2-присоединение карбонильных соединений к алкенам (реакция Патерно-Бюхи):
В качестве карбонильного компонента в таком циклоприсоединении могут участвовать алифатические и ароматические альдегиды и кетоны, хиноны, и т. п., в качестве алкенового — ациклические и циклические олефины, некоторые гетероциклы (например, фуран) и кетенимины; при использовании несимметрично замещённых алкенов образуются смеси изомерных оксетанов.
См. также
[править | править код]Ссылки
[править | править код]- ↑ Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // (unknown type) — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ C. R. Noller (1955), «Trimethylene oxide», Org. Synth. 29: 92, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV3P0835 Архивная копия от 6 июня 2011 на Wayback Machine ; Coll. Vol. 3: 835
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |