Оксиды аминов

Оксиды аминов (N-оксиды) — производные третичных (в том числе и гетероароматических) аминов общей формулы R3N+—O-. К N-оксидам также относят аналогичные производные первичных и вторичных аминов[1]. N-оксиды иминов называют нитронами[2].
Оксиды третичных аминов — стабильные вещества, низшие N-оксиды растворимы в воде и ограничено растворимы в неполярных растворителях. Оксиды первичных и вторичных аминов нестабильны и перегруппировываются in situ в гидроксиламины.
Общие сведения
[править | править код]Оксиды аминов были известны химикам и изучались ими до 1900 года, но только после того как компания I.G.Farbenindustrie в 1939 году получила патент на такое вещество как диметилдодецил амин оксид, оксиды аминов были общепризнаны поверхностно-активными веществами. Через 22 года была выявлена полезность включения оксидов амина в рецептуры жидких средств бытовой химии, это способствовало широкому интересу производителей к этому классу соединений. Замена традиционно использовавшихся алканоламидов жирных кислот в качестве пенообразователей в рецептурах средств для мытья посуды на оксид амина — это конкретный пример применения этого вещества, приведший к его популяризации. Соотношение между количеством вводимого в рецептуру оксида амина и получаемым эффектом компенсировало его более высокую стоимость.
Реакция между перекисью водорода и вторичными или первичными аминами не приводит к синтезу веществ, интересных с коммерческой точки зрения, зато реакция с третичными аминами дает возможность получать такие вещества, которые можно использовать не только в различных моющих средствах, но, и в жидких отбеливателях на основе гипохлорита натрия, и как антистатик в текстильном промышленности, в качестве стабилизатора пены при производстве резины, как катализаторы полимеризации при изготовлении пластиков, в качестве антикоррозионных составов, как диспергатор кальциевого мыла и антибактериальный агент в твердых дезодорантах, что обусловлено замечательной совместимостью с другими компонентами состава и проявляемым синергизмом. Оксиды амина получаются в результате экзотермической реакции второго порядка между перекисью водорода и третичными аминами, природа которых может быть алифатической, ароматической, гетероциклической, алициклической или их комбинацией. В распространенных оксидах амина предшествующее поверхностно-активное вещество обычно C12-C18 алкилдиметил амин.
Оксиды аминов относятся к особому классу поверхностно-активных веществ, классифицируемых как амфотерные ПАВ. Это связано с тем, что оксид амина является цвиттер-ионой молекулой, которая при изменении pH от низкой к высокой величине меняет свою природу с катионной на неионогенную.
Оксиды амина имеют низкий коэффициент биологического накопления, легко удаляются стандартными способами очистки сточных вод, биоразлогаемы под действием аэробных и анаэробных бактерий. Все оксиды амина имеют токсичность от низкой до умеренной.[3]
Реакционная способность
[править | править код]Связь N+—O− в N-оксидах диполярна с существенно повышенной электронной плотностью на атоме кислорода, являющегося нуклеофильным центром.
Так, N-оксиды протонируются, образуя кристаллические соли с сильными кислотами, однако являются более слабыми основаниями, чем исходные амины. N-оксиды алкилируются с образованием солей тетразамещенного гидроксиаммония, разлагающихся в водной щелочи с образованием альдегидов и третичных аминов:
- R3N+-O− + PhCH2X R3N+-OCH2Ph X−
- R3N+-OCH2Ph + OH− R3N + PhCHO + X−
Ацилирование алифатических N-оксидов приводит к нестабильным O-ацилпроизводным, которые, как и O-алкилпроизводные, разлагаются с образованием альдегида и замещенного ацетамида:
- (CH3)3N+-O− + (CH3CO)2O (CH3)3N+-OCOCH3 CH3COO−
- (CH3)3N+-OCOCH3 CH3COO− CH3CON(CH3)2 + CH2O + CH3COOH
Эта реакция с последующим проведением гидролизом ацетамида используется в качестве метода деметилирования метиламинов (реакция Полоновского):
N-оксиды третичных аминов, в алкильных заместителях которых присутствует атом водорода в β-положении к N-оксидному азоту, при нагревании разлагаются с образованием алкенов и гидроксиламинов. Реакция используется для синтеза алкенов из третичных аминов, N-оксиды которых зачастую синтезируют in situ и, не очищая, подвергают термическому разложению (элиминирование по Коупу)[4]:
При нагревании в растворе щелочи или при фотолизе N-оксиды третичных аминов перегруппировываются в O-замещенные гидроксиламины (реакция Майзенхаймера), обычно реакция протекает как 1,2-сдвиг:
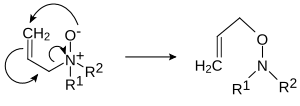
В случае N-оксидов аллиламинов возможна 2,3-перегруппировка в O-аллилгидроксиламины:
При каталитическом гидрировании над никелем или палладием, а также под действием фосфинов N-оксиды восстанавливаются до исходных аминов.
Синтез
[править | править код]Общий метод синтеза N-оксидов — окисление третичных аминов перекисью водорода, реакцию в случае алифатических аминов проводят в нейтральной среде, в случае ароматических — в кислой:
Нахождение в природе
[править | править код]
Триметиламиноксид образуется в организме человека из триметиламина, который, в свою очередь, является результатом переработки карнитина, холина, бетаина и лецитина кишечным микробиомом[5].
N-оксиды пергидроазафеналенов — кокцинеллин[6] и конвергин[7] входят в состав гемолимфы божьих коровок, при защитной реакции гемолимфа выделяется из отверстий около рта и в суставах ножек, чрезвычайно горький вкус этих соединений играет защитную роль.
См. также
[править | править код]Примечания
[править | править код]- ↑ amine oxides // IUPAC Gold Book. Дата обращения: 8 октября 2013. Архивировано 2 ноября 2013 года.
- ↑ nitrones // IUPAC Gold Book. Дата обращения: 8 октября 2013. Архивировано 21 октября 2012 года.
- ↑ Об оксидах аминов (рус.). https://nobel-group.by (11 декабря 2017). Дата обращения: 29 июня 2021. Архивировано 29 июня 2021 года.
- ↑ Arthur C. Cope, Engelbert Ciganek. Methylenecyclohexane and n, n-dimethylhydroxylamine hydrochloride. Organic Syntheses, Coll. Vol. 4, p.612 (1963); Vol. 39, p.40 (1959). Дата обращения: 8 октября 2013. Архивировано из оригинала 22 августа 2010 года.
- ↑ Chhibber-Goel J, Singhal V, Parakh N, Bhargava B, Sharma A. The Metabolite Trimethylamine-N-Oxide is an Emergent Biomarker of Human Health. PubMed.
- ↑ Holloway, Graham J.; de Jong, Peter W.; Brakefield, Paul M.; de Vos, Helene (1991-12-01). "Chemical defence in ladybird beetles (Coccinellidae). I. Distribution of coccinelline and individual variation in defence in 7-spot ladybirds (Coccinella septempunctata)". CHEMOECOLOGY. 2 (1): 7—14. doi:10.1007/BF01240660. ISSN 1423-0445. Дата обращения: 10 сентября 2020.
- ↑ Tursch, B.; Daloze, D.; Braekman, J. C.; Hootele, C.; Cravador, A.; Losman, D.; Karlsson, R. (1974). "Chemical ecology of arthropods. 9. Structure and absolute configuration of hippodamine and convergine, two novel alkaloids from american ladybug hippodamia convergens (coleoptera- coccinellidae)". Tetrahedron Letters: 409—412. ISSN 0040-4039. Архивировано 31 июля 2016. Дата обращения: 10 сентября 2020.