Фталоцианины



Фталоцианины — тетраазобензопорфирины, высшие гетероциклические соединения, состоящие из изоиндольных (бенз[c]пиррольных) колец, соединённые между собой через sp2-гибридизованный атом азота, структурно родственны порфиринам[1]. Комплексы фталоцианинов с переходными металлами используются в качестве красителей и пигментов.
История открытия
[править | править код]Первое упоминание о странном тёмно-синем веществе, которое сейчас называется фталоцианином, относится к 1907 году. В 1927 году швейцарские исследователи пытались синтезировать фталонитрил из о-дибромбензола и цианида меди (реакция Роземунда - фон Брауна). При этом получались синие соединения, среди которых были медь-замещённые фталоцианин, нафталоцианин, октаметилфталоцианин. Исследователи сообщали об удивительно высокой стабильности этих окрашенных соединений - они при высоких возгонялись без разложения и не разлагались концентрированными кислотами и щелочами - однако так и не смогли определить их природу[2]. Толчком к детальному исследованию этих соединений также послужила случайность: в результате реакции, в которой ожидались только бесцветные продукты, был получен осадок тёмно-синего цвета. Целенаправлено фталоцианин меди впервые был получен Линстедом в 1934 году при нагревании динитрила фталевой кислоты с порошком меди[3]. После 1934 началось интенсивное исследование металлированных и неметаллированных фталоцианинов.
Физические свойства
[править | править код]Тетраазопорфириновый цикл фталоцианинов представляет собой 18-электронную ароматическую систему, за счёт большой длины цепи сопряжения фталоцианины ярко окрашены, поглощая в видимом диапазоне в области примерно от 400 до 700 нм с коэффициентом молярной экстинции порядка 105 моль−1 см−1[4], у незамещённого фталоцианина присутствует два пика поглощения - при 663,75 нм, 140793 моль−1 см−1 и 699 нм, 161453 −1 см−1 (в хлорнафталине)[5] Введение электродонорных заместителей в бензольные фрагменты фталоцианина может приводить к батохромному сдвигу длинноволновой полосы поглощения до ~100 нм.
Фталоцианины и металлофталоцианины при нормальных условиях находятся в твёрдой фазе. Легко сублимируют и кристаллизуются, что позволяет получить очень чистые материалы.
Для фталоцианинов характерна высокая термическая стабильность: так, фталоцианин меди устойчив к кратковременному нагреву на воздухе до температур 400-500 °C, в вакууме — до 900 °C. При нагревании в вакууме в течение 5 суток при температуре 550-575 °C разлагается ~9% фталоцианина меди, при этом в газообразных продуктах разложения преобладает синильная кислота[6].
Растворяются в концентрированной серной, фосфорной, хлорсульфоновой, трихлоруксусной и трифторуксусной кислотах[7], при их разбавлении выпадают в осадок, растворимы в высококипящих органических растворителях (нитробензол, хинолин). При наличии объёмистых гидрофобных заместителей растворимость в неполярных растворителях повышается, сульфированые фталоцианины (фталоцианинсульфокислоты) растворимы в воде.
Химические свойства
[править | править код]Фталоцианины амфотерны: под действием сильных кислот происходит протонирование мостиковых атомов азота — вплоть до полного протонирования с образования тетрапротонированных солей под действием концентрированной серной и хлорсульфоновой кислот.
Водороды при пиррольных атомах азота подвижны и под действием оснований отщепляются с образованием дианиона. Пиррольные протоны также могут замещаться катионами металлов с образованием соответствующих солей либо комплексных соединений.
Фталоцианины, будучи ароматическими соединениями, вступают в реакции электрофильного замещения: они сульфируются, нитруются, галогенируются, реакционная способность комплексных металлоцианинов переходных металлов по сравнению со фталоцианинами понижена, так, например, если фталоцианин может быть хлорирован в суспензии в четырёххлористом углероде, то промышленный метод хлорирования фталоцианина меди — хлорирование в расплаве эвтектической смеси NaCl и AlCl3.
Под действием сильных окислителей (K2Cr2O7, KMnO4, Ce(SO4)2, концентрированной HNO3) в присутствии воды происходит разрушение тертаазобензопорфиринового цикла с образованием соответствующих производных фталевых кислот, в отсутствие воды (избыток брома в метаноле, концентрированная HNO3 в нитробензоле) продуктом окисления металлофталоцианинов являются производные изоиндоленина.
Комплексообразование и фталоцианиновые красители
[править | править код]Фталоцианины образуют с катионами щелочных и щелочноземельных металлов (а также некоторых переходных металлов, например, Cd2+) соединения солеобразного характера: они не растворимы в органических растворителях, не возгоняются и под действием кислот разлагаются, давая исходные фталоцианины. В случае ряда переходных металлов (Cu, Ni, Pd, Pt, Os) образуются высокоустойчивые комплексные соединения, способные к сублимации (фталоцианин меди сублимируется при атмосферном давлении при 550 °C), растворимые без деметаллирования в концентрированных кислотах и способные растворяться в органических растворителях.
Окрашенные комплексные фталоцианины переходных металлов — в первую очередь фталоцианин меди и его производные — устойчивы к нагреву и окислению и используются в качестве пигментов.
Получение
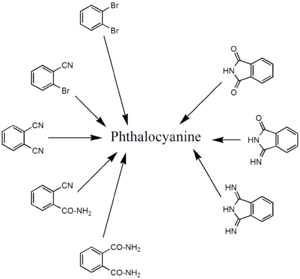
[править | править код]По изображению слева видно, что молекула фталоцианина состоит из четырёх одинаковых частей. На этом и базируется стратегия синтеза: в качестве исходных берут соединения, соответствующие данной части. Это различные производные фталевой кислоты: фталонитрил, о-цианобензамид, фталевый ангидрид, фталимид и дииминоизоиндол.

Применение
[править | править код]Подавляющая часть производимых фталоцианинов ~90 % в виде комплексов фталоцианинов с переходными металлами используется в качестве пигментов. Наибольшее промышленное значение и, соответственно, долю в производстве, имеют медные комплексы. Незамещённый фталоцианин меди (CuPc) в кристаллических α- и β-формах широко применяется в качестве синего пигмента. Перхлорбромфталоцианины меди используются в качестве зелёных пигментов, сдвиг цвета от синего к жёлтому таких пигментов увеличивается с увеличением отношения бром/хлор.
Растворимые производные фталоцианинов используются также в качестве красителей. Натриевые соли медных комплексов фталоцианиндисульфокислоты CuPC(SO3Na)2 (краситель Direct Blue 86, CAS 1330-38-7) и фталоцианинтетрасульфокислоты CuPC(SO3Na)4 (краситель Acid Blue 249, CAS 36485-85-5) применяются как прямые красители для натуральных и синтетических волокон, бумаги и кожи. Производые фталоцианина кобальта (краситель Vat Blue 29, CAS 1328-50-3) используются в качестве кубовых красителей для целлюлозных волокон.
Также фталоцианины применяются для изготовления активного слоя CD-R дисков[8].
В качестве редокс-катализаторов фталоцианины переходных металлов нашли применение в процессах демеркаптанизации и обезвреживания сернисто-щелочных стоков[9][10].
Фталоцианин меди входит в состав известной смазки №158 с загустителем на основе литиевых и калиевых солей смоляных кислот канифоли (в первую очередь абиетаты калия и лития) и жирных кислот касторового масла (получают омылением очищенного касторового масла щелочами, в данном случае гидроксидами лития и калия соответственно). Фталоцианин меди используется в качестве антиокислительной присадки, придаёт самой смазке №158 характерный синий цвет.
Примечания
[править | править код]- ↑ Nomenclature of Tetrapyrroles. Appendix 1 Trivially named porphyrins, chlorins, chlorophylls and bilins, fundamental parents. IUPAC Joint Commission on Biochemical Nomenclature (JCBN). Дата обращения: 24 сентября 2020. Архивировано 25 апреля 2021 года.
- ↑ de Diesbach, Henri; von der Weid, Edmond (1927). "Quelques sels complexes des o-dinitriles avec le cuivre et la pyridine". Helvetica Chimica Acta. 10 (1): 886—888. doi:10.1002/hlca.192701001110. eISSN 1522-2675. ISSN 0018-019X. Дата обращения: 25 сентября 2020.
- ↑ R. P. Linstead, J. Chem. Soc., 1934, 1016; G. E. Ficken, R. P. Linstead, E. Stephen, M. Whalley, J. Chem. Soc. 1958, 3879.
- ↑ Фараонов, 2016, с. 19.
- ↑ Phthalocyanine, optical absorption and emission data. OMLC. Дата обращения: 25 сентября 2020. Архивировано 27 августа 2020 года.
- ↑ Lawton, Emil A. (1958-03). "The Thermal Stability of Copper Phthalocyanine". The Journal of Physical Chemistry. 62 (3): 384—384. doi:10.1021/j150561a051. ISSN 1541-5740. Дата обращения: 25 сентября 2020.
- ↑ Miles A. Dahlen. The Phthalocyanines A New Class of Synthetic Pigments and Dyes (EN) // Industrial & Engineering Chemistry. — ACS Publications, 2002-05-01. — Т. 31, вып. 7. — С. 839-847. — doi:10.1021/ie50355a012.
- ↑ Тиражирование компакт-дисков. Часть 1. Введение. Дата обращения: 4 марта 2010. Архивировано 28 сентября 2010 года.
- ↑ Ахмадуллина, 1993.
- ↑ Ахмадуллина, 1994.
Литература
[править | править код]- M. N. Kopylovich, V. Yu. Kukushkin, M. Haukka, K. V. Luzyanin, A. J. L. Pombeiro, J. Amer. Chem. Soc., 2004, 126, 15040.
- Moser, Frank. H; Thomas, Arthur. L. Phthalocyanine Compounds. Reinhold Publishing Corporation, 1963
- Ахмадуллина А. Г., Кижаев Б. В., Нургалиева Г. М., Шабаева А. С., Тугуши С. О., Харитонов Н. В. Гетерогенно-каталитическая демеркаптанизация легкого углеводородного сырья // Нефтепереработка и нефтехимия : журнал. — 1994. — № 2. — С. 39—41.
- Ахмадуллина А. Г., Кижаев Б. В., Хрущева И. К., Абрамова Н. М., Нургалиева Г. М., Бекбулатова А. Т., Шабаева А. С. Опыт промышленной эксплуатации гетерогенных катализаторов в процессах окислительного обезвреживания сернисто-щелочных стоков и водных технологических конденсатов // Нефтепереработка и нефтехимия : журнал. — 1993. — № 2. — С. 19—23.
- Фараонов Максим Алексеевич. Анионные и анион-радикальные соединения фталоцианинов: синтез, структура, свойства (диссертация на соискание ученой степени кандидата химических наук) / Научный руководитель: доктор химических наук Конарев Дмитрий Валентинович. — Черноголовка: ФГБУН «Институт проблем химической физики РАН», 2016. — 146 с.