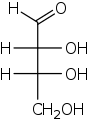
Эритроза

| Эритроза | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | (2R,3R)-2,3,4-тригидроксибутаналь (D-эритроза) |
| Традиционные названия | эритроза, эритротетроза |
| Хим. формула | C4H8O4 |
| Физические свойства | |
| Состояние | твёрдое кристаллическое вещество |
| Молярная масса | 120,1039 ± 0,005 г/моль |
| Плотность | 1,28 г/см³ |
| Химические свойства | |
| Растворимость | |
| • в воде | 25 г/100 мл |
| Классификация | |
| Рег. номер CAS | 583-50-6 |
| PubChem | 94176 |
| Рег. номер EINECS | 209-505-2 |
| SMILES | |
| InChI | |
| ChEBI | 27904 |
| ChemSpider | 84990 |
| Безопасность | |
| ЛД50 | 2000 (крысы) |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Эритроза — моносахарид из группы тетроз с эмпирической формулой C4H8O4, принадлежит к альдозам.[1] Является наряду со своим диастереомером треозой является представителем альдотетроз.
Строение молекулы
[править | править код]Эритроза является диастереомером треозы, отличаясь от неё ориентацией гидроксильной группы при С2. Так как молекула эритрозы содержат по два хиральных центра, то она может существовать в виде двух линейных энантиомеров — D- и L-стереоизомеров, а также в виде рацемата (смеси энантиомеров). Циклическая форма для эритрозы нехарактерна.
- Проекция Фишера для D-эритрозы
- Проекция Фишера для L-эритрозы
В живых организмах из этих двух стереоизомеров содержится исключительно D-эритроза.
Физические и химические свойства
[править | править код]Эритроза представляет собой прозрачную вязкую жидкость очень хорошо растворимую в воде, но плохо растворимую в органических растворителях (масла, эфиры, ацетон и т. п.). Водный раствор эритрозы имеет слабокислую реакцию среды.
При восстановлении эритрозы боргидридом натрия или калия образуется четырёхатомный спирт эритрит или бутантетрол (1,2,3,4-тетрагидроксибутан), образующийся также при восстановлении эритрулозы. В реакции с соляной кислотой эритроза медленно превращается в молочную кислоту. При окислении эритрозы аммиачным раствором оксида серебра(I) образуется оптически активная эритроновая кислота (2,3,4-тригидроксибутановая кислота). При окислении эритрозы азотной кислотой образуется оптически активная винная кислота (2,3-дигидроксибутандиовая кислота).
Биологическая роль, получение и применение
[править | править код]Эритроза (в виде 4-фосфата) является важным промежуточным компонентом углеводного обмена, участвующем в образовании фруктозо-6-фосфата. Образуется в ходе пентозофосфатного цикла под действием фермента трансальдолазы из седогептулозо-7-фосфата и глицеральдегид-3-фосфата. Образовавшийся эритрозо-4-фосфат затем реагирует с рибулозо-5-фосфатом с образованием фруктозо-6-фосфат и глицеральдегид-3-фосфата (реакция идет при участии тиаминпирофосфата).[2] В растениях и многих микроорганизмах эритроза (в виде 4-фосфата) вместе с фосфоенолпируватом участвует в синтезе ароматических аминокислот триптофана, тирозина и фенилаланина.
Эритроза-4-фосфат в растениях, бактериях и грибах необходима для синтеза пиридоксина (витамин В6).
Промышленно эритрозу выделяют из растительного сырья или синтезируют химически путём окисления эритрита. Находит ограниченное применение для синтеза других сахаров.
См. также
[править | править код]Литература
[править | править код]- Каррер, П. Курс органической химии. — М.: Химия, 1960. — 1216 с.
- Кочетков, Н. К. Химия углеводов / Н. К. Кочетков, А. Ф. Бочков, Б. А. Дмитриев. — М.: Наука, 1967. — 672 с.
- Березин, Б. Д. Курс современной органической химии: Учебное пособие / Б. Д. Березин. — М: Высшая школа, 1999. — 768 с.
Примечания
[править | править код]- ↑ Thisbe K. Lindhorst. Essentials of Carbohydrate Chemistry and Biochemistry (англ.). — 1st. — Wiley-VCH, 2007. — ISBN 3-527-31528-4.
- ↑ J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 644—645, 773—775. ISBN 978-3-8274-1800-5.
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |
Для улучшения этой статьи желательно:
|