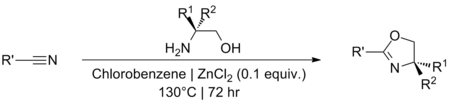Oksazolin

 | |
 | |
| Adlandırmalar | |
|---|---|
Tercih edilen IUPAC adı 4,5-Dihidro-1,3-oksazol | |
Diğer adlar Δ2-oksazolin | |
| Tanımlayıcılar | |
| |
3D model (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.007.274 |
PubChem CID | |
| UNII |
|
CompTox Bilgi Panosu (EPA) | |
| |
| Özellikler | |
| Kimyasal formül | C3H5NO |
| Molekül kütlesi | 71,08 g mol−1 |
| Yoğunluk | 1.075unit?[1] |
| Kaynama noktası | 98 °C (208 °F; 371 K)[1] |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
| Bilgi kutusu kaynakları | |
Oksazolin, C
3H
5NO formülüne sahip beş üyeli bir heterosiklik organik bileşiktir. Karbon ve/veya azot üzerinde, hidrojen olmayan ornatıklar içeren, oksazolinler (çoğul vurgu) adı verilen bir bileşik ailesinin ebeveynidir. Oksazolinler, oksazolidinlerin doymamış analoglarıdır ve N ve O'nun doğrudan bağlandığı izoksazolinlerle izomeriktirler. Çift bağın konumuna bağlı olarak iki oksazolin izomeri bilinmektedir.
Oksazolinin kendisinin herhangi bir uygulaması yoktur ancak oksazolinler potansiyel uygulamaları açısından geniş çapta araştırılmıştır. Bu uygulamalar arasında asimetrik katalizde ligand olarak, karboksilik asitler için koruyucu gruplar olarak ve giderek artan miktarda polimer üretiminde monomer olarak kullanım yer almaktadır.
Sentezi
[değiştir | kaynağı değiştir]2-oksazolin halkalarının sentezi iyi bilinmektedir ve genel olarak bir 2-amino alkolün (tipik olarak bir amino asidin indirgenmesiyle elde edilirler) uygun bir fonksiyonel grupla siklizasyonu (halka oluşturma) yoluyla ilerler.[2][3][4] Genel mekanizma genellikle Baldwin kurallarına tâbidir.
Karboksilik asitlerden
[değiştir | kaynağı değiştir]Klasik oksazolin sentezi, açil klorürlerin 2-amino alkollerle reaksiyonunu gerektirir. Tiyonil klorür, asit klorürü yerinde (in situ sentez) üretmek için yaygın olarak kullanılır; susuz koşulların korunmasına dikkat edilir, çünkü oksazolinler, iminin protonlanması durumunda klorür tarafından halka açılmasına uğrayabilir.[5] Reaksiyon tipik olarak oda sıcaklığında gerçekleştirilir. Aminometil propanol yaygın bir öncü amino alkoldür.[6][7]
Appel reaksiyonunun bir modifikasyonu, oksazolin halkalarının sentezine olanak tanır.[8] Bu yöntem nispeten ılımlı koşullar altında ilerlemektedir, ancak üretilen trifenilfosfin oksit miktarının büyük olması nedeniyle büyük ölçekli reaksiyonlar için ideal değildir. Karbon tetraklorürün Montreal Protokolü kapsamında kısıtlanması nedeniyle bu yöntemin kullanımı yaygınlığı yitirmeye başladı.
Aldehitlerden
[değiştir | kaynağı değiştir]Bir amino alkol ve bir aldehitin siklizasyonu, halojen bazlı bir oksitleyici madde (örn. NBS,[9] veya iyot[10]) ile işlenerek bir oksazoline dönüştürülebilen bir ara oksazolidin üretir; bu potansiyel olarak bir imidoil halojenür yoluyla ilerler. Yöntemin çok çeşitli aromatik ve alifatik aldehitler için etkili olduğu gösterilmiştir, ancak fenoller gibi elektron açısından zengin aromatik R grupları, tercihen oksitleyici madde ile hızlı elektrofilik aromatik halojenasyona maruz kaldıklarından uygun değildir.
Nitrillerden
[değiştir | kaynağı değiştir]Nitrillerden oksazolinler üretmek için katalitik miktarlarda ZnCl2'nin kullanımı ilk olarak Witte ve Seeliger[11][12] tarafından tanımlanmış ve daha sonra Bolm tarafından geliştirilmiştir.[13] Reaksiyonun başarılı olması için yüksek sıcaklıklar gerekir. Kesin bir reaksiyon mekanizması hiçbir zaman önerilmemiştir, ancak muhtemelen Pinner reaksiyonuna benzemektedir.[14][15] Reaksiyon için alternatif çözücülerin veya katalizörlerin belirlenmesine yönelik sınırlı araştırma yapılmıştır.[16][17]
Uygulamaları
[değiştir | kaynağı değiştir]Ligandlar
[değiştir | kaynağı değiştir]Kiral 2-oksazolin halkası içeren ligandlar, kolay sentezlenmeleri, geniş form aralıkları ve birçok katalitik dönüşüm türü için etkinlikleri nedeniyle asimetrik katalizde kullanılır.[18][19]
Amino asitlerin indirgenmesiyle hazırlanan 2-amino alkoller kullanılarak kiralite kolayca elde edilir; hem optik olarak saf hem de ucuzdurlar. Bu tür oksazolinlerdeki stereo merkez, koordinatör N atomuna bitişik olduğundan, metal merkezinde meydana gelen işlemlerin seçiciliğini etkileyebilir. Halka termal olarak stabildir[20] ve nükleofillere, bazlara, radikallere ve zayıf asitlere[21] karşı dirençlidir, ayrıca hidroliz ve oksidasyona karşı da oldukça dirençlidir;[2] dolayısıyla çok çeşitli reaksiyon koşullarında stabil kalması beklenebilir.
Oksazolin bazlı ligandın ana sınıfları şunları içerir:
Önemli özel oksazolin ligandları şunları içerir:
- Tris-oksazolinler (TRISOX)
- Bis(oksazolinato)lar
- Trisoksazolinilborat ligandları
Polimerler
[değiştir | kaynağı değiştir]2-etil-2-oksazolin gibi bazı 2-oksazolinler, poli(2-oksazolin)'leri oluşturmak üzere katyonik halka açılması polimerizasyonuna uğrar.[22] Bunlar poliamidlerdir ve peptidlerin analogları olarak kabul edilebilirler; çok sayıda potansiyel uygulamaya sahiptirler[23] ve biyomedikal kullanımları nedeniyle özel ilgi görmüştür.[24][25]
Yağ asitlerinin analizi
[değiştir | kaynağı değiştir]Yağ asitlerinin dimetiloksazolin (DMOX) türevleri gaz kromatografisi ile analiz edilebilir.
Ayrıca bakınız
[değiştir | kaynağı değiştir]Yapısal analoglar
- Benzoksazol : oksazolinin bir benzen halkasına kaynaştığı bir bileşik.
- Oksazol: iki çift bağa sahip olan
- Oksazolidin: Çift bağı olmayan
- Tiazolin: Oksijenin kükürt ile değiştirildiği bir analoğu
Diğer sayfalar
- Aminorex, oksazolin halkası taşıyan bir ilaç
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b Wenker, H. (1938). "Syntheses from Ethanolamine. V. Synthesis of Δ2-Oxazoline and of 2,2'-Δ2-Dioxazoline". Journal of the American Chemical Society. 60 (9). ss. 2152-2153. doi:10.1021/ja01276a036.
- ^ a b Wiley, Richard H.; Bennett, Leonard L. (1949). "The Chemistry of the Oxazolines". Chemical Reviews. 44 (3): 447-476. doi:10.1021/cr60139a002.
- ^ Frump, John A. (1971). "Oxazolines. Their preparation, reactions, and applications". Chemical Reviews. 71 (5): 483-505. doi:10.1021/cr60273a003.
- ^ Gant, Thomas G.; Meyers, A.I. (1994). "The chemistry of 2-oxazolines (1985–present)". Tetrahedron. 50 (8): 2297-2360. doi:10.1016/S0040-4020(01)86953-2.
- ^ Holerca, Marian N.; Percec, Virgil (2000). "1H NMR Spectroscopic Investigation of the Mechanism of 2-Substituted-2-Oxazoline Ring Formation and of the Hydrolysis of the Corresponding Oxazolinium Salts". European Journal of Organic Chemistry. 2000 (12): 2257-2263. doi:10.1002/1099-0690(200006)2000:12<2257::AID-EJOC2257>3.0.CO;2-2.
- ^ Albert I. Meyers; Mark E. Flanagan (1993). "2,2'-Dimethoxy-6-Formylbiphenyl". Org. Synth. 71: 107. doi:10.15227/orgsyn.071.0107.
- ^ r. Sardini, Stephen; Stoltz, Brian M. (2021). "Discussion Addendum for: Preparation of (S)-tert-ButylPy Ox and Palladium-Catalyzed Asymmetric Conjugate Addition of Arylboronic Acids". Organic Syntheses. 98: 117-130. doi:10.15227/orgsyn.098.0117. PMC 9558615 $2. PMID 36247231.
- ^ Vorbrüggen, Helmut; Krolikiewicz, Konrad (1993). "A simple synthesis of Δ2-oxazines, Δ2-oxazines, Δ2-thiazolines and 2-substituted benzoxazoles". Tetrahedron. 49 (41): 9353-9372. doi:10.1016/0040-4020(93)80021-K.
- ^ Schwekendiek, Kirsten; Glorius, Frank (2006). "Efficient Oxidative Synthesis of 2-Oxazolines". Synthesis. 2006 (18): 2996-3002. doi:10.1055/s-2006-950198.
- ^ Ishihara, Midori; Togo, Hideo (2007). "Direct oxidative conversion of aldehydes and alcohols to 2-imidazolines and 2-oxazolines using molecular iodine". Tetrahedron. 63 (6): 1474-1480. doi:10.1016/j.tet.2006.11.077.
- ^ Witte, Helmut; Seeliger, Wolfgang (1972). "Simple Synthesis of 2-Substituted 2-Oxazolines and 5,6-Dihydro-4H-1,3-oxazines". Angewandte Chemie International Edition in English. 11 (4): 287-288. doi:10.1002/anie.197202871.
- ^ Witte, Helmut; Seeliger, Wolfgang (1974). "Cyclische Imidsäureester aus Nitrilen und Aminoalkoholen". Justus Liebigs Annalen der Chemie. 1974 (6): 996-1009. doi:10.1002/jlac.197419740615.
- ^ Bolm, Carsten; Weickhardt, Konrad; Zehnder, Margareta; Ranff, Tobias (1991). "Synthesis of Optically Active Bis(2-oxazolines): Crystal Structure of a 1,2-Bis(2-oxazolinyl)benzene ZnCl2 Complex". Chemische Berichte. 124 (5): 1173-1180. doi:10.1002/cber.19911240532.
- ^ Makarycheva-Mikhailova, A. V.; Kukushkin, V. Y.; Nazarov, A. A.; Garnovskii, D. A.; Pombeiro, A. J. L.; Haukka, M.; Keppler, B. K.; Galanski, M. (2003). "Amidines Derived from Pt(IV)-Mediated Nitrile−Amino Alcohol Coupling and Their Zn(II)-Catalyzed Conversion into Oxazolines". Inorganic Chemistry. 42 (8): 2805-13. doi:10.1021/ic034070t. PMID 12691592.
- ^ i. Meyers, A.; Ann Hanagan, M.; l. Mazzu, A. (1981). "2-Oxazolines from Amides via Imidates". Heterocycles. 15: 361. doi:10.3987/S-1981-01-0361 (kapalı 2024-03-07).
- ^ Cornejo, A.; Fraile, J. M.; García, J. I.; Gil, M. J.; Martínez-Merino, V.; Mayoral, J. A.; Pires, E.; Villalba, I. (2005). "An Efficient and General One-Pot Method for the Synthesis of Chiral Bis(oxazoline) and Pyridine Bis(oxazoline) Ligands". Synlett (15): 2321-2324. doi:10.1055/s-2005-872672.
- ^ Aspinall, Helen C.; Bacsa, John; Beckingham, Oliver D.; Eden, Edward G. B.; Greeves, Nicholas; Hobbs, Matthew D.; Potjewyd, Frances; Schmidtmann, Marc; Thomas, Christopher D. (2014). "Adding the right (or left) twist to tris-chelate complexes – coordination chemistry of chiral oxazolylphenolates with M3+ ions (M = Al or lanthanide)" (PDF). Dalton Trans. 43 (3): 1434-1442. doi:10.1039/C3DT52366G. PMID 24201227. 9 Mayıs 2023 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 20 Temmuz 2024.
- ^ McManus, Helen A.; Guiry, Patrick J. (2004). "Recent Developments in the Application of Oxazoline-Containing Ligands in Asymmetric Catalysis". Chemical Reviews. 104 (9): 4151-4202. doi:10.1021/cr040642v. PMID 15352789.
- ^ Hargaden, Gráinne C.; Guiry, Patrick J. (2009). "Recent Applications of Oxazoline-Containing Ligands in Asymmetric Catalysis". Chemical Reviews. 109 (6): 2505-2550. doi:10.1021/cr800400z. PMID 19378971.
- ^ Loo, Yim Fun; O'Kane, Ruairi; Jones, Anthony C.; Aspinall, Helen C.; Potter, Richard J.; Chalker, Paul R.; Bickley, Jamie F.; Taylor, Stephen; Smith, Lesley M. (2005). "Deposition of HfO2 and ZrO2 films by liquid injection MOCVD using new monomeric alkoxide precursors". Journal of Materials Chemistry. 15 (19): 1896. doi:10.1039/B417389A.
- ^ Greene, T. W. (1991). Protective groups in organic synthesis, 2nd ed. New York: Wiley. ss. 265–266 & 433–436.
- ^ Kobayashi, Shiro; Uyama, Hiroshi (15 Ocak 2002). "Polymerization of cyclic imino ethers: From its discovery to the present state of the art". Journal of Polymer Science Part A: Polymer Chemistry. 40 (2): 192-209. doi:10.1002/pola.10090. Erişim tarihi: free. Tarih değerini gözden geçirin:
|erişimtarihi=(yardım) - ^ Hoogenboom, Richard (12 Ekim 2009). "Poly(2-oxazoline)s: A Polymer Class with Numerous Potential Applications". Angewandte Chemie International Edition. 48 (43): 7978-7994. doi:10.1002/anie.200901607. PMID 19768817.
- ^ Adams, Nico; Schubert, Ulrich S. (1 Aralık 2007). "Poly(2-oxazolines) in biological and biomedical application contexts". Advanced Drug Delivery Reviews. 59 (15): 1504-1520. doi:10.1016/j.addr.2007.08.018. PMID 17904246. 2 Ağustos 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Temmuz 2024.
- ^ Kelly, Andrew M; Wiesbrock, Frank (15 Ekim 2012). "Strategies for the Synthesis of Poly(2-Oxazoline)-Based Hydrogels". Macromolecular Rapid Communications. 33 (19): 1632-1647. doi:10.1002/marc.201200333. PMID 22811405.