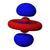
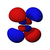
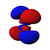
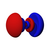
Atomska orbitala


(Grafički izrazi ψ funkcija)

Atomska orbitala je je matematička procjena dijela prostora u atomu kojem je najveća vjerovatnoća pojave elektrona.[1] Pritom se elektron zamišlja kao oblak negativnog naelektrisanja različite gustine, na osnovu čega se može registrirati njegovo prisustvo. Veličina ovog prostora zavisi od samog elektrona, iako se najčešće zadržava u blizini atomskog jezgra.[2][3]
Pregled
[uredi | uredi izvor]Smatra se da postoje s, p, d i f orbitale. Svaki s-podnivo sadrži jednu s-orbitalu, svaki p-podnivo sadrži tri p- orbitale, d-podnivo sadrži pet d-orbitala, a svaki f-podnivo sadrži sedam f-orbitala. U svakoj orbitali stanu po dva elektrona, tako da se, na osnovu atomskog broja, lahko određuje raspored elektrona po orbitalama.[4][5] [6][7]
Naprimjer: Magnezij ima redni broj 12, što je jednako broju protona, kao i elektrona (u osnovnom stanju, svaki atom je elektroneutralan). Prema tome, uređenost njegovih orbitala izgleda:
Svojstva elektrona
[uredi | uredi izvor]Sa razvojem kvantne mehanike i eksperimentalnih nalaza (kao što je dvoprorezna difrakcija elektrona), utvrđeno je da se u orbiti elektroni oko jezgra ne mogu u potpunosti opisati kao čestice, ali je potrebno objasniti dvojnost valne čestice. U tom smislu, elektroni imaju sljedeće osobine.
Valna svojstva:
- Elektroni ne kruže oko jezgra kao planeta oko Sunca, već postoje kao stojeći talasi. Najmanja moguća energija elektrona može se stoga uzeti kao analog fundamentalnoj frekvenciji vala na žici. Viša stanja energije su onda slična harmonici fundamentalne frekvencije.
- Elektroni nikada nisu u jednoj tački lokacije, iako se vjerovatnost interakcije s elektrona u jednom trenutku može procijeniti iz valne funkcije elektrona.
Svojstva koja liče na čestice:
- Oko jezgra uvijek kruži cijeli broj elektrona.
- Elektroni skok između orbitala se odvija u česticama sličnom oblikuu. Naprimjer, ako je jedan foton udari u elektron, javlja se samo jedna elektronska promjena, u odgovoru na foton.
- Elektroni zadržavaju svojstva slična česticama, kao što su: svaka stupanj vala ima isti električni naboj kao elektronska čestica. Svaki od njih ima jedan diskretan spin (gore ili dolje).
Stoga, bez obzira na očiglednu analogiju sa okretanjem planeta oko Sunca, elektroni se ne mogu opisati samo kao čvrste čestica. Pored toga, atomske orbitale u običnim atoma ne liče na elipsoidne putanje planeta. Tačnija analogija može biti da se velika i često čudno oblikovana "atmosfera" (elektrona), distribuira oko relativno malene planete (atomskog jezgra). Atomske orbitale tačno opisuju oblik ove "atmosfera" samo kada je prisutan elektron jednog atoma. Kada se više elektrona pridoda na jedan atom, dodatni elektroni imaju tendenciju da ravnomjernije popune prostor oko jezgra, a rezultat je njihovo prikupljanje (ponekad nazivano "elektronski oblak" ); ono teži ka generalno sfernoj zoni vjerojatnosti, opisujući gdje će se naći elektron atoma.
Formalna kvantno-mehanička definicija
[uredi | uredi izvor]Atomske orbitale se mogu preciznije definirati u formalnom jeziku kvantne mehanike. Naime, u kvantnoj mehanici, stanje atoma je aproksimirana ekspanzija linearne kombinacije anti-simetriziranog proizvoda (Slater determinanta) jedne elektronske funkcije. Prostorne komponente ovih jednoelektronskih funkcija pozivaju atomskih orbitala. (Kada se uzme u obzir i njihov spin komponenta, riječ je o orbitali atomskog spina). A stanje je zapravo funkcija koordinata svih elektrona, tako da je njihovo kretanje u korelaciji, ali to je često aproksimirano modelom nezavisne čestica proizvoda vala pojedinačnih funkcija elektrona. (London disperzijska sila, naprimjer, ovisi o korelaciji kretanja elektrona.)
U atomskoj fiziici, atomska spektralna linija odgovara tranziciji (kvantnih skokova) između kvantnih stanja atoma. Ova stanje su označena skupom kvantnih brojeva sažetih u simbolski pojam i obično swe povezuje sa posebnim elektronskim konfiguracijama, odnosno, po shemi atomskih orbitala (naprimjer, 1s22s22p6 za stanje osnove neona simbol-oznaka: 1S0).
Ova notacija znači da je odgovarajuća Slaterova determinanta ima jasnu veću težinu u proširenoj interakciji konfiguracije. Koncepte atomske orbitale je stoga ključni koncept za vizualizaciju procesa pobuđivanja, povezanog sa datom tranzicijom. Naprimjer, to se može reći za tranziciju s obzirom da odgovara na pobude elektrona iz okupirane orbitale u datoj praznoj orbitali. Ipak, treba imati na umu da su elektroni fermioni koji se ponašaju po principu Paulijevog isključenja i ne mogu se razlikovati od ostalih elektrona u atomu. Osim toga, ponekad se dogodi da je interakcija širenje konfiguracije konvergira vrlo sporo i da se ne može govoriti o jednostavnoj funkciji jednotalasne determinante na sve. To je slučaj kada je velika korelacija elektrona. U osnovi, atomska orbitala je funkcija jednoelektronskog vala, iako je većina elektrona ne postoje u jednom atomskom elektronu, pa je tako takav val aproksimacija.
Vrste orbitala
[uredi | uredi izvor]
(f i više orbitale nisu prikazane)
Atomske orbitale mogu biti kao vodikova orbitala i koje su tačna rješenja za Schrödingerova jednadžba|Schrödingerovu jednadžbu]] za atome slične vodiku (tj. atoma s jednim elektronom). Alternativno, atomske orbitala se odnose na funkcije koje ovise o koordinatama jednog elektrona (tj. orbitale), ali se koriste kao polazne osnove za približavanje valne funkcije koja ovisi o istovremenim koordinatama svih elektrona u atomu ili molekuloi. Koordinatni sistemi za atomske orbitale su obično sferne koordinate (r, θ, φ) u atomima i kartezijske (x, y, z) u poliatomskim molekulama. Prednost sfernih koordinata (za atome) je da je funkcija orbitnog vala proizvod tri faktora, od kojih svaki ovisi o jednoj koordinati:
- ψ (r, θ, φ) = R (r) Θ (θ) Φ (φ).
Ugaoni faktori atomskih orbitala Θ (θ) Φ (φ) generiraju e, p, d, itd funkcije kao prave kombinacije sfernih harmonika Yℓm (θ, φ) (gdje su ℓ i m kvantni brojevi).
Postoje tri matematička obrasca za radijalne funkcije R (r) koji se mogu birati kao polazište za izračunavanje svojstava atoma i molekula s mnogo elektrona:
- Atomske orbitale slične vodiku su izvedene iz točnog rješenja Schrödingerove jednačine za jedan elektron i jezgro, za atome poput vodika. Dio funkcije koja ovisi o udaljenosti od jezgra ima radijalne čvorove i opada kao e–konstanta × udaljenost.
- Orbitale Slater tipa (STO) je forma bez radijalnih čvorova, ali opada iz jezgra kao što to čini vodiku slična orbitala.
- Orbitale Gausseovog tipa (Gaussovih raspodjela) nemaju radijalne čvorove i opada kao e –udaljenost na kvadrat.
Iako se vodikolike orbitale i dalje koriste kao pedagoški alat, pojavom kompjutera, STO se pokazao kao bolji metod za atome i molekule diatomskih kombinacija. STO može zamijeniti i čvorove u vodonikolikim atomskim orbitalnama. Gausova raspodjela se obično koristi u molekulama s tri ili više atoma. Iako nije toliko precizan kao STO, kombinacija mnogih Gausovih raspodela može postići preciznost vodonik orbitala kao kod vodika.
Tabela orbitala
[uredi | uredi izvor]Tabela ispod prikazuje orbitalne konfiguracije za stvarne vodikoloke valne funkcije 7. i stoga pokriva jednostavne elektronske konfiguracija za sve elemente u periodnom sistemu do radija. ψ grafikoni su prikazani sa – i + valna funkcija, a faze su prikazane u dvije različite boje (proizvoljno crvena i plava). Na PZ orbitalni je isti kao i P0 orbitalne, ali Px i PY formiraju uzimanjem linearnim kombinacije P + 1 i P - 1 orbitale (što je razlog zašto su navedeni pod M = ± 1 etiketu). Također, P + 1 i P - 1 nisu isti oblik kao i pz orbitala je is ista kao p0 orbitala, ali px u py su formirane uzevši linearne kombinacije p+1 i p−1 orbitale (koja je zato prikazana ispod m = ±1 obilježavanja). Također,p+1 i p−1 nisu istog oblika kao p0, budući da su čista sferna harmonika.
Reference
[uredi | uredi izvor]- ^ Orchin M., Macomber R. S., Pinhas A., Wilson R. M. (2005): Atomic orbital theory, http://media.wiley.com/product_data/excerpt/81/04716802/0471680281.pdf.
- ^ Daintith J.(2004): Oxford dictionary of chemistry. Oxford University Press, New York, ISBN 978-0-19-860918-6.
- ^ Levine I. (2000): Quantum chemistry. Prentice Hall, Upper Saddle River, New Jersey, ISBN 978-0-13-685512-5.
- ^ Weast R. C., Ed. (1990): CRC Handbook of chemistry and physics. Chemical Rubber Publishing Company, Boca Raton, ISBN 0-8493-0470-9.
- ^ Laidler K. J. (1978): Physical chemistry with biological applications. Benjamin/Cummings, Menlo Park, ISBN 0-8053-5680-0.
- ^ Atkins P., de Paula J. (2006): Physical chemistry, 8th Ed. W. H. Freeman, San Francisco, ISBN 0-7167-8759-8
- ^ Binder H. H. (1999): Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart, ISBN 3-7776-0736-3.