Fotohemija


Fotohemija je grana hemije koja se bavi hemijskim efektima svjetlosti. Općenito, ovaj termin koristi se za opisivanje hemijske reakcije uzrokovane apsorpcijom ultraljubičastog (talasna dužina od 100 do 400 nm), vidljiva svjetlost (400–750 nm) ili infracrveno zračenje (750–2500 nm).[1]
U prirodi je fotohemija od ogromne važnosti jer je osnova fotosinteze, vida i stvaranja vitamina D sunčevom svjetlošću.[2] Fotohemijske reakcije odvijaju se drugačije od reakcija izazvanih temperaturom. Fotohemijski putevi pristupaju visokoenergetskim međuproizvodima koji se ne mogu generirati termički, čime se prevazilaze velike aktivacijske barijere u kratkom vremenskom periodu i omogućavaju reakcije koje inače nisu dostupne termalnim procesima. Fotohemija je također destruktivna, kao što ilustruje fotodegradacija plastike.
Koncept
[uredi | uredi izvor]Grotthuss–Draperov zakon i Stark–Einsteinov zakon
[uredi | uredi izvor]Fotoekscitacija je prvi korak u fotohemijskom procesu gdje se reaktant podiže u stanje više energije, pobuđeno stanje. Prvi zakon fotohemije, poznat kao Grotthuss–Draper zakon (po hemičarima Theodoru Grotthussu i Johnu W. Draperu), navodi da svjetlost mora biti apsorbovana hemijskom supstancom da bi se odigrala fotohemijska reakcija. Prema drugom zakonu fotohemije, poznatom kao Stark-Einstein zakon (po fizičarima Johannesu Starku i Albertu Einsteinu), za svaki foton svjetlosti apsorbuje hemijski sistem, ne aktivira se više od jedne molekule za fotohemijsku reakciju, kao što je definisano kvantnim prinosom.[3][4]
Principi
[uredi | uredi izvor]U slučaju fotohemijskih reakcija, svjetlost daje aktivacijsku energiju. Pojednostavljeno, svjetlost je jedan mehanizam za obezbjeđivanje energije aktivacije potrebne za mnoge reakcije. Ako se koristi lasersko svjetlo, moguće je selektivno pobuditi molekulu kako bi se proizvelo željeno elektronsko i vibracijsko stanje.[5] Jednako tako, emisija iz određenog stanja može se selektivno pratiti, obezbjeđujući mjeru populacije tog stanja. Ako je hemijski sistem pod niskim pritiskom, to omogućava da se posmatraju distribucija energije proizvoda hemijske reakcije prije nego što su razlike u energiji razmazane i usrednjene ponovljenim sudarima.
Apsorpcija fotona svjetlosti molekule reaktanta također može omogućiti reakciju, ne samo dovođenjem molekule do potrebne aktivacijske energije, već i promjenom simetrije elektronske konfiguracije molekula, omogućavajući inače nepristupačan put reakcije, kao što je opisano Woodward-Hoffmannovim pravilima selekcije. Reakcija cikloadicije 2+2 je jedan primjer periciklične reakcije, koja se može analizirati korištenjem ovih pravila ili srodne teorije granice molekulske orbitale.
Neke fotohemijske reakcije su nekoliko redova veličine brže od termičkih reakcija; često se opažaju reakcije brže od 10−9 sekundi i povezani procesi brzi od 10−15 sekundi.
Foton se može apsorbirati direktno reaktantom ili pomoću fotosenzibilizatora, koji apsorbira foton i prenosi energiju na reaktant. Suprotan proces se naziva gašenje kada se fotopobuđeno stanje deaktivira hemijskim reagensom.
Većina fotohemijskih transformacija odvija se u nizu jednostavnih koraka poznatih kao primarni fotohemijski procesi. Jedan uobičajen primjer ovih procesa je prijenos protona u pobuđenom stanju.
Fotohemijske reakcije
[uredi | uredi izvor]Primjeri fotohemijskih reakcija
[uredi | uredi izvor]- Fotosinteza: biljke koriste sunčevu energiju da pretvore ugljik-dioksid i vodu u glukozu i kisik.
- Ljudsko stvaranje vitamina D izlaganjem sunčevoj svetlosti.
- Bioluminiscencija: npr. Kod svitaca, enzim u abdomenu katalizira reakciju koja proizvodi svjetlost.[6]
- Polimerizacije započete putem fotoinicijatora, koji se razlažu pri apsorpciji svjetlosti da bi proizveli slobodne radikale za radikalnu polimerizaciju.
- Fotodegradacija mnogih supstanci, npr. polivinil-hlorida i Fp. Bočice za lijekove se često prave od zatamnjenog stakla kako bi se spriječila fotodegradacija lijekova.
- Fotohemijska preuređivanja, npr. fotoizomerizacija, prijenos atoma vodika i fotohemijske elektrocikličke reakcije.[7][8]
- Fotodinamička terapija: svjetlost se koristi za uništavanje tumora, djelovanjem jednostrukog kisika koji nastaje fotosenzibiliziranim reakcijama tripletnog kisika. Tipski fotosenzibilizatori uključuju tetrafenilporfirin i metilensko plavo. Dobijeni singletni kisik je agresivan oksidans, sposoban da konvertuje C–H veze u C–OH grupe.
- Proces dijazo štampanja
- Fotoresist tehnologija, koja se koristi u proizvodnji mikroelektronskih komponenti.
- Viđenje se pokreće fotohemijskom reakcijom rodopsina.[9]
- Torayeva fotohemijska proizvodnja ε-kaprolaktama.[10]
- Fotohemijska proizvodnja artemizinina, lijeka protiv malarije.[11][12]
- Fotoalkilacija koristi se za dodavanje alkil grupa molekulama izazvano svjetlom.
Organska fotohemija
[uredi | uredi izvor]Primjeri fotokemijskih organskih reakcija su elektrocikličke reakcije, radikalne reakcije, fotoizomerizacija i Norrishka reakcija.[13][14]
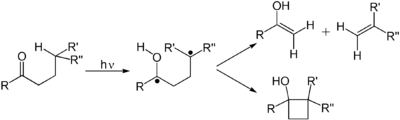
Alkeni se podvrgavaju mnogim važnim reakcijama koje se odvijaju preko fotonski induciranog π u π* prijelaza. Prvo elektronsko pobuđeno stanje alkena nema π-vezu, tako da je rotacija oko C–C veze brza i molekula se uključuje u reakcije koje se ne opažaju termički. Ove reakcije uključuju cis-trans izomerizaciju, cikloadiciju na drugo (osnovno stanje) alkena da bi se dobili ciklobutanski derivati. Cis-trans izomerizacija (poli)alkena je uključena u retinal, komponentu mehanizma vida. Dimerizacija alkena je relevantna za fotooštećenje DNK, gde se dimerni timini primećuju pri osvetljavanju DNK UV zračenjem. Takvi dimeri ometaju transkripciju. Blagotvorni efekti sunčeve svetlosti povezani su sa fotohemijski izazvanom reakcijom retrociklizacije (deciklizacije) ergosterola da bi se dobio vitamin D. U DeMayovoj reakciji, alken reaguje sa 1,3-diketonom, preko svog enola da bi se dobio 1,5-diketon. Još jedna uobičajena fotohemijska reakcija je Zimmermanov Di-pi-metanski rearanžman.
U industrijskoj primjeni, pripremi se oko 100.000 tona benzil-hlorida godišnje, fotohemijskom reakcijom toluena sa hlorom u olinskoj fazi.[15] Molekula hlora apsorbuje svjetlost, a niska energija ovog prijelaza je naznačena žućkastom bojom plina. Foton inducira homolizu Cl–Cl veze, a rezultujući radikal hlora pretvara toluen u benzil-radikal:
- Cl2 + hν → 2 Cl·
- C6H5CH3 + Cl· → C6H5CH2· + HCl
- C6H5CH2· + Cl· → C6H5CH2Cl
Merkaptani se mogu proizvesti fotohemijskim dodavanjem vodik-sulfida (H2S) u alfa olefinu.
Neorganska i organometalna fotohemija
[uredi | uredi izvor]Koordinacioni kompleksi i organometalni spokevi također su fotoreaktivni. Ove reakcije mogu dovesti do cis-trans izomerizacije. Češće fotoreakcije rezultiraju disocijacijom liganada, budući da foton pobuđuje elektron na metalu na orbitalu koja je antivezujuća u odnosu na ligande. Dakle, metalni karbonili koji se odupiru termalnoj supstituciji podliježu dekarbonilaciji nakon zračenja UV svjetlom. UV zračenje rastvora THF molibden-heksakarbonila daje THF kompleks, koji je sintetski koristan:
U srodnoj reakciji, fotoliza gvožđe-pentakarbonila daje diiron- nonakarbonil (vidi sliku):
- 2 Fe(CO)5 → Fe2(CO)9 + CO
Odabrani fotoreaktivni koordinacioni kompleksi mogu biti podvrgnuti oksidaciono-redukcionim procesima putem preijnosa jednog elektrona. Ovaj prijenos elektrona može se dogoditi unutar unutrašnje ili vanjske koordinacione sfere metala.[16]
Također pogledajte
[uredi | uredi izvor]- Fotonska molekula
- Fotoelektrohemijska ćelija
- Fotohemijska logička kapija
- Fotosinteza
- Reakcije zavisne od svjetlosti
- Izvori pojedinačnih fotona
- Fotogeohemija
- Fotoelektrični efekat
- Fotoliza
Reference
[uredi | uredi izvor]- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "photochemistry". doi:10.1351/goldbook.P04588
- ^ Glusac, Ksenija (2016). "What has light ever done for chemistry?". Nature Chemistry. 8 (8): 734–735. Bibcode:2016NatCh...8..734G. doi:10.1038/nchem.2582. PMID 27442273.
- ^ Calvert, J. G.; Pitts, J. N. Photochemistry. Wiley & Sons: New York, US, 1966. Congress Catalog number: 65-24288
- ^ Photochemistry, website of William Reusch (Michigan State University), accessed 26 June 2016
- ^ Menzel, Jan P.; Noble, Benjamin B.; Lauer, Andrea; Coote, Michelle L.; Blinco, James P.; Barner-Kowollik, Christopher (2017). "Wavelength Dependence of Light-Induced Cycloadditions". Journal of the American Chemical Society. 139 (44): 15812–15820. doi:10.1021/jacs.7b08047. hdl:1885/209117. ISSN 0002-7863. PMID 29024596.
- ^ Saunders, D. S. (11. 11. 2002). Insect Clocks, Third Edition. str. 179. ISBN 0444504079.
- ^ Lefebvre, Corentin; Hoffmann, Norbert (1. 1. 2021), Török, Béla; Schäfer, Christian (ured.), "Chapter Eight - Photochemical rearrangements in organic synthesis and the concept of the photon as a traceless reagent", Nontraditional Activation Methods in Green and Sustainable Applications, Advances in Green and Sustainable Chemistry (jezik: engleski), Elsevier, str. 283–328, doi:10.1016/b978-0-12-819009-8.00008-6, ISBN 978-0-12-819009-8, pristupljeno 24. 1. 2022
- ^ Lefebvre, Corentin; Fortier, Lucas; Hoffmann, Norbert (2020). "Photochemical Rearrangements in Heterocyclic Chemistry". European Journal of Organic Chemistry (jezik: engleski). 2020 (10): 1393–1404. doi:10.1002/ejoc.201901190. ISSN 1099-0690.
- ^ Dugave, Christophe (6. 10. 2006). Cis-trans Isomerization in Biochemistry. str. 56. ISBN 9783527313044.
- ^ Protti, Stefano; Fagnoni, Maurizio (2009). "The sunny side of chemistry: Green synthesis by solar light". Photochemical & Photobiological Sciences. 8 (11): 1499–516. doi:10.1039/B909128A. PMID 19862408.
- ^ Peplow, Mark (17. 4. 2013). "Sanofi launches malaria drug production". Chemistry World.
- ^ Paddon, C. J.; Westfall, P. J.; Pitera, D. J.; Benjamin, K.; Fisher, K.; McPhee, D.; Leavell, M. D.; Tai, A.; Main, A.; Eng, D.; Polichuk, D. R. (2013). "High-level semi-synthetic production of the potent antimalarial artemisinin". Nature (jezik: engleski). 496 (7446): 528–532. doi:10.1038/nature12051. ISSN 0028-0836. PMID 23575629.
- ^ Klán, Petr; Wirz, Jakob (23. 3. 2009). Photochemistry of Organic Compounds: From Concepts to Practice. ISBN 978-1405190886.
- ^ Turro, Nicholas J.; Ramamurthy, V.; Scaiano, Juan C. (2010). Modern Molecular Photochemistry of Organic Molecules. ISBN 978-1891389252.
- ^ Rossberg, Manfred; Lendle, Wilhelm; Pfleiderer, Gerhard; Tögel, Adolf; Dreher, Eberhard-Ludwig; Langer, Ernst; Rassaerts, Heinz; Kleinschmidt, Peter; Strack, Heinz; Cook, Richard; Beck, Uwe; Lipper, Karl-August; Torkelson, Theodore R.; Löser, Eckhard; Beutel, Klaus K.; Mann, Trevor (2006). "Chlorinated Hydrocarbons". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a06_233.pub2. ISBN 3527306730.
- ^ Balzani, Vincenzo; Carassiti, Vittorio (1970). Photochemistry of Coordination Compounds. New York, New York: Academic Press, Inc. str. 37–39. ISBN 9780120772506.
Dopunska literatura
[uredi | uredi izvor]- Bowen, E. J., Chemical Aspects of Light. Oxford: The Clarendon Press, 1942. 2nd edition, 1946.
- Photochemistry