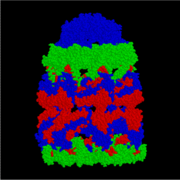
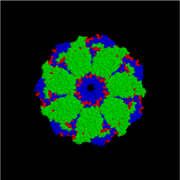
GroEL

GroEL je protein koji pripada porodici molekulskih šaperona pratioca, a nalazi se u velikom broju bakterija Potreban je za efikasno savijanje mnogih proteina. Da bi učinkovito funkcionirao, GroEL zahtijeva kompleks poklopca GroES, povezan s proteinima. Kod eukariota to su proteini Hsp60 i Hsp10, strukturno i funkcionalno gotovo identični GroEL-u odnosno GroES-u.[5] Slična struktura proteina postoji u hloroplastima određenih biljaka. Ovo prisustvo proteina pruža dokaze o evolucijskoj vezi razvoja mitohondrija i hloroplasta preko endosimbioze.[6]
Mehanizam djelovanja
[uredi | uredi izvor]U ćeliji, GroEL/ES posredovani proces savijanja proteina uključuje brojne sekvence vezanja, enkapsulacija i oslobađanja proteinsdkog supstrata.[7] Nesavijeni supstratni proteini vežu se za hidrofobno područje na unutrašnjem rubu otvorene šupljine GroEL-a, formirajući binarni kompleks sa šaperonino. Vezanje proteindkog supstrata na ovaj način, pored ATP-vezanja, dovodi do konformacijske modifikacije koja omogućava pridruživanje binarnog kompleksa sa različitom strukturom poklopca, GroES. Veza GroES-a sa otvorenom šupljinom šaperonina uzrokuje da se pojedine podjedinice šaperonina rotiraju, tako da se vezani hidrofobni supstrat ukloni iz unutrašnjosti šupljine, što izaziva izbacivanje supstratnog proteina iz ruba u sada hidrofilnu komoru. Hidrofilna sredina komore omogućava uvezivanje hidrofobnih ostatka supstrata, što inducira savijanje supstrata. Hidroliza ATP-a i vezanje novog supstratnog proteina u suprotnoj šupljini šalje alosterni signal, koji uzrokuje oslobađanje GroES-a i enkapsuliranih proteina u citosolu. Dati protein će se podvrći nekoliko sklopivih ciklusa, svaki put vraćajući se u prvobitno nesavijeno stanje, dok se ne proizvede izvorna konformacija ili posredna struktura namijenjena za „domorodačko“ stanje. Alternativno, supstrat se može denaturirati tokom konkurentne reakcije, kao što su loše sklapanje ili agregacija sa drugim slabo presavijenim proteinima
Termodinamika reakcije
[uredi | uredi izvor]Kontraktilna priroda unutrašnjosti molekularnog kompleksa snažno favorizira kompaktne molekulske konformacije supstratnog proteina. U rastvoru, apolarne i dalekometne interakcije mogu se pojaviti samo u ovom slučaju sa značajnim troškom u entropiji. U zatvorenim prostorima GroEL kompleksa, relativni gubitak entropije je mnogo manji. Metod hvatanja također teži da koncentrira apolarna mjesta vezanja, odvojeno od polarnih mjesta. Kada se GroEL-ova apolarna površina ukloni, šansa da bi bilo koja data apolarna grupa mogla naići na intramolekulsko apolarno mjesto je daleko veća nego u rastvoru. Hidrofobna nalazišta koja su vani okupljena su na vrhu CIS domena i međusobno povezana. GroEL-ova geometrija zahtijeva da polarne strukture budu motorne, a one omotavaju apolarnu srž kada izađu sa trans-strane.
Struktura
[uredi | uredi izvor]
GroEL je strukturno dvostruko prstenasti tetradar, sa cis i trans prstenovima koji se sastoje od po sedam podjedinica. Unutrašnjost GroEL-a je hidrofobna i tu bi trebalo da se oiviči proteinsko savijanje.
- GroEP (bočno)
- GroEL (gore)
- Kompleksni GroES/GroEL (bočno)
- GroES/GroEL kompleks (gore)
Ključ GroEL-ove aktivnosti je u strukturi monomera. Monomer Hsp60 ima tri različita dijela, odvojena sa dvije pivotne regije. Apeksna regija sadrži veliki broj mjesta vezanja za nesavijene proteinske supstrate. Mnogi globularni proteini se neće vezati za ovu apeksnu regiju jer su njihovi hidrofobni dijelovi unutrašnji, daleko od vodenog medija, u konformaciji koja je im je favorizirala termodinamiku. Kao rezultat toga, ova "supstratna mjesta" se vežu samo sa proteinima koji nisu optimalno presavijeni. Ta vršna regija ima i obavezujuća mjesta za GroES Hsp10 monomere.
Ekvatorski domen ima lokaciju u blizini ključne tačke za povezivanje ATP-a, kao i dvije spojne tačke za drugu polovicu GroEL molekule. Ostatak ekvatorijalne regije je umjereno hidrofilan.
Dodavanje ATP-a i GroES-a dovodi do radikalne promjene u konformaciji CISregije. Uzrokovan je savijanjem i rotacijom Hsp60 monomera na tačkama šarke. Srednji region se savija prema unutra, oko 25 stepeni od najniže šarke. Ovaj efekt, pomnožen kooperativnim sklopilom monomera, povećava ekvatorijalni promjer GroEL kafeza. Ali apski domen se rotira za 60 stepeni prema van u odnosu na gornje šarke, a također i 90 stepeni oko osi šarke. Ovo kretanje otvara kafez široko iznad cis regiona, ali uklanja sva mjesta koja se vežu iz unutrašnjosti.[8] Ova je struktura obično u ravnoteži sa svakom od njenih pojedinačnih komponenti: monomerima, heptamerima i tetradeceamerima.[9] Nedavna istraživanja sugerirala da se, pored svog tipskog položaja u mitohondrijama, HSP60 može naći i u citoplazmi u normalnim fiziološkim uvjetima.
Svaka podjedinica HSP60 ima tri domena: apikalni (vršni), ekvatorski i srednji (intermedijarni) domen. Ekvatorski sadrži mesto vezanja za ATP i za drugi heptamerni prsten. Srednji domen povezuje skupa ekvatorski i apikalni domen.[10] Intermedijerni domen izaziva konformacijsku promjenu kada je ATP vezan, omogućavajući izmjenu između hidrofilnih i hidrofobnih mjesta vezanja supstrata. U svom neaktivnom stanju protein je u hidrofobnom stanju. Kad se aktivira pomoću ATP-a, ovaj domen podliježe konformacijskoj promjeni, koja izlaže hidrofilno područje. Ovo osigurava vjernost u vezanju s proteinima.[10] Šaperonin 10 pomaže HSP60 u presavijanju, djelujući kao kupolasti pokrov na aktivnom ATP obliku HSP60. To dovodi do povećanja centralne šupljine i pomaže u savijanju proteina.[10]

Antitelo otkriva ćelijske mitohondrije u crvenoj boji. Plavi signal je posljedica boje koja veže DNK i otkriva ćelijska jedra.
Bojenje antitela i slika ljubaznošću kompanije EnCor Biotechnology Inc.

Sekvenca mitohondrijskog HSP60 sadrži niz ponavljanja G na C-kraju. Struktura i funkcija ove sekvence nisu sasvim poznati. N-kraj sadrži predsekvencu hidroksiliranih aminokiselina: arginin, lizin, serin i treonin, koji služe kao usmjerivači za unos proteina u mitohondrije.
Predviđena struktura HSP60 uključuje nekoliko vertikalnih sinusnih talasa, alfa-heliksa, beta-listova i rotiranja za 90 stepeni. Postoje regije hidrofobnosti u kojima se protein vjerojatno proteže kroz membranu. Postoje i tri N-vezana mjesta glikozilacije na pozicijama 104, 230, 436. Sekvenca i sekundarna struktura za mitohondrijski protein ilustrirani su gornjom slikom dobivenom iz banke proteinskih podataka.
Noviji podaci sugeriraju da se HSP60 pronađen u mitohondrijima razlikuje od onog u citoplazmi. Što se tiče aminokiselinske sekvence, citoplazmatski HSP60 ima sekvencu N-kraja koja nije pronađena u mitohondrijskom proteinu. U analizi gelnom elektroforezom, pronađene su značajne razlike u migraciji citoplazmatskih i mitohondrijskih HSP60. Citoplazmatski HSP60 sadrži signalnu sekvencu od 26 aminokiselina na N-kraju. Ova sekvenca je visoko degenerirana i sposobna je da se presavije u amfifilnu spiralu. Antitijela protiv HSP60 ciljaju i mitohondrijski i citoplazmatski oblik.[5] Ipak, antitela protiv signalne sekvence usmjerenea su samo na citoplazmatski oblik. U normalnim fiziološkim uvjetima, oboje se nalaze u relativno jednakim koncentracijama.[5] U vrijeme stresa ili velike potrebe za HSP60 bilo u citoplazmi ili u mitohondrijima, ćelija je sposobna za kompenzaciju, povećavanjem prisustva HSP60 u C–1[12] Proteini toplotnog šoka, prvenstveno su odgovorni za održavanje integriteta ćelijskih proteina, posebno kao odgovor na promjene u okolini. Stresovi poput temperature, neravnoteže koncentracije, promjene pH i toksina mogu podstaknuti sve proteine toplotnog šoka da održe konformaciju ćelijskih proteina. HSP60 pomaže u presavijanju i održavanju konformacije približno 15-30% svih ćelijskih proteina. Pored tipske uloge HSP60 kao proteina toplotnog šoka, studije su pokazale da ima i važnu ulogu u transportu i održavanju mitohondrijskih proteina, kao i transmisiji i replikaciji mitohondrijskih DNK.
Transport proteina u mitohondrijama
[uredi | uredi izvor]HSP60 ima dvije glavne uloge u pogledu transporta mitohondrijskih proteina. Funkcionira da katalizira presavijanje proteina namijenjenih matrici i održava protein u rasklopljenom stanju za transport kroz unutrašnju membranu mitohondrija.[13] Mnogi proteini su ciljani za preradu u matriksu mitohondrija, ali se zatim brzo iznose u druge dijelove ćelije. Hidrofobni dio HSP60 odgovoran je za održavanje nerazvijene konformacije proteina za transmembranski transport. Studije su pokazale kako se HSP60 veže za dolazne proteine i izaziva konformacijske i strukturne promjene. Naknadne promjene u koncentracijama ATP hidroliziraju veze između proteina i HSP60, što signalizira proteinu da izađe iz mitohondrija. HSP60 je također sposoban razlikovati proteine namijenjene izvozu i proteine koji će ostati u matrici mitohondrija u potrazi za amfifilnim alfa-heliksom od 15-20 ostataka. Postojanje ove sekvence signalizira da protein treba izvesti, dok odsustvo signalizira da protein treba ostati u mitohondrijima . Precizan mehanizam još nije u potpunosti poznat.
Metabolizam DNK
[uredi | uredi izvor]Pored svoje ključne uloge u presavijanju proteina, HSP60 je uključen u replikaciju i prenos mitohondrijske DNK. U opsežnim studijama aktivnosti HSP60 u Saccharomyces cerevisiae, istraživači su predložili da se HSP60 preferencijalno veže za jednolančani predložak DNK.[14]Mutacije u HSP60 povećavaju nivo mitohondrijske DNK i rezultiraju naknadnim defektima prenosa.
Citoplazmatskii vs mitohondrijski HSP60
[uredi | uredi izvor]Pored već ilustriranih strukturnih razlika između citoplazmatskog i mitohondrijskog HSP60, postoje i značajne funkcionalne razlike. Studije su sugerirale da HSP60 ima ključnu ulogu u prevenciji apoptoze u citoplazmi. Citoplazmatski HSP60 tvori kompleks sa proteinima odgovornim za apoptozu i regulira aktivnost tih proteina. Citoplazmatska verzija također je uključena u imunski odgovor i rak. Bliska nedavna istraživanja započela su sugerirati regulatornu korelaciju između HSP60 i glikolitskog enzima 6 - fosfofruktokinaza-1. Iako nema mnogo podataka, koncentracije citoplazmatskog HSP60 uticale su na ekspresiju 6-fosfofruktokinaze u glikolizi.[15] Unatoč ovim izraženim razlikama između citoplazmatskog i mitohondrijskog oblika, eksperimentalna analiza pokazala je da je ćelija brzo sposobna da premjesti citoplazmatski HSP60 u mitohondrije ako uslovi okoline zahtijevaju veće prisustvo mitohondrijskog HSP60.[5]
Sinteza i sklapanje
[uredi | uredi izvor]HSP60 se obično nalazi u mitohondrijama i pronađen je u organelama endosimbiotskog porijekla. HSP60 monomere tvore dva heptamerna prstena, koji se vežu za površinu linearnih proteina i kataliziraju njihovo savijanje u procesu ovisnom o ATP-u.[16] Podjedinice HSP60 kodiraju se jedarnim genima] i prevode u citosol. Te se podjedinice zatim premještaju u mitohondrije, gdje ih obrađuju druge molekule HSP60. Nekoliko studija pokazalo je kako proteini HSP60 moraju biti prisutni u mitohondrijama za sintezu i sastavljanje dodatnih komponenata HSP60. Postoji direktna pozitivna korelacija između prisustva proteina HSP60 u mitohondrijama i proizvodnje dodatnih kompleksa proteina HSP60.
Kinetika sastavljanja podjedinica HSP60 u 2-heptamerne prstenove traje dvije minute. Naknadni, proteaza-rezistentni HSP60 nastaje u poluvremenu od 5–10 minuta. Ova brza sinteza ukazuje da postoji interakcija ovisne o ATP-u, gdje formirani kompleks HSP60 stabilizira intermedijer kompleksa za sastavljanje HSP60, koji efektivno služi kao katalizator. Potreba prethodno postojećeg HSP60, kako bi se sintetizirale dodatne molekule HSP60, podržava teoriju endosimbiotskog porijekla mitohondrija. Sigurno je postojao rudimentni prokariotski homologni protein koji je bio sposoban za sličan samookupljanje i smanjenje koncentracije u suprotnom odjeljku.
Interakcije
[uredi | uredi izvor]GroEL je pokazao da je u interakciji sa GroES-om4,5, ALDH25, kaspasa 34,6 i dihidrofolat-reduktazom.
Reference
[uredi | uredi izvor]- ^ a b c GRCh38: Ensembl release 89: ENSG00000144381 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000025980 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d Itoh H, Komatsuda A, Ohtani H, et al. (decembar 2002). "Mammalian HSP60 is quickly sorted into the mitochondria under conditions of dehydration". Eur. J. Biochem. 269 (23): 5931–8. doi:10.1046/j.1432-1033.2002.03317.x. PMID 12444982.
- ^ Gupta RS (januar 1995). "Evolution of the chaperonin families (Hsp60, Hsp10 and Tcp-1) of proteins and the origin of eukaryotic cells". Mol. Microbiol. 15 (1): 1–11. doi:10.1111/j.1365-2958.1995.tb02216.x. PMID 7752884.
- ^ Zeilstra-Ryalls J, Fayet O, Georgopoulos C (1991). "The universally conserved GroE (Hsp60) chaperonins". Annu. Rev. Microbiol. 45: 301–25. doi:10.1146/annurev.mi.45.100191.001505. PMID 1683763.
- ^ Fenton WA, et al. (oktobar 1994). "Residues in chaperonin GroEL required for polypeptide binding and release". Nature. 371 (6498): 614–9. doi:10.1038/371614a0. PMID 7935796.
- ^ Habich C, et al. (mart 2007). "Heat shock protein 60: regulatory role on innate immune cells". Cell. Mol. Life Sci. 64 (6): 742–51. doi:10.1007/s00018-007-6413-7. PMID 17221165.
- ^ a b c Ranford JC, et al. (septembar 2000). "Chaperonins are cell-signalling proteins: the unfolding biology of molecular chaperones". Expert Rev Mol Med. 2 (8): 1–17. doi:10.1017/S1462399400002015. PMID 14585136.
- ^ PDB 1SRV; Walsh MA, et al. (juni 1999). "Taking MAD to the extreme: ultrafast protein structure determination". Acta Crystallogr. D. 55 (6): 1168–73. doi:10.1107/S0907444999003698. PMID 10329779.
- ^ Johnson RB, et al. (2003). "Cloning and characterization of the yeast chaperonin HSP60 gene". Genetics. 84 (2): 295–300. doi:10.1016/0378-1119(89)90503-9. PMID 2575559.
- ^ Koll H, et al. (mart 1992). "Antifolding activity of hsp60 couples protein import into the mitochondrial matrix with export to the intermembrane space" (PDF). Cell. 68 (6): 1163–75. doi:10.1016/0092-8674(92)90086-R. PMID 1347713.
- ^ Kaufman, B. A. (2003). "A function for the mitochondrial chaperonin Hsp60 in the structure and transmission of mitochondrial DNA nucleoids in Saccharomyces cerevisiae". The Journal of Cell Biology. 163 (3): 457–461. doi:10.1083/jcb.200306132. ISSN 0021-9525. PMC 2173642. PMID 14597775.
- ^ Koll H, et al. (1992). "Antifolding Activity of HSP60 Couples Protein Import into the Mitochondrial Matrix with Export to the Intermembrane Space" (PDF). Cell. 68 (6): 1163–75. doi:10.1016/0092-8674(92)90086-R. PMID 1347713.
- ^ Itoh H, et al. (decembar 2002). "Mammalian HSP60 is quickly sorted into the mitochondria under conditions of dehydration". Eur. J. Biochem. 269 (23): 5931–8. doi:10.1046/j.1432-1033.2002.03317.x. PMID 12444982.
Dopunska literatura
[uredi | uredi izvor]- Tabibzadeh S, Broome J (1999). "Heat shock proteins in human endometrium throughout the menstrual cycle". Infect Dis Obstet Gynecol. 7 (1–2): 5–9. doi:10.1002/(SICI)1098-0997(1999)7:1/2<5::AID-IDOG2>3.0.CO;2-Y. PMC 1784709. PMID 10231001.
- Schäfer C, Williams JA (2000). "Stress kinases and heat shock proteins in the pancreas: possible roles in normal function and disease". J. Gastroenterol. 35 (1): 1–9. doi:10.1080/003655200750024443. hdl:2027.42/42441. PMID 10632533.
- Moseley P (2000). "Stress proteins and the immune response". Immunopharmacology. 48 (3): 299–302. doi:10.1016/S0162-3109(00)00227-7. PMID 10960671.
- Liu Y, Steinacker JM (2001). "Changes in skeletal muscle heat shock proteins: pathological significance". Front. Biosci. 6: D12-25. doi:10.2741/Liu. PMID 11145923.
- Van Maele B, Debyser Z (2005). "HIV-1 integration: an interplay between HIV-1 integrase, cellular and viral proteins". AIDS Rev. 7 (1): 26–43. PMID 15875659.
- Hochstrasser DF, Frutiger S, Paquet N, Bairoch A, Ravier F, Pasquali C, Sanchez JC, Tissot JD, Bjellqvist B, Vargas R (1992). "Human liver protein map: a reference database established by microsequencing and gel comparison". Electrophoresis. 13 (12): 992–1001. doi:10.1002/elps.11501301201. PMID 1286669.
- Ikawa S, Weinberg RA (1992). "An interaction between p21ras and heat shock protein hsp60, a chaperonin". Proc. Natl. Acad. Sci. U.S.A. 89 (6): 2012–6. doi:10.1073/pnas.89.6.2012. PMC 48586. PMID 1347942.
- Brudzynski K, Martinez V, Gupta RS (1992). "Immunocytochemical localization of heat-shock protein 60-related protein in beta-cell secretory granules and its altered distribution in non-obese diabetic mice". Diabetologia. 35 (4): 316–24. doi:10.1007/BF00401198. PMID 1516759.
- Dawson SJ, White LA (1992). "Treatment of Haemophilus aphrophilus endocarditis with ciprofloxacin". J. Infect. 24 (3): 317–20. doi:10.1016/S0163-4453(05)80037-4. PMID 1602151.
- Singh B, Patel HV, Ridley RG, Freeman KB, Gupta RS (1990). "Mitochondrial import of the human chaperonin (HSP60) protein". Biochem. Biophys. Res. Commun. 169 (2): 391–6. doi:10.1016/0006-291X(90)90344-M. PMID 1972619.
- Venner TJ, Singh B, Gupta RS (1990). "Nucleotide sequences and novel structural features of human and Chinese hamster hsp60 (chaperonin) gene families". DNA Cell Biol. 9 (8): 545–52. doi:10.1089/dna.1990.9.545. PMID 1980192.
- Ward LD, Hong J, Whitehead RH, Simpson RJ (1990). "Development of a database of amino acid sequences for human colon carcinoma proteins separated by two-dimensional polyacrylamide gel electrophoresis". Electrophoresis. 11 (10): 883–91. doi:10.1002/elps.1150111019. PMID 2079031.
- Jindal S, Dudani AK, Singh B, Harley CB, Gupta RS (1989). "Primary structure of a human mitochondrial protein homologous to the bacterial and plant chaperonins and to the 65-kilodalton mycobacterial antigen". Mol. Cell. Biol. 9 (5): 2279–83. doi:10.1128/mcb.9.5.2279. PMC 363030. PMID 2568584.
- Waldinger D, Eckerskorn C, Lottspeich F, Cleve H (1988). "Amino-acid sequence homology of a polymorphic cellular protein from human lymphocytes and the chaperonins from Escherichia coli (groEL) and chloroplasts (Rubisco-binding protein)". Biol. Chem. Hoppe-Seyler. 369 (10): 1185–9. doi:10.1515/bchm3.1988.369.2.1185. PMID 2907406.
- Kreisel W, Hildebrandt H, Schiltz E, Köhler G, Spamer C, Dietz C, Mössner W, Heilmann C (1994). "Immuno-gold electron microscopical detection of heat shock protein 60 (hsp60) in mitochondria of rat hepatocytes and myocardiocytes". Acta Histochem. 96 (1): 51–62. doi:10.1016/s0065-1281(11)80009-7. PMID 7518175.
- Corbett JM, Wheeler CH, Baker CS, Yacoub MH, Dunn MJ (1994). "The human myocardial two-dimensional gel protein database: update 1994". Electrophoresis. 15 (11): 1459–65. doi:10.1002/elps.11501501209. PMID 7895732.
- Baca-Estrada ME, Gupta RS, Stead RH, Croitoru K (1994). "Intestinal expression and cellular immune responses to human heat-shock protein 60 in Crohn's disease". Dig. Dis. Sci. 39 (3): 498–506. doi:10.1007/BF02088334. PMID 7907543.
- Vélez-Granell CS, Arias AE, Torres-Ruíz JA, Bendayan M (1994). "Molecular chaperones in pancreatic tissue: the presence of cpn10, cpn60 and hsp70 in distinct compartments along the secretory pathway of the acinar cells". J. Cell Sci. 107 (3): 539–49. PMID 7911805.
- Mayhew M, da Silva AC, Martin J, Erdjument-Bromage H, Tempst P, Hartl FU (1996). "Protein folding in the central cavity of the GroEL-GroES chaperonin complex". Nature. 379 (6564): 420–6. doi:10.1038/379420a0. PMID 8559246.
- Tabibzadeh S, Kong QF, Satyaswaroop PG, Babaknia A (1996). "Heat shock proteins in human endometrium throughout the menstrual cycle". Hum. Reprod. 11 (3): 633–40. doi:10.1093/humrep/11.3.633. PMID 8671282.
Vanjski linkovi
[uredi | uredi izvor]- GroEL Protein na US National Library of Medicine Medical Subject Headings (MeSH)
- "Palaeos Bacteria: Pieces: GroEL". Arhivirano s originala, 26. 4. 2007. (No rights reserved)
- 3D macromolecular structures of GroEL in EMDB