Superantigen


Superantigeni (SAG) su antigeni koji dovode do antigen-neovisne aktivacije T-limfocita i tako djeluju kao toksini.
Svojstva
[uredi | uredi izvor]Struktura MHC II sa žljebom za vezanje antigena (polukružni).

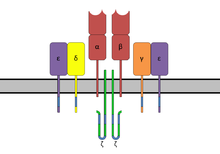
Superantigeni su najmoćniji aktivatori T-limfocita i povezani su sa raznim bolestima koje se mogu pripisati toksičnosti T-ćelija. U normalnim antigenima, formiranje ćelijsko-ćelijskih kontakata između MHC-vezanih peptida na ćelijama koje predstavljaju antigen i T-ćelijskih receptora (TCR) na T-limfocitima dovodi do pokretanja adaptivnog imunskog odgovora . U slučaju superantigena, s druge strane, T-limfocitia aktiviraju se na nespecifičan način i zaobilaze obradu ćelija koje predstavlja antigen koristeći superantigen kao most. Receptori se povezuju: Dok konvencionalni antigeni reagiraju sa samo 0,01% do 1% svih T-ćelija, taj udio iznosi 5% do 20% za superantigene (vidjeti dolje). T-ćelije, koje su nakon toga poliklonički rasle , emitiraju citokine gotovo nekontrolirano, što sprečava ciljanu imunoodbranu. Za superantigen SMEZ-2 proizveden od streptokoka, aktivnost se već može otkriti u rasponu femtograma po mililitru, što ga čini najsnažnijim od bakterijskih superantigena do danas.[1]
Struktura superantigena
[uredi | uredi izvor]SAG su bifunkcionalnie molekulie koje mogu istovremeno povezati mjesta vezanja receptora MHC molekula klase II ćelija koje prezentiraju antigen (APC) sa V ćelijama T-receptora (TCR Vβ) i CD28 T-ćelija. To im omogućuje da negativno moduliraju interakciju između molekula MHC klase II i TCR, formiranjem trimera (MHC-II/SAG/TCR). Posljednje, ali ne najmanje bitno, struktura superantigena je uzrok njihove visoke stabilnosti protiv proteaza i toplote. Za razliku od konvencijskih antigena, čiji epitopi imaju veličinu između približno osam i 17 aminokiselina, bakterijski SAG su proteini veličine 20-30 kDa, u smislu njihove molarne mase. Streptokoke uglavnom sadrže superantigene veličine 24–28 kDa. Većina SAG-ova su globularni proteini. Strukturna analiza pokazala je da se sastoje od jednog lanca, formiranog od dva globularna domena. Smatra se da superantigeni stafilokoka i streptokoka imaju zajedničko porijeklo, posebno jer se u usporedbama sekvenci aminokiselina može naći 20 do 90% podudaranja.[2][3]
Superantigeni konvencijskih antigena
[uredi | uredi izvor]Superantigeni koji djeluju u manjoj mjeri kao antigeni u kontekstu adaptivnog imunskog odgovora, imunoglobulini IgE i IgG protiv SAG, takođe se mogu otkriti kod pacijenata. Koristeći se primjerom stafilokoknih enterotoksina A, B i TSST-1, moglo bi se pokazati da se na taj način odvija oslobađanje IgE posredovanog putem IgE i tako pojačava upalna reakcija. U drugim eksperimentima, došlo je do još jednog neobjašnjivog efekta koji je bio konstitucijski izražen kod pacijenata sa infekcijom S. pyogenes (SPEA = Streptokokni pirogeni egzotoksin A). Trajno stvaranje SPEA teorijski omogućava inficiranom organizmu da dugoročno formira neutralizirajuća antitijela protiv toksina. Međutim, u slučaju SPEA-e, tokom akutne bolesti ne može se otkriti stvaranje antitijela, što može rezultirati dramatičnijim tokom. Tvo što superantigeni također mogu djelovati kao klasični antigena je zanimljivo po tome što s malim količinama ili toksoide je vakcinacija može napraviti. Ovaj pristup bi se mogao potvrditi na životinjskom modelu. Prognoza za tok bolesti mogla bi stoga biti pozitivnija.
Vrste veza sa ciljnim ćelijama
[uredi | uredi izvor]Za interakciju sa ciljanim ćelijama, SAG-ovi imaju najmanje dva mjesta vezanja molekula MHC klase II koja se razlikuju među SAG-ovima. Imaju mjesto vezanja niskog afiniteta na α-lancu i/ili mjesta visokog afiniteta, vezujuća mjesta za cink na P lancu MHC molekula klase II. Mjesto vezanja koje ovisi o cinku može biti presudno za aktivnost SAG-a. SAG-ovi koji su sposobni da vežu cink imaju primarni motiv vezanja cinka HXD na C-terminalu, koji se sastoji od aminokiselina histidina (H), bilo kojeg (X) i asparaginske kiseline (D). Naprimjer, sa superantigenima SPEC, SPEGGAS, SPEH, SPEJ i SMEZ dominantno se veže cink za polimorfni β-lanac MHC molekula klase II. Jedine poznate streptokokne SAG-ove bez vezanja cinka su SSA i SPEA. Poznato je da stafilokokni enterotoksini A (SEA) i E (SEE) kombiniraju oba oblika vezanja.
Interakcija s ciljnim ćelijama
[uredi | uredi izvor]Interakcija sa T-ćelijama odvija se u osnovi preko CDR2 i HV4 područja Vβ-elemenata TCR , dijelom s blagim uticajem iz drugih varijabilnih područja TCR. Ovo razlikuje SAG u njegovom vezanju, u usporedbi s konvenciijskim antigenima, koji koriste "regiju određivanja komplementarnosti" (CDR). Elementi Vβ imaju kod čovjeka oko 50 gena. Od toga, snažna interakcija sa SAG-om je opisana za samo oko 24 vrste. Svi SAG imaju specifičan profil na različitim prepoznavajućim sekvencama Vβ-elemenata i na taj se način vežu na one T-ćelije koje ispoljavaju odgovarajuće Vβ-elemente bez obzira na specifičnost antigena. To omogućava interakciju SAG s 5% do 20% svih T-ćelija, što se javlja zbog hiperproliferacije. Nasuprot tome, konvencijski antigeni reagiraju sa oko 0,01% do 1% svih T-ćelija.[4]
U konvencijskom antigenu, nakon prvog snimanja njihovog, odvija se egzogena obrada u male fragmente peptida sa 9-30 aminokiselina u lizosomne pregrade u fagosomnim ćelijama koje prezentiraju antigen. Nakon fuzije od phagosome i endosome sadrže klase II MHC molekula prisutna fragmenata antigen se odvija na površini ćelije. Kao rezultat toga, javlja se specifičan i kontrolirani imunski odgovor sa proliferacijom T-ćelija, otpuštanje citokina i indukovano stvaranje antitela. S druge strane, superantigeni su neovisni o obradi i prezentaciji i ne vežu se u vezivnoj jami, već direktno izvan domena DR ili DQ MHC molekula, klase II APC (B-ćelije, dendritske ćelije, monociti). Ne postoji ograničenje MHC-a , kao što je to obično u peptidnim antigenima.
Aktiviranje
[uredi | uredi izvor]Superantigenom posredovana aktivacija APC i T-ćelija dovodi do masovnog sistemskog lučenja limfokina u prvih nekoliko sati . Ovo dovodi do povećanja krvnih vrijednosti citokina IL-1 , IL-2 , IL-6 , TNF-α , gama-interferona (IFN-γ), upalnog proteina makrofaga 1α (MIP-1α), MIP-1β i monocitnog hemoatraktantnog proteina 1 ( MCP-1 ). Interakcija SAG i molekula MHC klase II dovodi do aktivacije fosfolipaze C i protein-kinaze C, pojačanom ekspresijom citokina (IL-1, IL-12, TNF-α) i raspadom fosfoinozitola. Aktivaciju T-limfocita, preko formiranje CD40, na klasu prekidača u B-limfocitima. Čini se da je abnormalni izlaz limfokina uzrok sindroma toksičnog šoka (TSS) i niza drugih bolesti.[5][6]
Bakterijski superantigeni
[uredi | uredi izvor]
Većina superantigena čine bakterije , posebno gram-pozitivne. Superantigeni TSST (toksin sindroma toksičnog šoka) iz Staphylococcus aureus i SPE (egzotoksin Streptococcus pyogenes) iz invazivnog Streptococcus pyogenes smatraju se toksinima visoke smrtnosti. Oko 1% Staphylococcus aureus formira TSST-1, što dovodi do sepsnog šoka, putem oslobađanja interleukina-1 i TNF-α iz makrofaga.[7][8]
Drugi sojevi proizvode takozvani egsfoliativni toksin kao SAG i tako ga razdvaju u male komade. Ritterova bolest (stafilokokni sindrom osipane kože, SSSS) i streptokoki grupe C i G također su identificirani kao potencijalni tvorci toksina, ali čini se da je njihova važnost ograničena na životinje. Među gram-negativnih mikroorganizama, toksini i MAM iz YPM su Myikoplasma arthritidis i Yersinia pseudotuberculosis identificirani kao superantigeni.
Virusni superantigeni
[uredi | uredi izvor]Pored bakterijskih superantigena, zabilježeni su i superantigeni efekti u virusnim infekcijama iz porodice herpes virusa mliječnog tumora miša (MMTV) i virusa imunodeficijencije 1 kod čovjeka (HIV-1).[9][10]
Značaj superantigenaza mikroorganizame
[uredi | uredi izvor]Patogeni često u toku jedne imunskog gubitka na imunski odgovor, zbjegnu proizvodnju superantigena i posljedično preveliku trajnu aktivaciju imunskih ćelija i prepreka adaptivnog imunskog odgovora. Vjerovatno, stimulacija posredovana superantigenom dovodi do konzumacije T-ćelija lokalno proizvedenog interleukina-2, koji suzbija efikasan imunski odgovor protiv patogena. Ogromno lučenje citokina će također odgoditi specifično otkrivanje patogena i na taj način olakšati njegovo širenje. Nadalje, SAG može uzrokovati anergiju i/ili deleciju T-ćelija, što također vodi efikasnoj zaštiti patogena od adaptivnog imunološkog odgovora. Za streptokokne pirogene egzotoksine A i C i stafilokokni enterotoksina B, postoje studije in vitro, koje pokazuju da su ovi toksini humoralnog odgovora, u nekim slučajevima, mogu potisnuti, čime se sprečava stvaranje antitela. Transkripcijsku regulaciju gena za superantigen često obavljaju isti faktori kao za transkripciju M-proteina i proteina bakterijske kapsule.[11][12]
Uloga superantigena u bolestima
[uredi | uredi izvor]Bolesti koje su vjerovatno vezane za superantigene
[uredi | uredi izvor]Različite indikacije ukazuju na uključenost SAG-a u određene bolesti ili se čak smatraju njihovom etiologijom. Međutim, uloga SAG-a još nije dokazana za mnoge bolesti. Kod šećerne bolesti (diabetes melitus) ovisne o insulinu, raspravlja se o odnosu prema T-ćelijskom superantigenu IDDMK 1,2 22 ljudskog endogenog retrovirusa (HERV) K-18 i prema enterotoksima iz S. aureus. Isto se odnosi i na autoimune reakcije, kao što su reumatski endokarditis, Sjögrenov sindrom, akutna reumatska groznica, reumatoidni artritis, Kawasakijev sindrom i multiplu sklerozezu, koje se smatra da su povezane sa bakterijskim SAG-om. Čini se da pirogeni egzotoksini A, C, G do J, SSA i varijante SMEZ imaju značajnu ulogu u akutnom tonzilitisu, nekrotizirajućem fasciitisu, reumatskoj groznici i nekim drugim groznicama. SAG imaju istu neobjašnjivu ulogu u iznenadnoj smrti dojenčadi (SIDS), u kojoj su uzročnici sojevi S. aureus, koji formiraju pirogene egzotoksine, a bili izolirani nakon obdukcije. Smatra se da SAG ima uticaj i na neke kožne bolesti poput atopijskog ekcema, atopijskog dermatitisa i psorijaze, budući da su značajno povećane količine SAG mogle biti izolirane iz uzoraka pacijenata. Pokazalo se da su SPE A i C povezani sa nekim lokalnim psorijazama.
Bolesti koje su povezane sa superantigenima
[uredi | uredi izvor]S druge strane, nesporno je da je enterotoksini A do M i TSST-1 iz S. aureus izaziva sindrom toksičnog šoka (TSS), sa višestrukim zatajenjem organa, kao i razna trovanja hranom (osom TSST). Isto se odnosi i na streptokokne SAG, koje se nazivaju i pirogeni egzotoksini, koji uzrokuju streptokokni sindrom toksičnog šoka i naglo povišenu temperaturu.
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ G. Ramachandran: Gram-positive and gram-negative bacterial toxins in sepsis: a brief review. In: Virulence. Band 5, Nummer 1, Januar 2014, S. 213–218, ISSN 2150-5608. doi:10.4161/viru.27024. PMID 24193365. PMC-3916377.
- ^ C. Louis-Dit-Sully, B. Blumenthal, M. Duchniewicz, K. Beck-Garcia, G. J. Fiala, E. Beck-García, M. Mukenhirn, S. Minguet, W. W. Schamel: Activation of the TCR complex by peptide-MHC and superantigens. In: EXS. Band 104, 2014, S. 9–23, ISSN 1023-294X. doi:10.1007/978-3-0348-0726-5_2. PMID 24214615.
- ^ R. Kaempfer, G. Arad, R. Levy, D. Hillman, I. Nasie, Z. Rotfogel: CD28: direct and critical receptor for superantigen toxins. In: Toxins. Band 5, Nummer 9, September 2013, S. 1531–1542, ISSN 2072-6651. doi:10.3390/toxins5091531. PMID 24022021. PMC-3798871.
- ^ I. V. Pinchuk, E. J. Beswick, V. E. Reyes: Staphylococcal enterotoxins. In: Toxins. Band 2, Nummer 8, August 2010, S. 2177–2197, ISSN 2072-6651. doi:10.3390/toxins2082177. PMID 22069679. PMC-3153290.
- ^ Stiles BG, Krakauer (2005). "Staphylococcal Enterotoxins: a Purging Experience in Review, Part I". Clinical Microbiology Newsletter. 27: 23.
- ^ Jabara HH, Geha RS (oktobar 1996). "The superantigen toxic shock syndrome toxin-1 induces CD40 ligand expression and modulates IgE isotype switching". Int. Immunol. 8 (10): 1503–10. doi:10.1093/intimm/8.10.1503. PMID 8921429.
- ^ A. R. Spaulding, W. Salgado-Pabón, P. L. Kohler, A. R. Horswill, D. Y. Leung, P. M. Schlievert: Staphylococcal and streptococcal superantigen exotoxins. In: Clinical microbiology reviews. Band 26, Nummer 3, Juli 2013, S. 422–447, ISSN 1098-6618. doi:10.1128/CMR.00104-12. PMID 23824366. PMC-3719495.
- ^ Thomas Proft et al.: Superantigens and Streptococcal Toxic Shock Syndrome. Emerging Infectious Diseases 9, Okt. 2003, doi:10.3201/eid0910.030042.
- ^ Jean-François Fortin et al.: Hyper-responsiveness to stimulation of human immunodeficiency virus-infected CD4+ T cells requires Nef and Tat virus gene products and results from higher NFAT, NF-kappaB, and AP-1 induction. J Biol Chem. 278, Sept. 2004, S. 39520–31, doi:10.1074/jbc.M407477200.
- ^ Satinder Dahiya et al.: Deployment of the human immunodeficiency virus type 1 protein arsenal: combating the host to enhance viral transcription and providing targets for therapeutic development, J Gen Virol 93, Juni 2012, S. 1151–1172, doi:10.1099/vir.0.041186-0.
- ^ Lussow AR, MacDonald HR (februar 1994). "Differential effects of superantigen-induced "anergy" on priming and effector stages of a T cell-dependent antibody response". Eur. J. Immunol. 24 (2): 445–9. doi:10.1002/eji.1830240227. PMID 8299694.
- ^ Cleary PP, McLandsborough L, Ikeda L, Cue D, Krawczak J, Lam H (1998). "High-frequency intracellular infection and erythrogenic toxin A expression undergo phase variation in M1 group A streptococci". Mol. Microbiol. 28 (1): 157–67. doi:10.1046/j.1365-2958.1998.00786.x. PMID 9593304.CS1 održavanje: više imena: authors list (link)
