Àcid fosfòric

| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 97,977 Da |
| Trobat en el tàxon | |
| Rol | dental material (en) |
| Estructura química | |
| Fórmula química | H₃PO₄ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 1,87 g/cm³ (a 77 °F, sòlid) |
| PKa | 1,97 2,12 |
| Punt de fusió | 42 °C 20 °C 42,4 °C |
| Punt d'ebullició | 213 °C (a 1 atm) 407 °C (a 101,325 kPa) |
| Pressió de vapor | 0,03 mmHg (a 20 °C) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 1 mg/m³ (10 h, Estats Units d'Amèrica) |
| Límit d'exposició a curt termini | 3 mg/m³ (cap valor) |
| IDLH | 1.000 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
L'àcid fosfòric, també conegut com a àcid ortofosfòric, és un oxoàcid inorgànic de fórmula química , l'àcid més important del fòsfor, en estat pur és un sòlid cristal·lí a temperatura ambient,[1] però absorbeix la humitat de l'aire molt fàcilment i es liqua. La font més comuna d'àcid fosfòric és una solució aquosa del 85% amb aspecte de xarop incolora i no volàtil.[2] És corrosiu per a metalls i teixits. S'utilitza en l'elaboració de fertilitzants i detergents i en l'elaboració d'aliments com acidificant, és l'additiu alimentari E338.[3]
Propietats
[modifica]Propietats físiques
[modifica]L'àcid fosfòric a temperatura ambient és un sòlid cristal·lí transparent i inodor, que cristal·litza en el sistema ortoròmbic.[4] Les molècules es troben unides mitjançant enllaços d'hidrogen, formant cristalls laminars, en les quals cada molècula de es troba unida a altres sis.[5] És higroscòpic, té una densitat de 1,834 g/cm³, el seu punt de fusió és de 42,35 °C i el d'ebullició 407 °C. És molt soluble en aigua (548 g en 100 g d'aigua a 20 °C) i soluble en etanol.[4] En estat líquid es mantenen un bon nombre d'enllaços d'hidrogen, per la qual cosa és xaropós i poc volàtil. també és incolor.
A més de l'àcid anhidre s'ha descrit el monohidrat , també cristal·lí,[5] i l'hemihidrat que té un punt de fusió de 29,32 °C i és transparent.[6]
Propietats químiques
[modifica]En dissolució aquosa es comporta com un àcid tribàsic amb constant d'ionització Ka1 = 7,25×10–3; Ka2 = 6,31×10–8; i Ka3 = 3,98×10–13,[7] que corresponen a un àcid de força mitjana la primera, a un molt feble la segona i a un extremadament feble la tercera. Els equilibris són:[5]
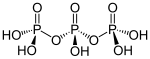
L'àcid fosfòric experimenta amb facilitat reaccions de condensació, això és, reaccions en les quals dues o més molècules d' s'uneixen, es condensen, per formar una molècula major amb eliminació de molècules d'aigua. La reacció més simple és la de dues molècules d' que es condensen en escalfar-les eliminant una molècula d'aigua. S'obté l'àcid difosfòric amb un oxigen que fa de pont. Si se segueix escalfant s'elimina més molècules d'aigua i es forma l'àcid trifosfòric i àcids amb cadenes més llargues i també anells.[8]
Estructura molecular
[modifica]
La molècula d'àcid fosfòric està constituïda per un àtom de fòsfor situat al centre d'un tetràedre que forma enllaços covalents amb quatre oxígens que se situen en els vèrtexs del tetràedre, separats aquest enllaços per angles de 109,5º. Segons la teoria d'enllaç de valència el fòsfor pot emprar orbitals atòmics híbrids sp3 per formar amb els quatre oxígens enllaços sigma.
Tres dels oxígens s'uneixen cadascun a un hidrogen mitjançant també un enllaç sigma. El quart oxigen s'uneix al fòsfor amb un altre enllaç covalent, en aquest cas un enllaç pi, formant un enllaç doble que precisa la intervenció dels orbitals 3d del fòsfor. La promoció d'electrons 3p a orbitals 3d molt propers en energia permet al fòsfor disposar de 5 electrons desaparellats per formar cinc enllaços.[8][9]
Obtenció
[modifica]L'àcid fosfòric es pot fabricar mitjançant un procés tèrmic o un altre de químic, dit humit, essent majoritari l'ús del procés humit. L'àcid fosfòric produït pel procés humit s'utilitza per a la producció d'adobs, mentre que l'obtingut pel procés tèrmic s'utilitza habitualment en la fabricació de productes químics que requereixen una puresa molt superior. La producció d'àcid fosfòric pel procés humit genera una quantitat considerable d'aigua de refrigeració àcida amb altes concentracions de fòsfor i fluorur. Aquest excés d'aigua es recull en estanys de refrigeració que s'utilitzen per emmagatzemar temporalment l'excés de precipitació per a la seva posterior evaporació i per permetre la recirculació de l'aigua de procés a la planta per a la seva reutilització.[10]
En un primer moment el procés humit va ser molt utilitzat, però a partir de l'any 1920 es va reemplaçar progressivament pel procés tèrmic. Gràcies a les millores introduïdes a les plantes de producció que fan servir el mètode humit i a l'augment del preu de l'energia, el procés humit ha tornat a ser el més utilitzat. El mètode tèrmic ha esdevingut cada vegada més car perquè cal escalfar les roques que contenen fosfat en un forn elèctric a 2000 °C, i això consumeix molta energia. El 1954 el procés humit ja representava el 60% de l'àcid fosfòric produït, el 1974 ja era el 88%, i ara més del 90%.[11]
Modernament, s'extrau també àcid fosfòric de les aigües residuals, en un procediment de mineria urbana que permet estalviar recursos i reduir la pol·lució.[12][13]
Procés humit
[modifica]
La principal font de fòsfor del món és l'apatita , un grup de minerals fosfats format per hidroxilapatita, fluorapatita i clorapatita, amb altes concentracions d'ions hidròxid , fluorur i clorur , respectivament. Comercialment, el més important és la fluorapatita . El fluor que conté s'ha d'eliminar per a la fabricació d'àcid fosfòric, però també es pot utilitzar per produir fluorur d'hidrogen i compostos fluorats.[10]
En el procés humit, l'àcid fosfòric es produeix en reaccionar l'àcid sulfúric amb fosforita, una roca amb alta concentració d'apatita. La fosforita s'asseca, es tritura i s'introdueix contínuament al reactor juntament amb l'àcid sulfúric. La reacció combina el calci de la fosforita amb el sulfat, formant sulfat de calci , que se separa de la solució de reacció per filtració. Algunes instal·lacions solen utilitzar un procés del dihidrat que produeix sulfat de calci amb dues molècules d'aigua (sulfat de calci dihidratat, ). Altres instal·lacions poden utilitzar un procés de l'hemihidrat que produeix sulfat de calci amb l'equivalent a mitja molècula d'aigua per molècula de sulfat de calci . El procés de l'hemihidrat d'un sol pas té l'avantatge de produir àcid fosfòric amb una major concentració de pentaòxid de difòsfor i menys impureses que el procés del dihidrat. Una reacció simplificada per al procés del dihidrat és la següent:[10]
Per tal de fer l'àcid fosfòric més concentrat possible i disminuir els costos d'evaporació, s'utilitza normalment àcid sulfúric del 93% en volum. Durant la reacció, els cristalls de guix es precipiten i se separen de l'àcid per filtració. Els cristalls separats s'han de rentar completament per obtenir una recuperació d'almenys un 99% en volum de l'àcid fosfòric filtrat. L'àcid fosfòric del procés humit conté normalment pentaòxid de difòsfor entre el 26% i el 30% en massa i, en la majoria dels casos, l'àcid s'ha de concentrar més per complir les especificacions necessàries per a la producció d'adobs. Segons el tipus d'adob que es produeixi, l'àcid fosfòric es concentra generalment fins al 40%–55% en massa de pentaòxid de difòsfor mitjançant l'ús de dos o tres evaporadors al buit.[10]
Procés tèrmic
[modifica]
En el procés tèrmic, les matèries primeres per a la producció d'àcid fosfòric són el fòsfor elemental (groc), l'aire i l'aigua. El procés implica tres passos: (1) combustió, (2) hidratació i (3) enderrocament. En la fase de combustió, el fòsfor elemental líquid es crema (oxidat) a l'aire ambient d'una cambra de combustió a temperatures de 1650–2760 °C per formar pentaòxid de difòsfor:[10]
El pentaòxid de difòsfor s'hidrata després amb àcid fosfòric diluït o aigua per produir un líquid àcid fosfòric.
L'últim pas és l'eliminació de la boira d'àcid fosfòric del corrent de gas de combustió abans d'alliberar-se a l'atmosfera Com sempre, l'alliberament a l'atmosfera només es pot realitzar si el producte desaparegut és un flux net i no contaminant.
La concentració d'àcid fosfòric produït a partir del procés tèrmic normalment oscil·la entre el 75% i el 85% en massa. Aquesta concentració és necessària per a la producció química d'alt grau i per a la fabricació d'altres productes no fertilitzants. Les plantes eficients recuperen aproximadament el 99,9% en massa del fòsfor elemental cremat com a producte de l'àcid fosfòric.
En la producció d'àcid fosfòric, el fluor alliberat dels reactors i evaporadors sol recuperar-se com a subproducte que es pot vendre. La resta es passa al condensador que produeix un efluent líquid amb fluorur majoritàriament i petites quantitats d'àcid fosfòric. Els sistemes tancats reciclen aquest efluent; en altres casos, es descarrega a aigües obertes.[10]
Aplicacions
[modifica]Fertilitzants
[modifica]Prop del 90% de l'àcid fosfòric produït s'empra en l'obtenció de fertilitzants. El 2014 el 38% de la producció mundial es dedicava a l'obtenció de hidrogenfosfat d'amoni ; el 29% en la producció de dihidrogenfosfat d'amoni ; el 8% en la síntesi del dihidrogenfosfat de calci , conegut com a superfosfat triple; el 15% en altres fertilitzants i el 10% restant en altres usos. La producció mundial fou el 2014 de 43 milions de tones, les quals la Xina en produí 15 milions, altres països d'Àsia 10 milions i 8,4 milions als EUA.[14]
L'hidrogenfosfat d'amoni i el dihidrogenfosfat d'amoni s'obtenen per reacció de l'àcid fosfòric amb amoníac en proporcions adients per obtenir un o l'altre compost:
El superfosfat triple s'obté per reacció del fosfat de calci mineral amb àcid fosfòric:
Obtenció de fosfats de sodi
[modifica]Els diferents fosfats de sodi es produeixen per reacció de l'àcid fosfòric i una dissolució concentrada d'hidròxid de sodi en les proporcions estequiomètriques adequades. El producte cristal·litza.
El dihidrogenfosfat de sodi s'utilitza en les formulacions de neteja de metalls i preparació de superfícies, com a font de fosfat en la fabricació farmacèutica i com a agent de control del pH en dentifricis, en recobriment d'esmalt vitri (sanitaris) i en la fabricació de fosfats de midó. Tant l'hidrogenfosfat de sodi com l'àcid fosfòric directament s'empren per produir un revestiment prim i insoluble de fosfat de plom(II) a les canonades de plom per evitar la dissolució del plom pels àcids de l'aigua.[14]
L'hidrogenfosfat de sodi s'utilitza com a agent suavitzant en el formatge processat, en esmalts i esmalts ceràmics, en el bronzejat de cuir, en la fabricació de colorants i com a inhibidor de la corrosió en el tractament de l'aigua.[14]
El fosfat de sodi s'utilitza en netejadors de gran resistència, per exemple en desgreixar acer. És un àlcali i un segrestant per als cations de calci, mantenint-los en solució i evitant la formació d'una escòria.[14]

El dihidrogendifosfat de sodi s'utilitza com a agent llevat en el pa i pastissos (ajuda a l'alliberament de diòxid de carboni de l'hidrogencarbonat), com a supressor d'òxids de ferro, en la fabricació de diversos aliments i com a dispersant en fang per perforació de petroli.[14]
En neutralitzar l'àcid fosfòric amb carbonat de sodi s'obté el trifosfat de sodi que és un dels principals components dels detergents per a teixits i renta-vaixelles. Segresta cations calci(2+) i magnesi(2+) evitant que els sabons reaccionin amb ells i perdin la seva capacitat de neteja. També facilita que els greixos i la pols es mantenguin en suspensió.[15]
Alimentació
[modifica]L'àcid fosfòric s'empra com acidificant en la industria alimentaria amb el codi E338. Destaca el seu ús en la preparació de begudes refrescants.[16]
Referències
[modifica]- ↑ «Phosphoric acid» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, Inc.. [Consulta: 10 octubre 2021].
- ↑ «Oxyacids of phosphorus» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, Inc.. [Consulta: 10 octubre 2021].
- ↑ «EURL Evaluation Report on the Analytical Methods submitted in connection with the Application for the Authorisation of Feed Additives according to Regulation (EC) No 1831/2003. Orthophosphoric acid (E 338)» (PDF) (en anglès). EURL. European Union Reference Laboratory. Feed Additives, 2011. [Consulta: 10 octubre 2021].
- ↑ 4,0 4,1 PubChem. «Phosphoric acid» (en anglès). [Consulta: 21 novembre 2019].
- ↑ 5,0 5,1 5,2 Gutiérrez Ríos, Enrique.. Química inorgánica. 2. ed., revisada. Barcelona: Reverté, 1994, ©1984. ISBN 84-291-7215-7.
- ↑ «Phosphoric acid hemihydrate CAS NO (16271-20-8)-Molbase». [Consulta: 24 novembre 2019].
- ↑ Ropp, R. C.. Chapter 4 - Group 15 (N, P, As, Sb and Bi) Alkaline Earth Compounds. Amsterdam: Elsevier, 2013, p. 199–350. DOI 10.1016/b978-0-444-59550-8.00004-1. ISBN 978-0-444-59550-8.
- ↑ 8,0 8,1 Gillespie, R.G. [et al.].. Química. Ed. en español. Barcelona: Reverté, 1990. ISBN 84-291-7183-5.
- ↑ Organic chemistry.. 5th ed.. Belmont, CA: Brooks/Cole Cengage Learning, 2009. ISBN 978-0-495-38857-9.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 Speight, James G.,. Environmental inorganic chemistry for engineers. ISBN 978-0-12-801142-3.
- ↑ Chenier, 2003, p. 37.
- ↑ «Projecte water-mining, innovació sostenible per garantir l'accés a l'aigua potable i al sanejament». Universitat Autònoma de Barcelona – Institut de Ciència i Tecnologia Ambientals (ICTA-UAB), 13-07-2021. [Consulta: 17 juliol 2021].
- ↑ Chan, Natasha. «Resource Snapshot (5): Phosphorus» (en anglès). World Ressource Forum, 13-02-2015. [Consulta: 11 maig 2022].
- ↑ 14,0 14,1 14,2 14,3 14,4 Lazonby, John. «Phosphoric Acid» (en anglès britànic). [Consulta: 23 novembre 2019].
- ↑ Muñoz Camacho, Eugenio.. Ingeniería química. ISBN 978-84-362-6642-9.
- ↑ Tratado de nutrición. 2a. ed. Madrid: Médica-Panamericana, D.L. 2010. ISBN 978-84-9835-242-9.
Bibliografia
[modifica]- Chenier, Philip J. Survey of Industrial Chemistry (en anglès). Tercera edició. Kluwer Academic/Plenum Publishers, 2003. ISBN 0-306-47246-5.