Enllaç covalent


L'enllaç covalent és un tipus d'enllaç químic en què dos àtoms comparteixen un o més parells d'electrons de tal manera que la seva escorça quedi plena. Els dos àtoms de l'enllaç químic que comparteixen els electrons són elements amb electronegativitats altes i molt similars, on cap dels dos àtoms té prou energia per a arrancar un electró d'un altre àtom. D'aquesta manera, cap dels dos àtoms té més tendència que l'altre a guanyar o perdre els electrons. L'atracció resultant de la compartició d'aquests parells d'electrons manté junta la molècula. Aquest tipus d'enllaç és més fort que l'enllaç per pont d'hidrogen i similar en força a l'enllaç iònic.
L'enllaç covalent és més comú entre els àtoms de no metalls també metall-semimetall o metall-no metall(sempre que la càrrega d'electrons de l'última capa del metall en qüestió sigui superior a >3) com per exemple CrO₃ i Ni₂Si,mentre que l'enllaç iònic és propi dels àtoms de metall o, si més no, entre un metall i un no-metall(sempre que el metall tingui les càrregues de l'última valència iguals o inferiors a 3) com per exemple Na₂C₂ i CsF.[1]
L'enllaç covalent sol ser més fort que els altres tipus d'enllaç, com ara l'enllaç iònic.[2] A diferència de l'enllaç iònic, en què la força d'atracció elèctrica no direccional manté junts els ions, l'enllaç covalent és altament direccional. És per això que les molècules covalents tendeixen a formar-se en un nombre relativament petit de formes característiques, amb els enllaços disposats en uns determinats angles.
La unió entre àtoms caracteritzada per la compartició d'electrons s'anomena enllaç covalent. Així, cada parell d'electrons compartits forma un enllaç covalent que es manté unit degut a l'atracció entre les càrregues positives dels nuclis i les negatives dels electrons compartits. Aquesta atracció entre els dos electrons, simultània i d'una magnitud aproximadament igual, rebaixa l'energia total del sistema de manera que el sistema resultant és més estable que els àtoms independents.
L'enllaç covalent dona lloc a la formació de molècules.[3] Si els àtoms units per enllaços covalents són iguals, es forma la molècula d'un element; però si els àtoms que es combinen són diferents, es forma la molècula d'un compost.
Història de l'enllaç covalent
[modifica]Pels dies en què Lewis començava a desenvolupar les seves idees, a principis del segle xx, estava realment estesa la creença que tot enllaç químic implicava atracció electroestàtica entre dues entitats iòniques, o de naturalesa similar. Aquesta teoria era aplicable a tots els compostos iònics, que són coneguts pel fet que, tal com, per exemple, fa el NaCl, es dissocien en ions quan són dissolts en aigua; però, la teoria no servia si volien extrapolar-la als enllaços entre compostos de naturalesa no electrolítica, com per exemple el CH₄. En aquest últim cas no es podia suposar una força electroestàtica entre components carregats electroquímicament. Tanmateix encara no s'havia plantejat el concepte d'orbitals atòmics, fet que hagués facilitat bastant trobar una explicació a la naturalesa d'aquest últim tipus d'enllaços. El concepte que sí que era conegut era el d'electrons de valència, de la mateixa manera que la taula periòdica ja havia estat proposada per Dmitri Mendeléiev.
Per tant, no és d'estranyar que la localització dels gasos nobles en aquesta fes que es comencés a considerar el fet que tots (menys l'Heli) tenien vuit electrons de valència. De la mateixa manera, es va començar a estudiar el fet que certs elements tendissin a formar unions, guanyant o perdent electrons, de forma que acabessin tenint vuit electrons a la capa de valència.
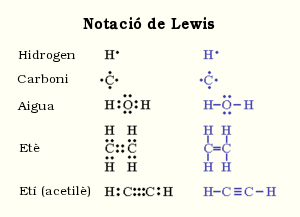 Lewis buscava una manera d'aconseguir enunciar una regla que, a partir d'aquella tendència a l'octet,[4] aconseguís explicar la formació dels compostos que no eren de naturalesa iònica sense haver de recórrer a les interaccions electroestàtiques. Així va ser com va enunciar la regla de l'octet, segons la qual, tots els elements de la taula periòdica, tenen tendència a guanyar o perdre electrons de forma que aconsegueixin una configuració de la capa de valència el més similar possible a la d'un gas noble.
Lewis buscava una manera d'aconseguir enunciar una regla que, a partir d'aquella tendència a l'octet,[4] aconseguís explicar la formació dels compostos que no eren de naturalesa iònica sense haver de recórrer a les interaccions electroestàtiques. Així va ser com va enunciar la regla de l'octet, segons la qual, tots els elements de la taula periòdica, tenen tendència a guanyar o perdre electrons de forma que aconsegueixin una configuració de la capa de valència el més similar possible a la d'un gas noble.
Aquell mateix any, el 1916, ell mateix va descriure la compartició de parells d'electrons entre àtoms. Per simplificar la seva teoria, va introduir també la Notació de Lewis, on els electrons de valència (els de l'escorça) són representats per punts entorn dels símbols atòmics dels àtoms a qui envolten. Per expressar un compost covalent, doncs, s'ajunten dos símbols atòmics i es posa el parell d'electrons que comparteixen enmig. Diversos parells d'electrons representen enllaços múltiples, com ara el doble enllaç o el triple enllaç. A la figura es mostren diversos exemples de notació de Lewis. Es mostra en color blau una forma alternativa, on els electrons enllaçants (els que formen l'enllaç, és a dir, els que són compartits pels àtoms) es representen mitjançant línies.
Tot i així, cal dir que la teoria dels electrons compartits no és només mèrit de Lewis. El seu col·lega Irving Langmuir també hi va tenir molt a veure. D'alguna forma, va col·laborar amb Lewis per desenvolupar la teoria i va ajudar a estendre-la i divulgar-la (fins i tot, va començar a ser coneguda com la teoria de Langmuir,[5] fet que va molestar molt a Lewis).
Malgrat la teoria de Lewis fos bastant satisfactòria a l'hora d'explicar la compartició d'electrons d'una forma més aviat qualitativa i intuïtiva, no va ser fins a l'arribada de la mecànica quàntica que els científics varen poder donar una explicació més consistent a la mecànica i la naturalesa de l'enllaç covalent, i també poder predir les estructures i propietats dels compostos covalents, o molècules, més simples.
Walter Heitler i Fritz London són considerats els primers a obtenir amb èxit una explicació quàntica de l'enllaç químic, concretament el de la molècula d'hidrogen, el 1927. El seu treball es basa en el model d'enllaç de valència. Aquest assumeix que un enllaç químic es forma quan se superposen els orbitals atòmics dels àtoms que participen en l'enllaç (i gràcies a això es produeix la compartició d'electrons entre els àtoms).
Teoria actual
[modifica]En l'actualitat, el model de l'enllaç de valència ha estat substituït per la Teoria dels Orbitals Moleculars (TOM)[6] desenvolupada per Mulliken i Hund (1928). El punt de partida d'aquesta teoria és la Teoria dels Orbitals Atòmics (TOA), i considera que els enllaços covalents entre dos nuclis situats a una distància d'equilibri es formen per superposició dels orbitals atòmics (OA) dels àtoms que participen en l'enllaç, de manera que els nous orbitals moleculars (OM) pertanyen a la molècula sencera i no a un sol àtom. A més, la Teoria dels Orbitals Moleculars considera que els orbitals atòmics del nivell de valència deixen d'existir quan es forma la molècula, i són substituïts per un nou conjunt de nivells energètics que corresponen a noves distribucions de densitat de probabilitat. Aquests nous nivells energètics es consideren en la molècula com un tot i s'anomenen orbitals moleculars.
Aquests orbitals són anàlegs als OA i presenten característiques similars:
- Cada electró d'una molècula ve descrit per una funció d'ona Ψ, anomenada orbital molecular.
- A cada OM li correspon una energia determinada.
- Per determinar l'estructura electrònica d'una molècula es calculen en primer lloc les energies dels possibles OM. A continuació s'introdueixen els electrons en aquests OM seguint el procediment d'Aufbau: sense violar el principi d'exclusió de Pauli ni la regla de la màxima multiplicitat de Hund.
Igual que amb els àtoms polielectrònics, no és possible resoldre l'equació de Schrödinger de forma exacta per la molècula i cal recórrer a mètodes aproximats per a conèixer la forma de les funcions d'ona que representen els OM. Un dels mètodes d'aproximació més utilitzats és el que fa ús de les combinacions lineals d'orbitals atòmics (CLOA), que fou introduït per Sir John Lennard-Jones (1929). De manera simple, explica que quan un electró està prop dels nuclis, és a dir, està "controlat" per un nucli, la seva funció d'ona serà molt semblant a la d'un orbital atòmic.


Els principis fonamentals de l'aproximació CLOA són:
- Els OM es formen per combinació o interacció d'orbitals atòmics procedents de dos o més àtoms.
- Només els electrons de valència estan implicats en l'enllaç químic, i només els orbitals de valència es combinen per formar OM.
- Les orbitals es conserven durant l'enllaç químic: el nombre d'OA que es combinen és sempre igual al nombre d'OM que es formen.
- Els OM tenen propietats similars als OA.
- Només els OA que tenen propietats de simetria idèntiques poden interaccionar entre si.
- La mescla d'orbitals és més significativa quan els OA tenen aproximadament la mateixa energia. A mesura que la diferència d'energia (ΔE) entre els OA augmenta, l'efectivitat de la superposició disminueix.
Durant la formació de l'enllaç covalent, els dos orbitals (en el cas d'una molècula diatòmica) s'aproximen i comencen a superposar-se, alliberant energia a mesura que l'electró de cada àtom és atret per la càrrega positiva del nucli de l'altre àtom. Com major sigui la superposició, major serà l'energia alliberada i, per tant, menor serà l'energia de l'OM. Si el procés d'aproximació dels àtoms continués, els nuclis atòmics s'arribarien a repel·lir mútuament; de manera que l'energia del sistema augmentaria. Això significa que la màxima estabilitat (mínima E) es dona quan els nuclis es troben a una distància determinada. Aquesta distància es coneix com a longitud del nou enllaç covalent.
Els dos OM normalitzats que descriuen l'electró de la molècula ió de l'hidrogen (o qualsevol altra molècula homonuclear amb un sol electró d'enllaç) són:
Funció simètrica:
Funció antisimètrica:
A partir de les funcions d'ona anteriors es pot determinar la distribució de càrrega electrònica en la molècula; i a partir de les expressions de l'energia se'n poden calcular els nivells energètics moleculars.
Classificació de l'enllaç covalent
[modifica]Segons el nombre d'electrons que participin en l'enllaç, aquest es pot classificar en:
ENLLAÇ COVALENT SIMPLE: es comparteixen un parell d'electrons
- Ex: H-H (dihidrogen), Cl-Cl (diclor)
ENLLAÇ COVALENT DOBLE: es comparteixen dos parells d'electrons
- Ex: O=C=O (diòxid de carboni), O=O (oxigen)
ENLLAÇ COVALENT TRIPLE: es comparteixen tres parells d'electrons
- Ex: N≡N (dinitrogen)
Segons la diferència d'electronegativitat, que mesura la tendència d'un àtom a atreure sobre si mateix els electrons compartits, els enllaços covalents es classifiquen segons la seva polaritat:
ENLLAÇ COVALENT POLAR: és el tipus d'enllaç covalent que es forma quan els electrons es comparteixen de manera desigual pels dos àtoms que formen l'enllaç degut a una diferència d'electronegativitat d'aquests. Així, l'extrem de la molècula amb l'àtom més electronegatiu adquireix la càrrega parcial negativa (δ-) i l'altre extrem amb l'àtom menys electronegatiu adquireix la càrrega parcial positiva (δ+). Per formar aquest tipus d'enllaç la diferència d'electronegativitat ha d'estar compresa entre 0.5 i 1.7.
- Ex: H-Cl
Enllaç covalent apolar: és el tipus d'enllaç que es forma quan els dos àtoms que formen aquest enllaç són iguals, tenen la mateixa electronegativitat i, per tant, la diferència és zero. Així, els electrons són atrets en igual magnitud per ambdós àtoms. Per formar aquest tipus d'enllaç, els àtoms han de tenir una diferència d'electronegativitat menor o igual a 0.4.
- Ex: H-H (dihidrogen)
Un altre tipus d'enllaç que podem trobar és:
Enllaç covalent datiu o coordinat: és l'enllaç que es forma quan el parell d'electrons que formen l'enllaç els dona un mateix àtom. És a dir, consisteix en la compartició dels electrons provinents d'un mateix àtom.
- Ex: ió amoni (NH₄+)
Propietats de l'enllaç covalent
[modifica]Ordre de l'enllaç
[modifica]L'ordre d'un enllaç és el nombre de parells d'electrons compartits en un enllaç. Aquest ordre s'obté de la resta entre el nombre d'electrons dels orbitals enllaçants i el nombre d'electrons dels orbitals no enllaçants i dividir-ho tot per 2.
La longitud de l'enllaç i l'energia són dues característiques íntimament relacionades amb l'ordre de l'enllaç. Així, com major ordre d'enllaç tingui una molècula, major serà la seva energia d'enllaç i menor serà la seva longitud.
El tipus més habitual d'enllaç covalent és l'enllaç simple, la compartició d'un parell d'electrons entre dos àtoms. Tots els enllaços amb més d'un parell d'electrons compartit són anomenats enllaços covalents múltiples. Tot i així, comunament també trobem enllaços dobles i enllaços triples.
L'enllaç covalent quàdruple és molt més rar que els simples, dobles i triples. Tant el carboni com el silici poden en teoria formar un enllaç quàdruple; tanmateix, les molècules que formen són extremadament inestables. Si ens imaginem els tres orbitals que es comparteixen en un enllaç triple com esquerra, dreta i amunt, el quart orbital ha de fer-se lloc entre aquests tres, cosa que duu a la inestabilitat. Les molècules de C₂ sols poden ser observades observades en el buit, i les molècules de Si₂ són encara més inestables. S'observen enllaços quàdruples estables entre un element de transició i un metall, o bé entre dos elements de transició, formant compostos organometàl·lics.
S'ha observat l'enllaç sèxtuple, encara més rar, entre elements de transició en estat gasós.[7]
Distància de l'enllaç
[modifica]La longitud d'un enllaç correspon, aproximadament, a la suma dels radis covalents dels àtoms que participen en aquest enllaç. Per tant, com major siguin els radis dels àtoms, majors seran les longituds dels enllaços formats les quals es poden mesurar amb tècniques de difracció o d'espectroscòpia.
Així no obstant, la distància d'enllaç d'equilibri de la molècula no és el mateix que la distància d'enllaç mesurada experimentalment, sinó que la distància d'enllaç d'equilibri de la molècula és la separació internuclear en el mínim de la corba d'energia potencial molecular; mentre que la distància d'enllaç mesurada experimentalment és una mitjana de les distàncies dels enllaços mesurades durant la vibració molecular. Tot i així, s'ignora la diferència entre ambdues mesures, ja que en la majoria dels casos és considerada inapreciable.
Força de l'enllaç
[modifica]L'energia de dissociació d'un enllaç és l'energia necessària per separar un enllaç mitjançant homòlisi o heteròlisi. En el procés d'homòlisis, l'enllaç es trenca i cada àtom queda amb un dels electrons que formaven l'enllaç donant lloc als radicals lliures, entitats químiques amb un nombre imparell d'electrons. En canvi, en el procés d'heteròlisis, quan es trenca l'enllaç, l'àtom amb major electronegativitat reté els dos electrons que formaven l'enllaç donant lloc a dos ions diferents.
Així, la força de l'enllaç ve determinada per l'energia de dissociació, D; com major sigui l'energia de dissociació de l'enllaç, major serà la força d'unió entre els dos àtoms que formen l'enllaç.
Propietats dels compostos covalents
[modifica]La formació d'enllaços covalents pot donar lloc a dos tipus de substàncies amb estructures i propietats completament diferents. Aquestes dues substàncies són els cristalls covalents i les substàncies moleculars. Tot i així, també existeixen substàncies covalents amb estructures especials que no es poden incloure dins cap tipus dels establerts.
Cristalls covalents
[modifica]Els cristalls covalents[8] estan constituïts per xarxes tridimensionals que s'estenen al llarg de tot el cristall on trobem els àtoms units entre si mitjançant enllaços covalents. Normalment els àtoms que formen els cristalls covalents són el carboni, silici i oxigen. El fet que els enllaços covalents siguin molt forts i difícils de rompre fa que els cristalls covalents presentin unes propietats determinades:
Propietats mecàniques:
- Tenen una gran duresa mecànica, que és deguda a la xarxa d'enllaços covalents, ja que, per ratllar els cristalls, s'haurien de rompre els enllaços interatòmics. És a dir, els enllaços covalents són molt forts i necessiten una gran energia per rompre's.
Punt de fusió:
- Tenen punts de fusió elevats, ja que per fondre's, s'han de rompre els enllaços covalents entre els àtoms i, per a això, es necessita una gran temperatura en forma d'energia calorífica. Així, són sòlids a temperatura ambient.
Conductivitat elèctrica:
- Els cristalls covalents són aïllants elèctrics, ja que no presenten càrregues en moviment a causa del fet que els electrons de valència estan units als enllaços covalents molt fermament.
Solubilitat:
- Són molt resistents i insolubles en qualsevol tipus de substàncies, ja que no formen interaccions amb altres àtoms pel fet que es necessita molta energia per rompre els enllaços covalents entre els àtoms dels cristalls.
Exemples: Com a exemples més destacats trobem el diamant, una forma atròpica de carboni amb els àtoms disposats en una xarxa de tetràedres units entre ells mitjançant enllaços covalents amb un punt de fusió de 3550 °C; el diòxid de silici (SiO₂), on cada àtom de silici està rodejat per quatre àtoms d'oxigen units mitjançant enllaços covalents i té un punt de fusió de 1700 °C; i el grafit.
Substàncies moleculars
[modifica]Les substàncies moleculars[9]> són un conjunt de molècules, cada una d'elles formada per àtoms units entre si mitjançant enllaços covalents. Aquestes molècules s'uneixen mitjançant forces intermoleculars, que són molt més dèbils que els enllaços químics. Així, la ruptura d'aquest tipus de forces no implica cap canvi químic sinó un canvi físic, com l'evaporació o la fusió, i són aquestes forces les responsables de les propietats característiques de les substàncies moleculars:
Propietats mecàniques:
- Les substàncies moleculars, degut a la debilitat de les forces intermoleculars, són sòlids tous, ja que quan es ratllen es trenquen les forces intermoleculars; i, en general, no mal·leables.
- Punts de fusió
- Tenen punts de fusió i ebullició baixos el que implica que la majoria d'aquestes substàncies siguin gasos a temperatura ambient.
- Tot i així, depenent de les forces intermoleculars, del nombre d'àtoms que formen les molècules, del seu nombre atòmic i del seu pes molecular, trobem líquids com el brom diatomic (Br₂) o sòlids com el iode (I₂).
- Conductivitat elèctrica
- Degut a l'absència de càrregues elèctriques en moviment, les substàncies moleculars no són conductores de l'electricitat sinó que són aïllants.
Solubilitat:
- La solubilitat de les substàncies moleculars depèn de si es tracta de substàncies formades per molècules polars o per molècules apolars. Així, les primeres es dissoldran en dissolvents polars com l'aigua mentre que les segones ho faran en dissolvents apolars com el tetraclorur de carboni o els hidrocarburs.
- Exemples
- Hi ha moltes substàncies moleculars, però entre elles hi ha l'hidrogen (H₂), l'aigua (H₂O), l'amoníac (NH₃), els compostos orgànics...
Ressonància
[modifica]La ressonància és una propietat que posseeixen algunes substàncies que consisteix en no poder ser representades per una sola estructura de Lewis que resumeixi a la perfecció les seves característiques. Això es deu al fet que les dades experimentals recollides sobre certes propietats d'aquestes substàncies (tals com l'energia o la longitud d'enllaç no permeten resumir-les en una sola forma de Lewis.
Les substàncies que presenten ressonància (que també pot ésser anomenada mesomeria) són anomenades híbrids de ressonància o estat mesomèric i, per tal d'expressar-les correctament, s'hauran de representar mitjançant dues o més estructures separades per un signe de doble fletxa (↔). Cadascuna d'aquestes estructures s'anomena estructura de ressonància (o bé formes límit o formes mesòmeres). Aquestes estructures tenen totes semblant energia i el mateix nombre d'electrons, així com el mateix tipus de nuclis d'àtoms, i únicament es diferencien entre elles per la distribució dels seus àtoms d'enllaç.
Un exemple de molècula que presenta aquesta propietat és l'ozó, O3. La notació de Lewis diu que l'O central formarà un enllaç simple amb un O i un enllaç doble amb l'altre, però no ens diu pas amb quin dels dos O en particular s'ha d'establir el doble enllaç i amb quin el simple; per tant, tant el primer com el segon oxigen tenen la mateixa probabilitat de formar l'enllaç doble.

El que succeeix en la realitat, però, és que l'estat real de l'estructura de les molècules que formen la substància en ressonància és un intermedi entre l'estat que representen totes les formes mesòmeres. És a dir, que cada forma mesòmera per separat no té sentit ni realitat física, sinó que els electrons es distribueixen de manera mitjana entre totes les estructures en ressonància. Aquest estat intermedi té menys energia que totes les formes mesòmeres per separat i, per tant, és més estable.
Tornant al cas de l'ozó, trobem que en lloc de tenir un enllaç doble i un enllaç simple, hi ha de fet dos enllaços d'ordre 1.5 amb aproximadament tres electrons a cada un.
Un cas especial de ressonància es dona en els anells aromàtics d'àtoms, com per exemple en el benzè. Els anells aromàtics són substàncies compostes per àtoms disposats en forma de cercle i s'uneixen entre ells mitjançant enllaços covalents que, segons l'estructura de Lewis, són alternadament simples i dobles. Les seves estructures en ressonància es diferencien entre elles per la posició d'aquests dobles enllaços alterns. De fet, però, els seus electrons tendeixen a distribuir-se uniformement a l'anell d'àtoms. És a dir, que aquests enllaços no són alterns, sinó que en realitat es distribueixen d'una manera més o menys igual per tots els àtoms. És per això que podem afirmar que l'estructura de les substàncies que presenten ressonància és un híbrid entre totes les formes límit que la pretenen representar.[10] En les estructures aromàtiques una altra manera usada sovint per a representar la distribució dels electrons i els enllaços és l'ús d'un cercle dins el cercle d'àtoms en lloc de línies o punts. D'aquesta manera, s'intenta aclarir que no es dona una o altra estructura en ressonància sinó que és una barreja entre ambdues.
Vegeu també
[modifica]Referències
[modifica]- ↑ «Educamix en línia». Arxivat de l'original el 2010-12-21. [Consulta: 13 desembre 2010].
- ↑ «Clases de apoyo en línia». Arxivat de l'original el 2010-12-19. [Consulta: 13 desembre 2010].
- ↑ Ventanas al Universo en línia
- ↑ http://www.xtec.cat/~afaro1/4ESO/Activitats/10.configuracio.elect.html
- ↑ All about Chemical Bounding[en línia]: http://www.chem1.com/acad/webtext/chembond/cb03.html
- ↑ http://www.acienciasgalilei.com/qui/pdf-qui/ecovalente.pdf
- ↑ «Còpia arxivada». Arxivat de l'original el 2010-11-10. [Consulta: 13 desembre 2010].
- ↑ Educared [en línia]: http://portales.educared.net/wikiEducared/index.php?title=Propiedades_de_los_compuestos_covalentes._Disolventes_apolares[Enllaç no actiu]
- ↑ http://www.buenastareas.com/ensayos/Compuestos-Covalentes/166298.html
- ↑ Alipso en línia



