Pèptid


Els pèptids (del grec πεπτος, 'digerible') són un tipus de molècules formades per la unió de diversos aminoàcids mitjançant enllaços peptídics, o enllaç triple amb una conjugació d'ADN (àcid desoxiribonucleic)
Els pèptids, igual que les proteïnes, estan presents en la natura i són responsables per un gran nombre de funcions, moltes de les quals encara no es coneixen.
La unió d'un baix nombre d'aminoàcids dona lloc a un pèptid:
- Oligopèptid: menys de 10 aminoàcids.
- Polipèptid: més de 10 aminoàcids.
- Proteïna: més de 100 aminoàcids. Les proteïnes amb una sola cadena polipeptídica es denominen proteïnes monomèriques, mentre que les compostes de més d'una cadena polipeptídica es coneixen com a proteïnes multimèriques.
Els pèptids es diferencien de les proteïnes en què són més petits (tenen menys de deu mil o dotze mil Daltons) i que les proteïnes poden estar formades per la unió de diversos polipèptids i de vegades grups prostètics. Un exemple de polipèptid és la insulina, composta de 51 aminoàcids i coneguda com una hormona d'acord amb la funció que té en l'organisme dels éssers humans.
L'enllaç peptídic
[modifica]Veure enllaç peptídic.
Comportament àcid/base dels pèptids
[modifica]Com que tenen un grup amino-terminal i un carboxil-terminal, i poden tenir grups R ionitzables, els pèptids tenen un comportament àcid/bàsic similar al dels aminoàcids.
Els pèptids, com els aminoàcids i les proteïnes són biomolècules amb un caràcter amfòter que permeten la regulació homeostàtica dels organismes.
És de destacar aquest comportament en els enzims, pèptids que funcionen com a catalitzadors biològics de les reaccions metabòliques, ja que tenen una valència d'actuació dins de certs nivells de pH. Si se supera es produeix una descompensació de càrregues en la superfície de l'enzim, que perd la seva estructura i la seva funció.
Reaccions químiques dels pèptids
[modifica]Són les mateixes que per als aminoàcids; és a dir, les que del seu grup amino, carboxil i R. Aquestes reaccions (sobretot les dels grups amino i carboxil) s'han fet servir per a seqüenciar pèptids.
Reaccions del grup amino
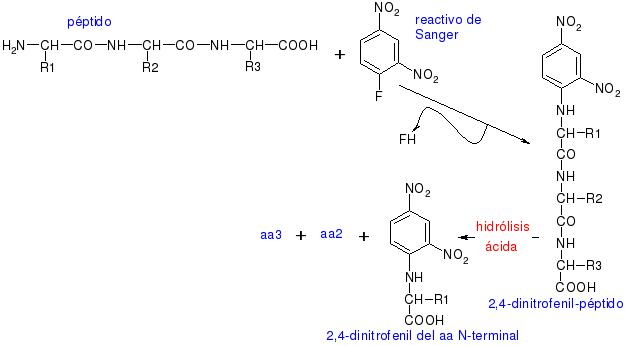
[modifica]En les reaccions del grup amino, és molt interessant la reacció amb el reactiu de Sanger per seqüenciar, ja que si tenim el 2,4-dinitrofenil-pèptid i els hidrolitzats per hidròlisi àcida, s'hidrolitzen tots els enllaços peptídics i obtindrem el dinitrofenil del primer aminoàcid de la seqüència, el terminal, més la resta dels aminoàcids disgregats en el medi.
Amb aquesta reacció Sanger va aconseguir seqüenciar la insulina.
En aquesta reacció, el nucli acolorit de dinitrobenzè s'uneix a l'àtom de nitrogen de l'aminoàcid per produir un derivat groc, el derivat 2,4-dinitrofenil o DNP-aminoàcid. El compost DNFB reaccionarà amb el grup amino lliure de l'extrem amino d'un polipèptid, i també amb els grups amino dels aminoàcids lliures. L'enllaç C - N que es forma és en general molt més estable que un enllaç peptídic. D'aquesta manera, fent reaccionar una proteïna nativa o un polipèptid intacte amb el DNFB, hidrolitzant la proteïna en àcid i aïllant els DNP-aminoàcids acolorits, pot identificar el grup amino terminal de l'aminoàcid en una cadena polipeptídica. El grup amino-terminal de la lisina i alguns altres grups funcionals de les cadenes laterals també reaccionessin amb el DNFB.
No obstant això, després de la hidròlisi, només el derivat del grup amino terminal de l'aminoàcid original tindrà el seu grup α-amino bloquejat, així mateix, com DNP-α-aminoàcids poden separar d'altres derivats DNP mitjançant procediments d'extracció simples. Amb qualsevol dels variats mètodes cromatogràfics es podrà identificar els DNP-α-aminoàcids
Però aquest procés consumeix molta energia, ja que, tenint el primer aminoàcid cal obtenir els altres trencant per altres zones. Això s'evita amb el procediment d'Edman (també és una reacció d'aminoàcids): Com la ciclació es dona en condicions àcides suaus, no es trenquen els enllaços, i es dona la feniltiohidantoína de l'aminoàcid -terminal + la resta del pèptid intacte.
Es separen dos compostos i per cromatografia es detecta. Amb la resta del pèptid se segueix amb el mateix procediment fins a tenir la seqüència completa. Aquest mètode es coneix com a Degradació d'Edman, i és la reacció que fan servir els seqüenciadors automàtics de proteïnes. Però aquests seqüenciadors només poden seqüenciar els 20-30 primers aminoàcids, de manera que haurem d'hidrolitzar i seguir després. Això és perquè el rendiment no és del 100% i perdem pèptid a poc a poc, i al final no ens queda. Només els enzims aconsegueixen un rendiment al 100%.
Reaccions del grup carboxil
[modifica]També podem seqüenciar començant per l'extrem carboxil-terminal, per al que s'usen enzims com la carboxipeptidasa. És una proteasa que hidrolitza els enllaços peptídics. Aquesta en concret és una exoproteasa (ataca la proteïna per un extrem) que ataca a l'extrem carboxil-terminal. S'utilitzen 2 tipus, la carboxipeptidasa A i B. Catalitzen la mateixa reacció, però tenen especificitat diferent. L'A només trenca l'enllaç peptídic si l'aminoàcid carboxil-terminal és hidròfob. La B el trenca si és bàsic. Cal controlar molt bé el temps de reacció, ja que quan s'allibera un carboxil-terminal el següent aminoàcid es converteix en el carboxil-terminal.
Reaccions dels grups R
[modifica]Respecte a les reaccions dels grups R, hi ha molts reactius que reaccionen de forma específica amb determinats grups R (OH de la serina, tiol de la cisteïna ...). Això es fa servir per veure quin aminoàcid és essencial per al funcionament de la proteïna. Dins de les reaccions dels grups R, una interessant des del punt de vista d'aïllament i purificació de proteïnes és la del grup tiòlics (SH) de la cisteïna, que és fortament reductor. En presència de O2 té molta tendència a oxidar. Si hi ha dues molècules de cisteïna, en presència d'oxigen, s'oxiden per originar una molècula de cistina:
Això passa sovint en una proteïna, quan es plega i dues molècules de cisteïna queden pròximes en l'espai, generant un pont disulfur. El pont disulfur ocorre de forma natura, i ha de formar-se per estabilitzar l'estructura tridimensional de la proteïna. No obstant això, pot ser que no hagi de passar de manera natural, per exemple, si hi ha cisteïnes essencials exposades (necessàries per a la funcionalitat). Quan aïllem una proteïna del seu entorn natural, posem a la proteïna en presència d'oxigen, de manera que aquests grups tiòlics es poden oxidar, i la proteïna perdre la seva funcionalitat. Per evitar això, en els mitjans d'aïllament i purificació de proteïnes afegim β-mercapto-etanol, el grup tiòlics és més reductor que el de la mateixa cisteïna, té més tendència a oxidar.
De manera que en afegir β-mercapto-etanol, aquest s'oxida i protegeix així els grups tiòlics de la cisteïna.
Quan volem estudiar la composició d'aminoàcids d'una proteïna hem d'hidrolitzar-la completament, amb el que tenim una barreja de tot el conjunt d'aminoàcids lliures que constitueixen aquesta proteïna. Per evitar, en tota aquesta manipulació, que les Cys que tinguem en el medi s'oxidin, hem de protegir el seu grup tiòlic afegint com a reactiu iodoacetat:
Així transformem la cisteïna a carboximetilcisteïna.
| Principals famíles bioquímiques | ||
| Àcids nucleics | Alcaloides | Aminoàcids | Carbohidrats | Carotenoides | Cofactors enzimàtics | Esteroides | Flavonoides | Glicòsids | Lípids | Pèptids | Policètids | Tetrapirrols | Terpens | ||
| Anàlegs d'àcids nucleics: | Anàlegs d'àcids nucleics : | |




