Diole
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie

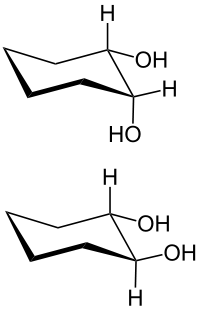

Diole sind organische Verbindungen, die zwei alkoholische Hydroxygruppen (–OH) enthalten, also zweiwertige Alkohole (Dialkohole).
Ein Beispiel für ein einfaches, stabiles Diol ist Ethylenglycol (1,2-Ethandiol).
Einteilung[Bearbeiten | Quelltext bearbeiten]
Alkandiole[Bearbeiten | Quelltext bearbeiten]
Je nach relativer Stellung der beiden alkoholischen Hydroxygruppen im Molekül unterscheidet man zwischen
- 1,2-Diolen (vicinal) Beispiel: Ethylenglycol (Glycole)
- 1,3-Diolen
- 1,4-Diolen
Geminale Diole, bei denen die Hydroxygruppen am gleichen C-Atom stehen, sind nach der Erlenmeyer-Regel nicht stabil und reagieren unter Abspaltung von Wasser. Es gibt jedoch Ausnahmen wie Chloralhydrat oder Ninhydrin.
Bei 1,2-Diolen, die z. B. von einem Cycloalkan abgeleitet sind, unterscheidet man zwischen cis-1,2-Diolen und trans-1,2-Diolen.[1]
Polyethylenglycole[Bearbeiten | Quelltext bearbeiten]
α,ω-Diole die durch Kondensation von Ethylenglycol entstehen Diethylenglycol, Triethylenglycol, Polyethylenglycol.
Endiole[Bearbeiten | Quelltext bearbeiten]
Endiole (oder Reduktone) sind eine Untergruppe der Diole.
Aldehydhydrate[Bearbeiten | Quelltext bearbeiten]
Das formal einfachste – nur in wässriger Lösung stabile – Diol ist das Aldehydhydrat des Formaldehyds, das Methandiol. Viele Lehrbücher zählen Aldehydhydrate allerdings nicht zu den Diolen.
Dihydroxybenzole[Bearbeiten | Quelltext bearbeiten]
Dihydroxybenzole zählen nicht zu den Diolen, ebenso wie Phenol nicht zu den Alkoholen gerechnet wird.[2][3]
Verwendung[Bearbeiten | Quelltext bearbeiten]
1,2-Ethandiol wird als Frostschutzmittel in wassergekühlten Verbrennungsmotoren und in Klimaanlagen verwendet. Diole werden in der chemischen Industrie bei der Herstellung von Polyestern, Polycarbonaten und Polyurethanen mittels Polykondensation und Polyaddition (bei Polyurethan) benötigt. Kunststofffasern aus Polyestern finden in der Textilindustrie unter dem Handelsnamen Diolen Verwendung.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Siegfried Hauptmann: Organische Chemie. 2. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 235–236.
- ↑ Brockhaus ABC Chemie. F. A. Brockhaus Verlag, Leipzig 1965, S. 44.
- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 122–123.