Ácido truxílico

| Ácido truxílico | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Ácido 2,4-difenilciclobutan-1,3-dicarboxílico | ||
| General | ||
| Fórmula semidesarrollada | (C6H5)2C4H4(COOH)2 | |
| Fórmula molecular | C18H16O4 | |
| Identificadores | ||
| Número CAS | 4462-95-7[1] | |
| PubChem | 78213 | |
| Propiedades físicas | ||
| Densidad | 1323 kg/m³; 1,323 g/cm³ | |
| Masa molar | 296,317 g/mol | |
| Punto de ebullición | 470,5 °C (744 K) | |
| Índice de refracción (nD) | 1.629 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Los ácidos truxílicos son ácidos dicarboxílicos cíclicos estereoisómeros de fórmula (C6H5)2C4H4(COOH)2 que se obtienen de diversas plantas[2][3] y por fotodimerización del ácido cinámico,[4] donde los dos alquenos trans reaccionan cabeza-con-cola en una reacción de cicloadición fotoquímica, y los isómeros aislados se denominan ácidos truxílicos:

Los ácidos truxílicos son isómeros de los ácidos truxínicos. Un estudio reciente demostró que la estructura dimérica de derivados del ácido alfa-truxílico juegan un papel importante en la expresión de sus actividades antiinflamatorias. Se investigó la correlación entre la estructura y la actividad antiinflamatoria de los ácidos alfa-truxílico (y algunos derivados de este) y del beta-truxínico (y derivados de este), concluyendo que podría ser un nuevo fármaco antiinflamatorio suave.[5]
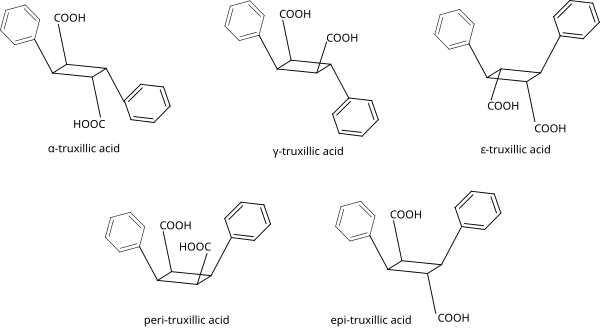
Isómeros del ácido truxílico
[editar]El ácido truxílico cuenta con 4 átomos de carbono quirales (4 centros quirales) y, por lo tanto, esperaríamos encontrar 16 estereoisómeros (24), pero tenemos que tener cuidado de restar de ese número los compuestos que posean planos de simetría y centros de inversión (que generan pares de enantiómeros idénticos). Para simplificar las cosas vamos a escribir "COOH" y "C6H5" para representar a los grupos funcionales.
Al tener un ciclobutano con 4 grupos funcionales iguales 2 a 2, el número de estereoisómeros se reduce drásticamente, y puesto que se encuentran alternados en los vértices del ciclobutano, la gran simetría de estos compuestos hacen que solo se encuentren 5 posibles estereoisómeros en la naturaleza:[6][7][8]

| Isómero | a | b | c | d | e | f |
|---|---|---|---|---|---|---|
| α-truxílico | COOH | H | H | C6H5 | H | COOH |
| γ-truxílico | COOH | H | H | C6H5 | COOH | H |
| ε-truxílico | H | COOH | C6H5 | H | H | COOH |
| peri-truxílico | COOH | H | C6H5 | H | COOH | H |
| epi-truxílico | COOH | H | C6H5 | H | H | COOH |
Los ácidos peri- y ε-truxílicos poseen 2 planos de simetría (entre otros elementos de simetría), los ácidos epi- y γ-truxílicos poseen un plano de simetría, y el ácido α-truxílico posee un centro de inversión. Estos elementos de simetría impiden que estos compuestos tengan enantiómeros, por lo que todos ellos son compuestos no quirales (no poseen actividad óptica).
En la siguiente figura se muestran las estructuras completas de estos ácidos truxílicos (con sus nombres en inglés):
Bibliografía
[editar]- ↑ Número CAS
- ↑ Liebermann (1888). «Cinnamic acid polymers obtained from the minor alkaloids of cocaine». Berichte der Deutschen Chemischen Gesellschaft 21.
- ↑ Krauze-Baranowska, Miroslawa (2002). «Truxillic and truxinic acids-ocurrence in plant kingdom». Acta poliniae Pharmaceutica-Drug research 59 (5): 403-410.
- ↑ Hein, Sara M. (junio de 2006). «An Exploration of a Photochemical Pericyclic Reaction Using NMR Data». Journal of Chemical Education 83: 940 - 942. doi:10.1021/ed083p940.
- ↑ Chi YM, Nakamura M, Zhao XY, Yoshizawa T, Yan WM, Hashimoto F, Kinjo J, Nohara T, Sakurada S. (2006). «Antinociceptive activities of alpha-truxillic acid and beta-truxinic acid derivatives». Biol Pharm Bull. 29 (3): 580-4.
- ↑ Stoermer (1924). «Five stereoisomers have been obtained: alfa-, gamma-, epsilon-, peri- and epi-isomers. Stereochemical configurations». Berichte der Deutschen Chemischen Gesellschaft, B: Abhandlungen. 57B: 15-23.
- ↑ Agarwai, O. P. (2011). Organic Chemistry Reactions and Reagents. Krishna Prakashan Media. ISBN 8187224657.
- ↑ «Zur Stereochemie der Truxillsäuren (VII.). (Nach Versuchen mit Christian Wegner und Alfred Carl.)». Berichte der deutschen chemischen Gesellschaft (A and B Series) 56 (7): 1683-1695. 1923. doi:10.1002/cber.19230560734.