Cortistatina

| Cortistatina A | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
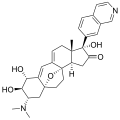
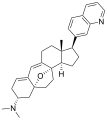
| (1R,2R,3S,5R,8β,17β)-3-(Dimethylamino)-17-(isoquinolin-7-yl)-5,8-epoxy-9,19-cyclo-9,10-secoandrosta-9(11),10-diene-1,2-diol | ||
| General | ||
| Otros nombres | Cortistatina A | |
| Fórmula molecular | C 30H 36N 2O 3 | |
| Identificadores | ||
| Número CAS | 882976-95-6[1] | |
| ChEBI | 67171 | |
| ChemSpider | 9736681 | |
| PubChem | 11561907 | |
| C[C@]12CC=C3C=C4[C@H]([C@@H]([C@H](C[C@]45CC[C@@]3([C@@H]1CC[C@@H]2c6ccc7ccncc7c6)O5)N(C)C)O)O | ||
| Propiedades físicas | ||
| Masa molar | 472,62 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Las cortistatinas son un grupo de esteroides alcaloides que fueron por primera vez aislados en 2006 de la esponja marina Corticium simplex.[2] Los cortistatinas inhiben la proliferación de células endoteliales de la vena umbilical humana ( HUVEC ) con alta selectividad, con la cortistatina A que es el compuesto más potente en su clase.[3] Cortistatina A reprime la replicación viral en células infectadas con el VIH a través de la unión a la Tat proteína.[4]
La estructura química única y potente actividad biológica de estos compuestos han estimulado el interés en su síntesis total y posterior evaluación biológica.[5][6]
Estructuras químicas
[editar]- Cortistatina A
- Cortistatina B
- Cortistatina C
- Cortistatina D
- Cortistatina E
- Cortistatina F
- Cortistatina G
- Cortistatina H
- Cortistatina J
- Cortistatina K
- Cortistatina L
Referencias
[editar]- ↑ Número CAS
- ↑ Aoki, S; Watanabe, Y; Sanagawa, M; Setiawan, A; Kotoku, N; Kobayashi, M (2006). «Cortistatins A, B, C, and D, anti-angiogenic steroidal alkaloids, from the marine sponge Corticium simplex». Journal of the American Chemical Society 128 (10): 3148-9. PMID 16522087. doi:10.1021/ja057404h.
- ↑ Aoki, S; Watanabe, Y; Tanabe, D; Arai, M; Suna, H; Miyamoto, K; Tsujibo, H; Tsujikawa, K; Yamamoto, H (2007). «Structure-activity relationship and biological property of cortistatins, anti-angiogenic spongean steroidal alkaloids». Bioorganic & Medicinal Chemistry 15 (21): 6758-62. PMID 17765550. doi:10.1016/j.bmc.2007.08.017.
- ↑ Mousseau, G.; Clementz, M. A.; Bakeman, W. N.; Nagarsheth, N.; Cameron, M.; Shi, J.; Baran, P.; Fromentin, R. M.; Chomont, N.; Valente, S. T. (2012). "An Analog of the Natural Steroidal Alkaloid Cortistatin a Potently Suppresses Tat-Dependent HIV Transcription". Cell Host & Microbe 12 (1): 97–108. doi:10.1016/j.chom.2012.05.016. PMC 3403716. PMID 22817991.
- ↑ Chen, David Yu-Kai; Tseng, Chih-Chung (2010). «Chemistry of the cortistatins–a novel class of anti-angiogenic agents». Organic & Biomolecular Chemistry 8 (13): 2900. doi:10.1039/C003935G.
- ↑ Hardin Narayan, Alison R.; Simmons, Eric M.; Sarpong, Richmond (2010). «Synthetic Strategies Directed Towards the Cortistatin Family of Natural Products». European Journal of Organic Chemistry 2010 (19): 3553. doi:10.1002/ejoc.201000247.
Enlaces extaernos
[editar]- Esta obra contiene una traducción derivada de «Cortistatins» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.