Espectroscopia de absorción


La espectroscopía de absorción se refiere a técnicas espectroscópicas que miden la absorción de radiación, en función de la frecuencia o longitud de onda, debido a su interacción con una muestra. La muestra absorbe energía, es decir, fotones, del campo radiante. La intensidad de la absorción varía en función de la frecuencia y esta variación es el espectro de absorción. La espectroscopía de absorción se realiza a través del espectro electromagnético.
La espectroscopía de absorción se emplea como una herramienta de química analítica para determinar la presencia de una sustancia particular en una muestra y, en muchos casos, para cuantificar la cantidad de la sustancia presente. La espectroscopía infrarroja y ultravioleta-visible es particularmente común en aplicaciones analíticas. La espectroscopía de absorción también se emplea en estudios de física molecular y atómica, espectroscopía astronómica y teledetección.
Existe una amplia gama de enfoques experimentales para medir los espectros de absorción. La disposición más común es dirigir un haz de radiación generado hacia una muestra y detectar la intensidad de la radiación que la atraviesa. La energía transmitida se puede utilizar para calcular la absorción. La fuente, la disposición de la muestra y la técnica de detección varían significativamente según el rango de frecuencia y el propósito del experimento.
Los siguientes son los tipos principales de espectroscopía de absorción:[1]
| No | Radiación electromagnética | Tipo espectroscópico |
|---|---|---|
| 1 | Rayos X | espectroscopía de absorción de rayos X |
| 2 | Ultravioleta: visible | espectroscopía de absorción UV-vis |
| 3 | Infrarrojo | espectroscopía de absorción de infrarrojos |
| 4 | Microonda | espectroscopía de absorción de microondas |
| 5 | Onda de radio | Espectroscopía de resonancia de espín electrónico Resonancia magnética nuclear espectroscópica |
Espectro de absorción
[editar]
El espectro de absorción de un material es la fracción de radiación incidente absorbida por el material en un rango de frecuencias. El espectro de absorción se determina principalmente[2][3][4] por la composición atómica y molecular del material. Es más probable que la radiación se absorba a frecuencias que coincidan con la diferencia de energía entre dos estados de la mecánica cuántica de las moléculas. La absorción que se produce debido a una transición entre dos estados se denomina línea de absorción y un espectro suele estar compuesto por muchas líneas.
Las frecuencias donde ocurren las líneas de absorción, así como sus intensidades relativas, dependen principalmente de la estructura electrónica y molecular de la muestra. Las frecuencias también dependerán de las interacciones entre las moléculas de la muestra, la estructura cristalina en los sólidos y de varios factores ambientales (por ejemplo, temperatura, presión, campo electromagnético). Las líneas también tendrán un ancho y una forma que están determinados principalmente por la densidad espectral o la densidad de estados del sistema.
Teoría
[editar]Las líneas de absorción se clasifican típicamente por la naturaleza del cambio mecánico cuántico inducido en la molécula o átomo. Las líneas de rotación, por ejemplo, ocurren cuando se cambia el estado de rotación de una molécula. Las líneas de rotación se encuentran típicamente en la región espectral de microondas. Las líneas vibratorias corresponden a cambios en el estado vibratorio de la molécula y se encuentran típicamente en la región infrarroja. Las líneas electrónicas corresponden a un cambio en el estado electrónico de un átomo o molécula y se encuentran típicamente en la región visible y ultravioleta. Las absorciones de rayos X están asociadas con la excitación de los electrones de la capa interna en los átomos. Estos cambios también se pueden combinar (por ejemplo, transiciones de rotación-vibración), lo que lleva a nuevas líneas de absorción a la energía combinada de los dos cambios.
La energía asociada con el cambio de la mecánica cuántica determina principalmente la frecuencia de la línea de absorción, pero la frecuencia puede cambiar mediante varios tipos de interacciones. Los campos eléctricos y magnéticos pueden provocar un cambio. Las interacciones con moléculas vecinas pueden provocar cambios. Por ejemplo, las líneas de absorción de la molécula en fase gaseosa pueden cambiar significativamente cuando esa molécula está en una fase líquida o sólida e interactúa más fuertemente con moléculas vecinas.
El ancho y la forma de las líneas de absorción están determinados por el instrumento utilizado para la observación, el material que absorbe la radiación y el entorno físico de ese material. Es común que las líneas tengan la forma de una distribución gaussiana o lorentziana. También es común que una línea se describa únicamente por su intensidad y ancho en lugar de caracterizar la forma completa.
La intensidad integrada, que se obtiene al integrar el área debajo de la línea de absorción, es proporcional a la cantidad de sustancia absorbente presente. La intensidad también está relacionada con la temperatura de la sustancia y la interacción mecánica cuántica entre la radiación y el absorbente. Esta interacción se cuantifica por el momento de transición y depende del estado inferior particular desde el que comienza la transición y del estado superior al que está conectada.
El ancho de las líneas de absorción puede ser determinado por el espectrómetro utilizado para registrarlo. Un espectrómetro tiene un límite inherente sobre qué tan estrecha puede resolver una línea y, por lo tanto, el ancho observado puede estar en este límite. Si el ancho es mayor que el límite de resolución, entonces está determinado principalmente por el entorno del absorbedor. Un absorbedor líquido o sólido, en el que las moléculas vecinas interactúan fuertemente entre sí, tiende a tener líneas de absorción más amplias que un gas. El aumento de la temperatura o la presión del material absorbente también tenderá a aumentar el ancho de la línea. También es común que varias transiciones vecinas estén lo suficientemente cerca entre sí como para que sus líneas se superpongan y, por lo tanto, la línea general resultante sea aún más amplia.
Relación con el espectro de transmisión
[editar]Los espectros de absorción y transmisión representan información equivalente y uno puede calcularse a partir del otro mediante una transformación matemática. Un espectro de transmisión tendrá sus intensidades máximas en las longitudes de onda donde la absorción es más débil porque se transmite más luz a través de la muestra. Un espectro de absorción tendrá sus intensidades máximas en las longitudes de onda donde la absorción es más fuerte.
Relación con el espectro de emisión
[editar]
La emisión es un proceso mediante el cual una sustancia libera energía en forma de radiación electromagnética. La emisión puede ocurrir a cualquier frecuencia a la que pueda ocurrir la absorción, y esto permite que las líneas de absorción se determinen a partir de un espectro de emisión. Sin embargo, el espectro de emisión normalmente tendrá un patrón de intensidad bastante diferente del espectro de absorción, por lo que los dos no son equivalentes. El espectro de absorción se puede calcular a partir del espectro de emisión utilizando coeficientes de Einstein.
Relación con los espectros de dispersión y reflexión
[editar]Los espectros de dispersión y reflexión de un material están influenciados tanto por su índice de refracción como por su espectro de absorción. En un contexto óptico, el espectro de absorción se cuantifica típicamente mediante el coeficiente de extinción, y los coeficientes de extinción y de índice se relacionan cuantitativamente mediante la relación Kramers-Kronig. Por tanto, el espectro de absorción se puede derivar de un espectro de reflexión o de dispersión. Por lo general, esto requiere la simplificación de supuestos o modelos, por lo que el espectro de absorción derivado es una aproximación.
Aplicaciones
[editar]
La espectroscopía de absorción es útil en el análisis químico[5] debido a su especificidad y su naturaleza cuantitativa. La especificidad de los espectros de absorción permite que los compuestos se distingan entre sí en una mezcla, lo que hace que la espectroscopía de absorción sea útil en una amplia variedad de aplicaciones. Por ejemplo, los analizadores de gases infrarrojos se pueden utilizar para identificar la presencia de contaminantes en el aire, distinguiendo el contaminante del nitrógeno, oxígeno, agua y otros componentes esperados.[6]
La especificidad también permite identificar muestras desconocidas comparando un espectro medido con una biblioteca de espectros de referencia. En muchos casos, es posible determinar información cualitativa sobre una muestra incluso si no está en una biblioteca. Los espectros infrarrojos, por ejemplo, tienen bandas de absorción características que indican si están presentes enlaces carbono-hidrógeno o carbono-oxígeno.
Un espectro de absorción se puede relacionar cuantitativamente con la cantidad de material presente usando la ley de Beer-Lambert. La determinación de la concentración absoluta de un compuesto requiere el conocimiento del coeficiente de absorción del compuesto. El coeficiente de absorción de algunos compuestos está disponible en fuentes de referencia y también se puede determinar midiendo el espectro de un estándar de calibración con una concentración conocida del objetivo.
Sensores remotos
[editar]Una de las ventajas únicas de la espectroscopía como técnica analítica es que se pueden realizar mediciones sin que el instrumento y la muestra entren en contacto. La radiación que viaja entre una muestra y un instrumento contendrá la información espectral, por lo que la medición se puede realizar de forma remota. La detección espectral remota es valiosa en muchas situaciones. Por ejemplo, las mediciones se pueden realizar en entornos tóxicos o peligrosos sin poner en riesgo a un operador o instrumento. Además, el material de la muestra no tiene que ponerse en contacto con el instrumento, evitando una posible contaminación cruzada.
Las mediciones espectrales remotas presentan varios desafíos en comparación con las mediciones de laboratorio. El espacio entre la muestra de interés y el instrumento también puede tener absorciones espectrales. Estas absorciones pueden enmascarar o confundir el espectro de absorción de la muestra. Estas interferencias de fondo también pueden variar con el tiempo. La fuente de radiación en las mediciones remotas suele ser una fuente ambiental, como la luz solar o la radiación térmica de un objeto cálido, y esto hace necesario distinguir la absorción espectral de los cambios en el espectro de la fuente.
Para simplificar estos desafíos, la espectroscopía de absorción óptica diferencial ha ganado cierta popularidad, ya que se centra en las características de absorción diferencial y omite la absorción de banda ancha, como la extinción de aerosoles y la extinción debida a la dispersión Rayleigh. Este método se aplica a mediciones terrestres, aéreas y satelitales. Algunos métodos terrestres brindan la posibilidad de recuperar perfiles de gases traza estratosféricos y troposféricos.
Astronomía
[editar]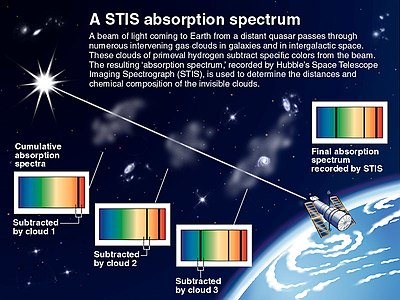
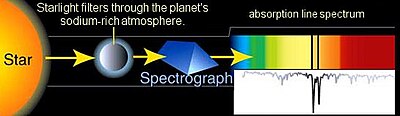
La espectroscopía astronómica es un tipo particularmente significativo de detección espectral remota. En este caso, los objetos y muestras de interés están tan lejos de la tierra que la radiación electromagnética es el único medio disponible para medirlos. Los espectros astronómicos contienen información espectral de emisión y absorción. La espectroscopía de absorción ha sido particularmente importante para comprender las nubes interestelares y determinar que algunas de ellas contienen moléculas. La espectroscopía de absorción también se emplea en el estudio de planetas extrasolares. La detección de planetas extrasolares por el método de tránsito también mide su espectro de absorción y permite la determinación de la composición atmosférica del planeta,[7] temperatura, presión y altura de escala, y por lo tanto también permite la determinación de la masa del planeta.[8]
Física atómica y molecular
[editar]Los modelos teóricos, principalmente modelos de mecánica cuántica, permiten relacionar los espectros de absorción de átomos y moléculas con otras propiedades físicas como la estructura electrónica, la masa atómica o molecular y la geometría molecular. Por lo tanto, las mediciones del espectro de absorción se utilizan para determinar estas otras propiedades. La espectroscopía de microondas, por ejemplo, permite la determinación de longitudes y ángulos de enlace con alta precisión.
Además, las mediciones espectrales se pueden utilizar para determinar la precisión de las predicciones teóricas. Por ejemplo, no se esperaba que existiera el desplazamiento de Lamb medido en el espectro de absorción atómica de hidrógeno en el momento en que se midió. Su descubrimiento estimuló y guio el desarrollo de la electrodinámica cuántica, y ahora se utilizan medidas del desplazamiento de Lamb para determinar la constante de estructura fina.
Métodos experimentales
[editar]Enfoque básico
[editar]El enfoque más sencillo para la espectroscopía de absorción es generar radiación con una fuente, medir un espectro de referencia de esa radiación con un detector y luego volver a medir el espectro de la muestra después de colocar el material de interés entre la fuente y el detector. Los dos espectros medidos se pueden combinar para determinar el espectro de absorción del material. El espectro de la muestra por sí solo no es suficiente para determinar el espectro de absorción porque se verá afectado por las condiciones experimentales: el espectro de la fuente, el espectro de absorción de otros materiales entre la fuente y el detector y las características dependientes de la longitud de onda del detector. Sin embargo, el espectro de referencia se verá afectado de la misma manera por estas condiciones experimentales y, por lo tanto, la combinación produce el espectro de absorción del material solo.
Se emplea una amplia variedad de fuentes de radiación para cubrir el espectro electromagnético. Para la espectroscopía, generalmente es deseable que una fuente cubra una amplia franja de longitudes de onda para medir una amplia región del espectro de absorción. Algunas fuentes emiten inherentemente un amplio espectro. Ejemplos de estos incluyen globares u otras fuentes de cuerpos negros en el infrarrojo, lámparas de mercurio en los tubos de rayos X y visible y ultravioleta. Una nueva fuente de radiación de amplio espectro desarrollada recientemente es la radiación sincrotrón que cubre todas estas regiones espectrales. Otras fuentes de radiación generan un espectro estrecho, pero la longitud de onda de emisión se puede ajustar para cubrir un rango espectral. Ejemplos de estos incluyen klistrones en la región de microondas y láseres en la región infrarroja, visible y ultravioleta (aunque no todos los láseres tienen longitudes de onda sintonizables).
El detector empleado para medir la potencia de radiación también dependerá del rango de longitud de onda de interés. La mayoría de los detectores son sensibles a un rango espectral bastante amplio y el sensor seleccionado a menudo dependerá más de los requisitos de sensibilidad y ruido de una medición determinada. Ejemplos de detectores comunes en espectroscopía incluyen receptores heterodinos en microondas, bolómetros en ondas milimétricas e infrarrojos, telururo de mercurio cadmio y otros detectores de semiconductores refrigerados en infrarrojos, y fotodiodos y tubos fotomultiplicadores en el visible y ultravioleta.
Si tanto la fuente como el detector cubren una amplia región espectral, entonces también es necesario introducir un medio para resolver la longitud de onda de la radiación para determinar el espectro. A menudo, se utiliza un espectrógrafo para separar espacialmente las longitudes de onda de la radiación de modo que la potencia en cada longitud de onda se pueda medir de forma independiente. También es común emplear interferometría para determinar el espectro; la espectroscopía infrarroja por transformada de Fourier es una implementación ampliamente utilizada de esta técnica.
Otras dos cuestiones que deben tenerse en cuenta al preparar un experimento de espectroscopía de absorción incluyen la óptica utilizada para dirigir la radiación y los medios para sostener o contener el material de muestra (llamado cubeta o celda). Para la mayoría de las mediciones UV, visible y NIR, es necesario el uso de cubetas de cuarzo de precisión. En ambos casos, es importante seleccionar materiales que tengan relativamente poca absorción propia en el rango de longitud de onda de interés. La absorción de otros materiales podría interferir o enmascarar la absorción de la muestra. Por ejemplo, en varios rangos de longitud de onda es necesario medir la muestra al vacío o en un entorno de gas noble porque los gases en la atmósfera tienen características de absorción que interfieren.
Enfoques específicos
[editar]- Espectroscopía astronómica
- Espectroscopía de anillo de cavidad (CRDS)
- Espectrometría de absorción láser (LAS)
- Espectroscopia Mössbauer
- Espectroscopía fotoacústica
- Espectroscopia de fotoemisión
- Microscopía óptica fototérmica
- Espectroscopía fototérmica
- Espectroscopia de reflectancia difusa
- Espectroscopia de absorción de láser de diodo sintonizable (TDLAS)
- Estructura fina de absorción de rayos X (XAFS)
- Absorción de rayos X cerca de la estructura del borde (XANES)
- espectroscopía de absorción total (TAS)
- espectroscopía infrarroja de reflexión-absorción (RAIRS)
Véase también
[editar]- Absorción (óptica)
- Densitometría
- HITRAN
- Analizador infrarrojo de gases
- Espectroscopia infrarroja de carbonilos metálicos
- Densidad óptica
- Espectroscopia de fotoemisión
- Materiales transparentes
- Absorción de agua
- Células de absorción espectroscópica multipaso
- Espectroscopia de absorción de rayos X
Referencias
[editar]- ↑ Kumar, Pranav (2018). Fundamentals and Techniques of Biophysics and Molecular biology. New Delhi: Pathfinder publication. p. 33. ISBN 978-93-80473-15-4.
- ↑ Modern Spectroscopy (Paperback) by J. Michael Hollas ISBN 978-0-470-84416-8
- ↑ Symmetry and Spectroscopy: An Introduction to Vibrational and Electronic Spectroscopy (Paperback) by Daniel C. Harris, Michael D. Bertolucci ISBN 978-0-486-66144-5
- ↑ Spectra of Atoms and Molecules by Peter F. Bernath ISBN 978-0-19-517759-6
- ↑ James D. Ingle Jr. and Stanley R. Crouch, Spectrochemical Analysis, Prentice Hall, 1988, ISBN 0-13-826876-2
- ↑ «Gaseous Pollutants – Fourier Transform Infrared Spectroscopy». Archivado desde el original el 23 de octubre de 2012. Consultado el 30 de septiembre de 2009.
- ↑ Khalafinejad, S.; Essen, C. von; Hoeijmakers, H. J.; Zhou, G.; Klocová, T.; Schmitt, J. H. M. M.; Dreizler, S.; Lopez-Morales, M. et al. (1 de febrero de 2017). «Exoplanetary atmospheric sodium revealed by orbital motion». Astronomy & Astrophysics (en inglés) 598: A131. Bibcode:2017A&A...598A.131K. ISSN 0004-6361. arXiv:1610.01610. doi:10.1051/0004-6361/201629473.
- ↑ de Wit, Julien; Seager, S. (19 de diciembre de 2013). «Constraining Exoplanet Mass from Transmission Spectroscopy». Science 342 (6165): 1473-1477. Bibcode:2013Sci...342.1473D. PMID 24357312. arXiv:1401.6181. doi:10.1126/science.1245450.