Fulminato de plata

| Fulminato de plata | ||
|---|---|---|
 Estructura química | ||
 LAgujas de fulminato de plata (III) | ||
| General | ||
| Fórmula molecular | AgCNO | |
| Identificadores | ||
| Número CAS | 5610-59-3[1] | |
| Número RTECS | LS9340000 | |
| ChemSpider | 56347 | |
| PubChem | 62585 | |
| UNII | 5QNF7XT857 | |
| Propiedades físicas | ||
| Masa molar | 148,903 g/mol | |
El fulminato de plata (AgCNO) es una sal de plata derivada del ácido fulmínico que es explosiva.
El fulminato de plata es un explosivo primario, pero tiene un uso limitado como tal debido a su extrema sensibilidad al impacto, el calor, la presión y la electricidad. El compuesto se vuelve progresivamente sensible a medida que se agrega, incluso en pequeñas cantidades; el roce de una pluma al caer, el impacto de una sola gota de agua o una pequeña descarga estática son capaces de detonar explosivamente una pila no confinada de fulminato de plata no mayor que una moneda de diez centavos y no más pesada que unos pocos miligramos. Es imposible acumular cantidades mayores, debido a la tendencia del compuesto a autodetonarse por su propio peso.
El fulminato de plata fue preparado por primera vez en 1800 por Edward Charles Howard en su proyecto de investigación para preparar una gran variedad de fulminatos. Junto con el fulminato de mercurio, es el único fulminato lo suficientemente estable para su uso comercial. En 1885 se utilizaron detonadores de fulminato de plata para iniciar el ácido pícrico, pero desde entonces sólo han sido utilizados por la marina italiana.[2] El uso comercial actual ha sido la producción de ruidos no dañinos como juguetes para niños.
Estructura
[editar]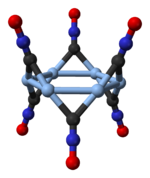
El fulminato de plata aparece en dos formas polimórficas, una en un sistema cristalino ortorrómbico, y otra en un sistema cristalino trigonal.[3] El trigonal polimórfico consta de hexámeros cíclicos, (AgCNO)6.[4]

Propiedades
[editar]Los fulminatos son muy tóxicos, casi tanto como los cianuros.[2] Cuando es puro, el fulminato de plata es químicamente muy estable y no se descompone tras años de almacenamiento. Como muchas sales de plata, se oscurece con la exposición a la luz. Sólo es ligeramente soluble en agua fría y puede recristalizarse con agua caliente.[2][5] También puede recristalizarse a partir de una solución al 20% de acetato de amonio.[2] No es higroscópico y puede explotar cuando está húmedo o bajo el agua; se iha documentado que seguía siendo explosivo después de 37 años bajo el agua.[2] Explota en contacto con ácido sulfúrico concentrado o cloro o bromo, pero no en contacto con yodo.[2] Es insoluble en ácido nítrico, pero se disuelve en amoníaco, cloruros alcalinos, cianuros alcalinos, anilina, piridina y yoduro de potasio formando complejos.[2] El ácido clorhídrico concentrado lo descompone de forma no explosiva con un sonido de silbido; el tiosulfato también lo descompone de forma no explosiva y puede utilizarse para su eliminación.[2]
Preparación
[editar]Este compuesto puede ser preparado al verter una solución de nitrato de plata en ácido nítrico sobre etanol, bajo control prudente de las condiciones de reacción, para evitar una explosión.[6] La reacción suele realizarse a 80-90 °C; a 30 °C, puede que no se forme el precipitado.[2] Sólo deben prepararse cantidades muy pequeñas de fulminato de plata de una vez, ya que incluso el peso de los cristales puede provocar su autodetonación. Otra forma de fabricar fulminato de plata consiste en hacer reaccionar carbonato de plata con amoníaco en disolución.
4 Ag2CO3 + 4 NH3 → 4 AgCNO + 6 H2O + 4 Ag + O2
El fulminato de plata también se forma cuándo se hace pasar el gas óxido de nitrógeno a través de una solución de nitrato de plata en etanol.[2]
El fulminato de plata puede ser preparado involuntariamente, cuando una solución ácida de nitrato de plata entra contacto con alcohol.[6] Esto supone un peligro en algunas fórmulas de plateado químico de espejos.
Explosivo para usos recreativos
[editar]El fulminato de plata, a menudo en combinación con el clorato de potasio se utiliza en los petardos. Los fabricantes hacen "galletas", "sorpresas", "bombitas", y otros fuegos artificiales. Contienen aproximadamente 200 miligramos de gravilla fina (los explosivos) recubierta de una cantidad ínfima (unos 80 microgramos) de fulminato de plata.[7] Cuando se arroja contra una superficie dura, el impacto es capaz de detonar la cantidad minúscula de explosivo, creando una pequeña explosión. Está diseñado para ser incapaz de producir daño (ni siquiera al detonar contra la piel) debido al efecto amortiguador que proporciona la masa mucho mayor del medio de grava. Es también un producto químico usado en Navidad.[8] El producto químico se pinta en una de las dos tiras estrechas de cartulina, con abrasivo en la segunda. Cuando se tira de la "galleta", el abrasivo detona el fulminato de plata.
Véase también
[editar]- Explosivo
- Justus von Liebig
- Friedrich Wöhler
- Isomería
- Fulminato
- Ácido fulmínico
- Fulminato de potasio
Referencias
[editar]- ↑ Número CAS
- ↑ a b c d e f g h i j Matyas, Robert; Pachman, Jiri (12 de marzo de 2013). Primary Explosives. Springer Science & Business Media, 338 pages.
- ↑ Britton, D.; Dunitz, J. D. (1965). «The Crystal Structure of Silver Fulminate». Acta Crystallographica 19 (4): 662-668. doi:10.1107/S0365110X6500405X.
- ↑ Britton, D. (1991). «A Redetermination of the Trigonal Silver Fulminate Structure». Acta Crystallographica C 47 (12): 2646-2647. doi:10.1107/S0108270191008855.
- ↑ 0.0075 gm at 13 °C, 0.018 gm at 30 °C, and 0.25 gm per 100 gm H2O at 100 °C
- ↑ a b Collins, P. H.; Holloway, K. J. (1978). «A Reappraisal of silver fulminate as a detonant». Propellants, Explosives and Pyrotechnics 3 (6): 159-162. doi:10.1002/prep.19780030603.
- ↑ package disclosure of Alexron Co. Ltd, Hong Kong, Phantom Brand Bang Snaps, (c)2013
- ↑ "Spectrum". «Comment #70». Old Firework Factory Locations. UK Pyrotechnics Society. Consultado el 20 de diciembre de 2011.
Otras lecturas
[editar]- Singh, K. (1959). «Crystal structure of silver fulminate». Acta Crystallographica 12 (12): 1053. doi:10.1107/S0365110X5900295X.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Silver fulminate» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.