Metilación del ADN

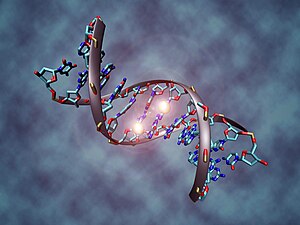
La metilación del ADN es un proceso por el cual se añaden grupos metilo al ADN. La metilación modifica la función del ADN cuando se encuentra en el gen promotor. La metilación del ADN generalmente actúa para reprimir la transcripción génica. La metilación del ADN es esencial para el desarrollo normal y se asocia con una serie de procesos clave, incluyendo la impronta genómica, la inactivación del cromosoma X, la represión de transposones, el envejecimiento y la carcinogénesis.
Dos de los cuatro nucleótidos de ADN, citosina y adenina, pueden ser metilados. La metilación de adenina se limita en procariontes. El rango de citosina en la metilación del ADN es notablemente diferente entre las especies: 14% de las citosinas están metiladas en Arabidopsis thaliana, 4% en Mus musculus, 2.3% en Escherichia coli,0.03% en Drosophila, y prácticamente ninguno (< 0.0002%) en especies de levadura.[1]
La metilación de la citosina para formar 5-metilcitosina ocurre en la quinta posición en el anillo de la pirimidina, misma posición en la que se encuentra el grupo metilo de la base de ADN timina; éste la distingue de la base análoga del ARN uracilo, que no tiene un grupo metilo. Una mutación común consiste en la desaminación espontánea de la 5-metilcitosina en timina, ya que esto genera un apareamiento incorrecto T:G. Al ser corregido por mecanismos de reparación, puede sustituirse la guanina por adenina y generarse un cambio del apareamiento origina C:G a un nuevo apareamiento T:A. La presencia casi obligatoria de timina en ADN y uracilo en ARN pudo haber evolucionado como un mecanismo de control de errores, para facilitar la eliminación de uracilos generados por la desaminación espontánea de la citosina.[2] Se cree que la metilación del ADN, así como muchos de sus ADN metiltransferasas contemporáneas, evolucionó a partir de la metilación de ARN en el mundo primitivo y está apoyada por varias líneas de evidencias.[3]
La metilación del ADN puede alterar de manera estable la expresión de genes en las células mientras las células se dividen y se diferencian de células madre embrionarias a tejidos específicos. El cambio resultante es normalmente permanente y unidireccional, previniendo que una célula vuelva a ser una célula madre o se convierta en un tipo de célula diferente. Sin embargo, la metilación del ADN se puede quitar de forma pasiva, por dilución mientras las células se dividen, o por un proceso activo más rápido. Este último proceso se produce a través de la hidroxilación de los grupos metilo que se van a eliminar, en lugar de la completa eliminación de grupos metilo.[4][5] La metilación del ADN se remueve típicamente durante la formación del cigoto y se re-establece a través de divisiones celulares sucesivas durante el desarrollo. Las modificaciones de la metilación que regulan la expresión de genes son generalmente heredadas a través de la división celular mitótica; ciertas metilaciones son heredadas a través de la división celular meiótica especializada que crea óvulos y espermatozoides, resultando en la impresión genómica. La metilación del ADN suprime la expresión de genes retrovirales endógenos y otros tramos nocivos de ADN que se han incorporado en el genoma del huésped con el tiempo. La metilación de ADN también forma la base de la estructura de la cromatina, lo que permite a una sola célula crecer en múltiples órganos o realizar múltiples funciones. De igual manera, la metilación del ADN desempeña un papel crucial en el desarrollo de casi todos los tipos de cáncer.[6]
La metilación del ADN en la posición 5 de la citosina tiene el efecto específico de reducir la expresión génica y se ha encontrado en todos los vertebrados examinados. En las células somáticas adultas (células en el cuerpo, no utilizadas para la reproducción), la metilación del ADN se produce normalmente en un contexto dinucleótido CpG (es decir, donde una citosina es seguida por una guanina); la metilación que no involucra los CpG es frecuente en las células madre embrionarias,[7][8][9] y también se ha encontrado en el desarrollo neural.[10] De igual manera, en la metilación que no involucra los CpG se ha observado en las células progenitoras hematopoyéticas, y es producida sobre todo en un contexto de secuencia CpApC.[11]
En mamíferos
[editar]- For significant overlapping coverage, see also Methylation.
Entre 60% y 90% de todas las CpG están metiladas en los mamíferos.[12][13] Los residuos metilados de C se desaminan espontáneamente para formar residuos T con el paso del tiempo; por lo tanto, los dinucleótidos CpG se desaminan de manera constante a dinucleótidos TpG, lo cual se evidencia por la falta de representación de los dinucleótidos CpG en el genoma humano (que ocurre en sólo el 21% de la frecuencia esperada).[14] (Por otra parte, la desaminación espontánea de los residuos de C no metilados da lugar a residuos U, un cambio que es rápidamente reconocido y reparado por la célula).
La metilación del ADN se ha observado para dirigirse a diferentes organismos en diferentes áreas, y tienen funciones diferentes. Por ejemplo, el patrón de metilación del ADN en los mamíferos generalmente se distribuye uniformemente a través de sitios CpG (con excepciones). Sin embargo, los invertebrados experimentan lo contrario: patrones de metilación CpG que se agrupan en racimos.[15]
Las CpG no metiladas a menudo se agrupan en grupos llamadas islas CpG, que están presentes en las regiones reguladoras 5' de muchos genes. En muchos procesos de enfermedad, como el cáncer, el promotor del gen de las islas CpG adquieren hipermetilación anormal, lo que resulta en el silenciamiento transcripcional que puede ser heredado por las células hijas tras la división celular. Las alteraciones de la metilación del ADN se han reconocido como un componente importante en el desarrollo del cáncer. La hipometilación, en general, se presenta más temprano y está vinculada a la inestabilidad cromosómica y la pérdida de impresión, mientras que la hipermetilación está asociada con los promotores y puede surgir secundaria al silenciamiento del gen (supresor de oncogenes), pero podría ser un objetivo para la terapia epigenética.[16]
La metilación del ADN puede afectar a la transcripción de genes de dos maneras. En primer lugar, la metilación de ADN en sí puede impedir físicamente la unión de proteínas transcripcionales con el gen,[17] y segundo, y probablemente más importante, el ADN metilado puede estar unido por proteínas conocidas como proteínas de dominio metil-CpG-unión (CMBD). Las proteínas MBD a continuación reclutan proteínas adicionales al locus, como las histonas deacetilasas y otras proteínas de remodelación de la cromatina que pueden modificar las histonas, formando de esta manera la cromatina compacta, inactiva, denominada heterocromatina. Este enlace entre la metilación del ADN y la estructura de la cromatina es muy importante. En particular, la pérdida de proteína metil-CpG vinculante 2 (MeCP2) ha sido implicada en el síndrome de Rett; y la proteína de dominio 2 (MBD2) metil-CpG vinculante media la silenciación transcripcional de los genes hipermetilados en el cáncer.
La investigación ha sugerido que el almacenamiento de la memoria a largo plazo en seres humanos puede ser regulada por la metilación del ADN.[18][19]
Los niveles de metilación de ADN se pueden utilizar para estimar la edad, formando un reloj biológico preciso en los seres humanos y los chimpancés.[20]
En cáncer
[editar]La metilación del ADN es un importante regulador de la transcripción de genes y un gran conjunto de pruebas ha demostrado que los genes con niveles elevados de 5-metilcitosina en su región promotora son transcripcionalmente silenciosos, y que la metilación del ADN se acumula gradualmente en el silenciamiento de genes a largo plazo. La metilación del ADN es esencial durante el desarrollo embrionario, y en las células somáticas, los patrones de metilación del ADN se transmiten generalmente a las células hijas con una alta fidelidad. Los patrones aberrantes de metilación de ADN-hipermetilación e hipometilación en comparación con el tejido normal-han sido asociados con un gran número de tumores malignos humanos. La hipermetilación se produce normalmente en las islas CpG en la región promotora y se asocia con la inactivación de genes. Un nivel más bajo de leucocitos de la metilación del ADN se asocia con muchos tipos de cáncer.[21] La hipometilación global también ha sido implicada en el desarrollo y progresión del cáncer a través de diferentes mecanismos.[22] Típicamente, hay hipermetilación de genes supresores de tumores y la hipometilación de oncogenes.[23]
Cáncer, tabaco y patrones de metilación
[editar]Hay estudios que han atribuido patrones de metilación diferenciales en personas fumadoras. Este proceso se llevó a cabo mediante arrays de metilación, que contienen 470.000 de los 28 millones de sitios CpG candidatos a la metilación en todo el genoma humano. Los niveles de metilación en las islas CpG no presentan claras diferencias entre fumadores y no fumadores, pero, en el análisis individual de cada uno de los tipos de cáncer asociados a tabaco se encontraron con que, en el caso del adenocarcinoma pulmonar sí que existían diferencias significativas en la metilación de islas CpG así como en otras regiones del genoma. Al analizar dichas regiones, se descubrió que estas regiones contenían clústeres de genes asociados a cáncer .[24]
En aterosclerosis
[editar]Las modificaciones epigenéticas como la metilación del ADN se han implicado en enfermedades cardiovasculares, incluyendo la aterosclerosis. En modelos animales de aterosclerosis, el tejido vascular, así como células de la sangre tales como células sanguíneas mononucleares exhiben hipometilación global con áreas de genes específicos de la hipermetilación. Polimorfismos de metilación del ADN se pueden usar como biomarcadores precoces de la aterosclerosis, ya que están presentes antes de que se observaron lesiones, que pueden proporcionar una herramienta para la detección temprana y prevención de riesgos.[25]
Dos de los tipos de células específicas para los polimorfismos de metilación del ADN son monocitos y linfocitos, que experimentan una hipometilación general. Un mecanismo propuesto detrás de esta hipometilación global es la homocisteína elevada, causando hiperhomocisteinemia, un factor de riesgo conocido para las enfermedades cardiovasculares. Los altos niveles plasmáticos de homocisteína inhiben a las metiltransferasas de ADN, lo que causa la hipometilación. La hipometilación de ADN afecta al gen que altera la proliferación de células del músculo liso, causa disfunción de la célula endotelial, y aumenta los mediadores inflamatorios, los cuales son críticos en la formación de lesiones ateroscleróticas.[26] Los altos niveles de homocisteína también dan lugar a la hipermetilación de las islas CpG en la región promotora del receptor de estrógenos alfa (ERα) de genes, provocando su baja regulación.[27] ERα rotege contra la aterosclerosis debido a su acción como un supresor de crecimiento, haciendo que las células del músculo liso permanezcan en un estado de reposo.[28] La hipermetilación del promotor de ERα permite que las células íntimas del músculo liso proliferen en exceso y contribuyan al desarrollo de la lesión aterosclerótica.[29]
Otro gen que experimenta un cambio en el estado de metilación en la aterosclerosis es el transportador monocarboxilato (MCT3), que produce una proteína responsable del transporte de los cuerpos de lactato y otra cetona de muchos tipos de células, incluyendo las células del músculo liso vascular. En pacientes con aterosclerosis, hay un aumento en la metilación de las islas CpG en el exón 2, lo que disminuye la expresión de proteínas MCT3. La baja regulación de MCT3 perjudica el transporte de lactato, y aumenta significativamente la proliferación de células de músculo liso, lo que contribuye aún más a la lesión aterosclerótica. Un experimento ex vivo usando el agente de desmetilación decitabina (5-aza-2 -deoxycytidina) fue mostrado para inducir la expresión MCT3 de una manera dependiente de la dosis, ya que todos los sitios hipermetilados en el exón 2 de la isla CpG se desmetilaron después del tratamiento. Esto puede servir como un agente terapéutico para el tratamiento de la aterosclerosis, aunque no se han realizado estudios en humanos hasta ahora.[30]
En el envejecimiento
[editar]Un estudio longitudinal de niños gemelos mostró que, entre las edades de 5 y 10, hubo divergencia de los patrones de metilación debido al medio ambiente en lugar de las influencias genéticas.[31] Existe una pérdida global de la metilación del ADN durante el envejecimiento.[23]
En un estudio en el que se analizaron los metilomas de ADN de las células T CD4+ en un recién nacido, un individuo de 26 años de edad y uno de 103 años de edad se observó que la pérdida de metilación es proporcional a la edad. Las CpG hipometiladas observadas en los ADN centenarios en comparación con los recién nacidos cubrieron todos los compartimentos genómicos (promotores, intergénicos, regiones intrónicas y exónicas).[32]
Sin embargo, algunos genes se convierten en hipermetilados con la edad, incluyendo genes para el receptor de estrógenos, p16, y la insulina factor de 2 de crecimiento.[23] El reloj epigenético es un biomarcador prometedor de envejecimiento.[33][34]
En el ejercicio
[editar]El ejercicio de alta intensidad se ha demostrado que resulta en la reducción de la metilación del ADN en el músculo esquelético.[35] La metilación del promotor de PGC-1α y PDK4 se redujo inmediatamente después del ejercicio de alta intensidad, mientras que la metilación PPAR-γ no se redujo hasta tres horas después del ejercicio.[35] Por el contrario, seis meses de ejercicio en hombres sedentarios de mediana edad produjo un aumento de la metilación en el tejido adiposo.[36] Un estudio mostró un posible aumento de la metilación del ADN genómico global de las células blancas de la sangre con más actividad física en los no hispanos.[21]
En la diferenciación de células B
[editar]Un estudio que investigó el metiloma de las células B a lo largo de su ciclo de diferenciación, mediante la secuenciación de bisulfito de todo el genoma (WGBS), mostró que hay una hipometilación desde las primeras etapas de las etapas más diferenciadas. La mayor diferencia es la metilación entre las etapas centrales germinales de células B y las células B de memoria. Por otra parte, este estudio demostró que existe una similitud entre los tumores de células B y células B de larga vida en sus firmas de la metilación del ADN.[11]
Expresión genética
[editar]La metilación del ADN posee un rol muy importante en la expresión genética en niveles de iniciación de transcripción y elongación. Este proceso es capaz de funcionar como elementos reguladores tales como promotores, potenciadores e insoladores. Muchos de estos roles de la metilación del ADN relacionados con la expresión genética están muy bien analizados, pero se cree que otro proceso importante tal como el numero de elementos transponibles son la causa primordial por la cual el tamaño del genoma en los organismos eucariotas es considerablemente más grande, por lo consecuente, esto afecto la expresión genética.[37]
Metiltransferasas del ADN (en mamíferos)
[editar]En células de mamíferos, la metilación del ADN se produce principalmente en la posición C5 de dinucleótidos CpG y se lleva a cabo por dos clases generales de actividades enzimáticas - metilación de mantenimiento y la metilación de novo.[38]
La actividad de la metilación de mantenimiento es necesaria para preservar la metilación del ADN después de cada ciclo de replicación del ADN celular. Sin la ADN metiltransferasa (DNMT), la maquinaria de replicación en sí produciría cadenas hijas no metiladas y, con el tiempo, daría lugar a la desmetilación pasiva. DNMT1 es la metiltransferasa de mantenimiento propuesta que es responsable de la copia de los patrones de metilación del ADN a las hebras hijas durante la replicación del ADN. Los modelos de ratones con dos copias del DNMT1 borrado, son embrionariamente letales en el día 9 aproximadamente, debido a la exigencia de la actividad DNMT1 para el desarrollo en células de mamíferos.
Se cree que la DNMT3a y la DNMT3b son las metiltransferasas de novo que establecen los patrones de metilación de ADN en el desarrollo temprano. DNMT3L es una proteína que es homóloga a los demás DNMT3s pero no tiene ninguna actividad catalítica. En su lugar, DNMT3L ayuda a las metiltransferasas de novo mediante el aumento de su capacidad de unirse al ADN y estimular su actividad. Finalmente, DNMT2 (TRDMT1) se ha identificado como un homólogo de la ADN metiltransferasa, que contiene los 10 motivos de secuencia comunes a todas las metiltransferasas de ADN; Sin embargo, la DNMT2 (TRDMT1) no metila el ADN sino metila la citosina-38 en el bucle anticodón del ARN de transferencia del ácido aspártico.[39]
Dado que muchos genes supresores de tumores son silenciados por la metilación del ADN durante la carcinogénesis, se han hecho intentos para volver a expresar estos genes mediante la inhibición de las DNMTs. La 5-Aza-2 'desoxicitidina (decitabina) es un análogo del nucleósido que inhibe DNMTs atrapándolos en un complejo covalente en el ADN mediante la prevención de la etapa de β-eliminación de la catálisis, lo que resulta en la degradación de las enzimas. Sin embargo, para que la decitabina esté activa, debe ser incorporada en el genoma de la célula, que puede causar mutaciones en las células hijas si la célula no muere. Además, la decitabina es tóxica para la médula ósea, lo que limita el tamaño de su ventana terapéutica. Estas trampas han conducido al desarrollo de terapias de ARN antisentido que se dirigen a los DNMTs degradando sus ARNm y previenen su traducción. Sin embargo, todavía no está claro si la orientación DNMT1 en sí sola es suficiente para reactivar los genes supresores de tumores silenciados por la metilación del ADN.
En plantas
[editar]Se ha hecho un progreso significativo en la comprensión de la metilación del ADN en la planta modelo Arabidopsis thaliana. La metilación del ADN en plantas es diferente a la de los mamíferos: mientras que la metilación del ADN en los mamíferos se produce principalmente en el nucleótido citosina en un sitio CpG, en las plantas, la citosina puede ser metilada en CpG, CpHpG, y los sitios CpHpH, donde H representa cualquier nucleótido excepto la guanina. En general, el ADN de Arabidopsis es altamente metilado, el análisis de espectrometría de masas estimó el 14% de las citosinas para ser modificadas.[1]
Las principales enzimas metiltransferasas de ADN de Arabidopsis que se transfieren y unen covalentemente grupos metilo en el ADN, son DRM2, MET1 y CMT3. Tanto las proteínas DRM2 y MET1 comparten una homología significativa con las metiltransferasas de mamíferos DNMT3 y DNMT1, respectivamente, mientras que la proteína CMT3 es única en el reino vegetal. Actualmente hay dos clases de ADN metiltransferasas: 1) la clase de novo, o enzimas que crean nuevas marcas de metilación en el ADN; y 2) una clase de mantenimiento que reconoce las marcas de metilación en la hebra parental del ADN y las transferencias de la nueva metilación de las hijas hebras después de la replicación del ADN. La DRM2 es la única enzima que se ha implicado como un de novo de ADN metiltransferasa. La DRM2 también se ha demostrado, junto con MET1 y CMT3 a estar implicadas en el mantenimiento de marcas de metilación a través de la replicación del ADN.[40] Otras metiltransferasas de ADN se expresan en plantas, pero no tienen función conocida.
No está claro cómo la célula determina la ubicación de la metilación de novo de ADN, pero la evidencia sugiere que, para muchos (aunque no todos) los lugares, la metilación del ADN dirigida por ARN (RdDM) está involucrado. En RdDM, las transcripciones de ARN específicas se producen a partir de un molde de ADN genómico, y este ARN forma estructuras secundarias llamadas moléculas de doble cadena de ARN.[41] Los ARN de doble cadena, ya sea a través del pequeño ARN de interferencia (ARNi) o microARN (ARNmi) o las vías directo de novo de la metilación del ADN de la localización genómica original que produce el ARN.[41] Este tipo de mecanismo se piensa que es importante en la defensa celular contra el virus de ARN y/o los transposones, los cuales a menudo forman un ARN de doble hebra que puede ser mutagénico para el genoma del huésped. Al metilar sus lugares genómicos, a través de un mecanismo no muy bien conocido, se cierran y ya no están activos en la célula, protegiendo el genoma de su efecto mutagénico.
En hongos
[editar]Muchos hongos tienen niveles bajos (0.1 a 0.5%) de la metilación de citosina, mientras que otros hongos tienen tanto como el 5% del genoma metilado.[42] Este valor parece variar tanto entre especies y entre los aislados de la misma especie.[43] También hay pruebas de que la metilación del ADN puede estar implicado en el control del estado específico de la expresión génica en los hongos.[cita requerida] Sin embargo, a un límite de detección de 250 moles-átomos mediante el uso de ultra-alta espectrometría de masas sensible, la metilación del ADN no se confirmó en una sola especie de levadura celular, tal como Saccharomyces cerevisiae o Schizosaccharomyces pombe, lo que indica que las levaduras no poseen esta modificación del ADN.[1]
A pesar de que la levadura de cerveza (Saccharomyces), levadura de fisión (Schizosaccharomyces), y Aspergillus flavus[44] no tienen metilación del ADN detectable, el modelo hongo filamentoso Neurospora crassa tiene un sistema de metilación bien caracterizado.[45] Varios genes controlan la metilación en Neurospora y mutación del ADN metil transferasa, dim-2, elimina toda la metilación del ADN, pero no afecta el crecimiento o la reproducción sexual.
Mientras que el genoma de Neurospora tiene muy poco ADN repetido, la mitad de la metilación se produce en el ADN repetido incluyendo reliquias de transposones y ADN centromérico. La capacidad de evaluar otros fenómenos importantes en un fondo genético deficiente de metilasa de ADN hace a la Neurospora un sistema importante en el cual estudiar la metilación del ADN.
En insectos
[editar]La metilación del ADN funcional ha sido descubierta en las abejas melíferas.[46][47] Las marcas de metilación del ADN están principalmente en el cuerpo de los genes, y las opiniones actuales sobre la función de la metilación del ADN es la regulación de genes a través del "splicing" alternativo.[48]
Drosophila melanogaster posee un nivel muy bajo de la metilación del ADN[1] que es sin embargo demasiado bajo para ser estudiado por métodos tales como la secuenciación de bisulfito.[49] El desarrollo de un método sensible que permitió encontrar que los patrones de secuenciación del genoma de la mosca que se asocian con la metilación son muy diferentes de los patrones observados en los seres humanos, o en otras especies animales o vegetales hasta la fecha. La metilación del genoma en D. melanogaster fue encontrada en motivos cortos específicos (concentrados en específicamente motivos de base de secuencia 5 que son ricos en CA y CT pero empobrecidos en guanina) y es independiente de la actividad de DNMT2. Mediante el uso de enfoques de espectrometría de masas de alta sensibilidad,[50] se ha demostrado ahora la presencia de bajos (0.07%), pero significativos niveles de metilación de adenina durante las primeras etapas de la embriogénesis de Drosophila.
En bacterias
[editar]La metilación de adenina o citosina es parte del sistema de modificación de restricción de muchas bacterias, en el que las secuencias de ADN específicas están metiladas periódicamente durante todo el genoma. Una metilasa es la enzima que reconoce una secuencia específica y metila una de las bases en o cerca de esa secuencia. ADNs exteriores (que no están metilados de esta manera) que se introducen en la célula son degradados por enzimas de restricción específicas de secuencia y se escinden. El ADN genómico bacteriano no es reconocido por estas enzimas de restricción. La metilación del ADN nativo actúa como una especie de sistema inmunológico primitivo, lo que permite a las bacterias protegerse de infecciones por bacteriófagos.
La metiltransferasa de ADN adenina de la E. coli (Dam) es una enzima de ~ 32 kDa que no pertenece a un sistema de restricción/modificación. La secuencia de reconocimiento objetivo para E. coli Dam es GATC, ya que la metilación se produce en la posición N6 de la adenina en esta secuencia (G meATC). Los tres pares de bases que flanquean cada lado de este sitio también influyen la unión a ADN-Dam. Dam desempeña varios papeles clave en los procesos bacterianos, incluyendo reparación de genes, el momento de la replicación del ADN, y la expresión génica. Como resultado de la replicación del ADN, el estado de los sitios GATC en el genoma de E. coli cambian de completamente metilados a hemimetilados. Esto se debe a que la adenina introducida en la nueva cadena de ADN está metilada. La re-metilación se produce dentro de dos a cuatro segundos, durante los cuales se reparan los errores de replicación de tiempo en la nueva cadena. La metilación, o su ausencia, es el marcador que permite que el aparato de reparación de la célula se diferencie entre el molde y las hebras nacientes. Se ha demostrado que la alteración de la actividad de Dam en bacterias resulta en una mayor tasa de mutación espontánea. La viabilidad bacteriana se ve comprometida en los mutantes de dam, que también carecen de ciertas otras enzimas de reparación del ADN, proporcionando una prueba para el papel de la Dam en la reparación del ADN.
Una región del ADN que mantiene su estado hemimetilado por más tiempo es el origen de replicación, que tiene una abundancia de sitios GATC. Esto es fundamental para el mecanismo bacteriano para temporizar la replicación del ADN. SecA se une al origen de replicación, secuestrándolo y evitando así la metilación. Debido a que los orígenes de hemimetilados de replicación son inactivos, este mecanismo limita la replicación del ADN a una vez por ciclo celular.
La expresión de ciertos genes, por ejemplo los que codifican para la expresión de pilus en E. coli, está regulada por la metilación de sitios GATC en la región promotora del operón de genes. Las condiciones ambientales de las células justo después de la replicación del ADN determinan si Dam está bloqueado de la metilación de una región proximal a distal de la región promotora. Una vez que se creó el patrón de metilación, la transcripción de genes pilus está bloqueada en la posición de encendido o apagado hasta que el ADN se replica de nuevo. En E. coli, estos operones de pilus tienen un papel importante en la virulencia de las infecciones del tracto urinario. Ha sido propuesto que los inhibidores de la Dam pueden funcionar como antibióticos.
Por otra parte, los objetivos de la metilasa de ADN citosina CCAGG y los sitios CCTGG para metilar la citosina en la posición C5 (C meC(A/T) GG). La otra enzima metilasa, EcoKI, causa la metilación de adeninas en las secuencias AAC(N6)GTGC y GCAC(N6)GTT.
Clonación molecular
[editar]La mayoría de las cepas utilizadas por los biólogos moleculares son derivados de E. coli K-12, y poseen tanto Dam y DCM, pero hay cepas comerciales disponibles que son dam-/dcm- (falta de actividad de cualquier metilasa). De hecho, es posible desmetilar el ADN extraído de cepas dam+/dcm+ mediante su transformación en cepas dam-/dcm. Esto ayudaría a digerir las secuencias que no están siendo reconocidas por las enzimas de restricción sensibles a la metilación.[51][52]
La enzima de restricción DpnI puede reconocer los sitios 5'-GmeATC-3' y digiere el ADN metilado. Al ser un motivo muy corto, se produce con frecuencia en las secuencias por casualidad, y como tal, su uso principal para los investigadores es degradar ADN molde siguiendo la plantilla de PCRs (productos de PCR carecen de metilación, como no hay metilasas presentes en la reacción). Del mismo modo, algunas enzimas de restricción disponibles comercialmente son sensibles a la metilación en sus sitios de restricción afines, y deben como se mencionó anteriormente ser utilizadas en ADN que pasa a través de una cepa dam-/dcm- para permitir el corte.
Detección
[editar]La metilación del ADN puede ser detectada por los siguientes ensayos actualmente utilizados en la investigación científica:
- La espectrometría de masas es un método analítico muy sensible y fiable para detectar la metilación del ADN. MS, en general, no es informativo acerca de la secuencia de contexto de la metilación, por lo tanto es limitado en el estudio de la función de esta modificación del ADN.
- La metilación específica de PCR (MSP), que se basa en una reacción química de bisulfito de sodio con el ADN que convierte las citosinas no metiladas de los dinucleótidos CpG en uracilo o UpG, seguido de PCR tradicional.[53] Sin embargo, las citosinas metiladas no serán convertidas en este proceso, y se diseñan cebadores para solapar el sitio CpG de interés, lo que permite determinar el estado de metilación como metilado o no metilado.
- Secuenciación de todo el genoma con bisulfito, también conocido como BS-Sec, que es un análisis de todo el genoma de alto rendimiento de la metilación del ADN. Se basa en la citada conversión de bisulfito de sodio de ADN genómico, que se secuenció a continuación, en una plataforma de secuenciación de la próxima generación. Las secuencias obtenidas son luego re-alineadas con el genoma de referencia para determinar los estados de metilación de los dinucleótidos CpG sobre la base de los desajustes resultantes de la conversión de las citosinas no metiladas en uracilos.
- El ensayo HELP, que se basa en la capacidad diferencial de las enzimas de restricción para reconocer y escindir sitios CpG de ADN metilados y no metilados
- Ensayos de ChIP-en-chip, que se basa en la capacidad de los anticuerpos preparados comercialmente que se unen a proteínas asociadas de ADN de metilación como MeCP2.
- La restricción histórica de escaneo genómico, una complicada y ahora rara vez utilizada técnica basada en el reconocimiento diferencial de las enzimas de restricción de los sitios CpG metilados y no metilados; el ensayo es similar en concepto al ensayo HELP.
- Inmunoprecipitación metilada de ADN (MeDIP), análoga a la inmunoprecipitación de la cromatina, la inmunoprecipitación se utiliza para aislar fragmentos de ADN metilado para la entrada en los métodos de detección de ADN, tales como microarreglos de ADN (MeDIP-chip) o la secuenciación del ADN (MeDIP-sec).
- Pirosecuenciación de bisulfito del ADN tratado. Esta es la secuencia de un amplicón hecha por un cebador de avance normal, pero un cebador inverso biotinilado a PCR el gen de elección. El pirosecuenciador entonces analiza la muestra por la desnaturalización del ADN y la adición de un nucleótido a la vez a la mezcla de acuerdo con una secuencia determinada por el usuario. Si hay una falta de coincidencia, se registra y el porcentaje de ADN por el que el desajuste está presente se observa. Esto da al usuario un porcentaje de metilación por cada isla CpG.
- El ensayo molecular luz de freno para la actividad de la ADN metiltransferasa de adenina- un ensayo que se basa en la especificidad de la enzima de restricción DpnI para los sitios completamente metilados (metilación de adenina) GATC en un oligonucleótido marcado con un fluoróforo y extintor. La adenina metiltransferasa metila el oligonucleótido por lo que es un sustrato para DpnI. El corte del oligonucleótido por DpnI da lugar a un aumento de fluorescencia.[54][55]
- "Southern Blotting" Sensible Metilado es similar al ensayo de HELP, aunque utiliza técnicas de Southern blot para investigar las diferencias de genes específicos en la metilación mediante la digestión de restricción. Esta técnica se utiliza para evaluar la metilación local cerca del sitio de unión para la sonda.
- Las proteínas de unión MetilCpG (Mbps) y las proteínas de fusión que contienen sólo el dominio de unión de metilo (MBD) se utilizan para separar el ADN nativo en fracciones metiladas y no metiladas. El porcentaje de metilación de islas CpG individuales se puede determinar mediante la cuantificación de la cantidad del objetivo en cada fracción.[56] La detección extremadamente sensible se puede lograr en los tejidos FFPE con la detección basada en abscripción.
- Análisis de alta resolución de fusión (GRH o HRMA), es una técnica de análisis post-PCR. El ADN objetivo se trata con bisulfito de sodio, que convierte químicamente citosinas no metiladas en uracilos, mientras que las citosinas metiladas se conservan. La amplificación por PCR se lleva a cabo a continuación, con cebadores diseñados para amplificar las plantillas tanto metiladas y no metiladas. Después de esta amplificación, las secuencias de ADN altamente metiladas contienen un mayor número de sitios CpG no metilados en comparación con plantillas, lo que resulta en una temperatura de fusión diferente que se puede utilizar en la detección de la metilación cuantitativa.[57][58]
- Reconstrucción antigua de la metilación del ADN, un método para reconstruir la metilación del ADN de alta resolución a partir de muestras de ADN antiguo. El método se basa en los procesos de degradación naturales que se producen en el ADN antiguo: con el tiempo, las citosinas metiladas son degradadas en timinas, mientras que las citosinas no metiladas en uracilos se degradan. Esta asimetría en las señales de degradación se utilizó para reconstruir los mapas de metilación del Neandertal y el Denisovan.[59]
Regiones diferencialmente metiladas (DMRs)
[editar]Las regiones diferencialmente metiladas, son regiones genómicas con diferentes estados de metilación entre múltiples muestras (tejidos, células, individuos u otros), son consideradas como posibles regiones funcionales que intervienen en la regulación transcripcional de genes. La identificación de los DMR entre múltiples tejidos (DMR-T) ofrece un estudio exhaustivo de las diferencias epigenéticas entre los tejidos humanos.[60] Por ejemplo, estas regiones metiladas que son únicas para un tejido en particular permiten a los individuos para diferenciar entre el tipo de tejido, como el semen y el fluido vaginal. La investigación actual realizada por Lee et al., mostró que DACT1 y USP49 identificaron positivamente semen mediante el examen de T-DMR.[61] Las DMR entre las muestras de cáncer y normales (DMR-C) demuestran la metilación aberrante en los cánceres.[62] Es bien sabido que la metilación del ADN está asociada con la diferenciación y la proliferación celular.[63] Muchas DMR se han encontrado en las etapas de desarrollo (DMR-D)[64] y en el progreso reprogramado (DMR-R).[65] Además, hay DMR intraindividuales (DMR-intra) con los cambios longitudinales en la metilación del ADN a nivel mundial, junto con el aumento de la edad de un individuo dado.[66] También hay DMR interindividuales (DMR-inter) con diferentes patrones de metilación entre varios individuos.[67]
QDMR (Regiones cuantitativas diferencialmente metiladas) es un enfoque cuantitativo para cuantificar diferencias de la metilación e identificar DMRs de perfiles de metilación de todo el genoma mediante la adaptación de la entropía de Shannon (https://web.archive.org/web/20151023040525/http://bioinfo.hrbmu.edu.cn/qdmr/). La naturaleza libre de la plataforma y libre de especies de QDMR hace que sea potencialmente aplicable a diversos datos de metilación. Este enfoque proporciona una herramienta eficaz para la identificación de alto rendimiento de las regiones funcionales que intervienen en la regulación epigenética. Las QDMR se pueden utilizar como una herramienta eficaz para la cuantificación de la diferencia de metilación y la identificación de DMRs a través de múltiples muestras.[68]
El análisis Gene-set (también conocido como análisis de la vía; herramientas que generalmente se realizan como DAVID, GoSec o GSEA) ha demostrado ser gravemente sesgada cuando se aplica a los datos de metilación de alto rendimiento (por ejemplo MeDIP-sec, MeDIP-ChIP, HELP-sec etc. ), y una amplia gama de estudios han informado por error hipermetilación de genes relacionados con el desarrollo y la diferenciación; se ha sugerido que esto se puede corregir utilizando permutaciones etiquetadas de la muestra o el uso de un modelo estadístico para controlar las diferencias en el número de sondas CpG / sitios de CpG que se dirigen a cada gen.[69]
Marcas de la metilación del ADN
[editar]Las marcas de metilación de ADN, son las regiones genómicas con el patrón de metilación específica de una situación biológica específica tal como un tejido, tipo de célula, individuo, son consideradas como posibles regiones funcionales que intervienen en la regulación transcripcional de genes. Aunque varios tipos de células humanas pueden tener el mismo genoma, estas células tienen diferentes metilomas. La identificación sistemática y caracterización de marcas de metilación a través de tipos de células son cruciales para entender la red de regulación compleja para la determinación del destino celular. Hongbo Liu et al. propuso un marco basado en la entropía denominada SMART para integrar todos los metilomas del genoma de secuenciación de bisulfito en 42 tejidos/células humanas y se identificaron 757,887 segmentos del genoma.[70] Casi el 75% de los segmentos mostraron metilación uniforme en todos los tipos de células. Del 25% restante de los segmentos, identificaron marcas de hipo/hipermetilación de un tipo de células específicas que estaban específicamente hipo/hípermetiladas en una minoría de los tipos de células utilizando un enfoque estadístico y presentaron un atlas de las marcas de metilación humanas. Un análisis más detallado reveló que las marcas específicas del tipo hipometiladores celulares se enriquecieron a través H3K27ac y el factor de transcripción de sitios de manera específica del tipo celular vinculante. En particular, se observó que los tipos de células específicas hipometiladores están asociadas con las células específicas del tipo super-potenciadores que dirigen la expresión de los genes de identidad celular. Este marco proporciona una anotación complementaria, funcional del genoma humano y ayuda a aclarar las características críticas y las funciones de las células hipometiladoras específicas.
La entropía específica basada en el Análisis de Metilación y el "Report Tool", denominada "inteligente", que se centran en la integración de un gran número de metilomas de ADN para la identificación de novo de "MethyMarks" tipo de células específicas, está disponible en http://fame.edbc.org/smart/.[71] SMART ha sido publicado en un paquete de Python llamado “SMART-BS-Seq” y está gratuitamente disponible en el Índice de Paquetes de Python(https://web.archive.org/web/20160815211617/https://pypi.python.org/pypi/SMART-BS-Seq). Todos los recursos producidos en este estudio están públicamente disponibles a través del Atlas de la Metilación Humana (https://web.archive.org/web/20170108072914/http://fame.edbc.org/methymark/[72]).
Predicción computacional
[editar]La metilación de ADN también se puede detectar mediante modelos computacionales a través de algoritmos y métodos sofisticados. Los modelos computacionales pueden facilitar los perfiles mundiales de metilación del ADN a través de los cromosomas, y con frecuencia este tipo de modelos son más rápidos y más baratos que los ensayos biológicos. Tales modelos computacionales actualizados incluyen Bhasin, et al., Bhasin, et al.,[73] Bock, et al.,[74] y Zheng, et al.[75][76] Junto con el ensayo biológico, estos métodos facilitan en gran medida el análisis de metilación del ADN.
Véase también
[editar]- Regiones diferencialmente metiladas
- Epigenética, del cual la metilación del ADN es un contribuyente significativo
- Epigenoma
- Genoma
- Impronta genómica, una represión hereditaria de un alelo, basándose en la metilación del ADN
Referencias
[editar]- ↑ a b c d Capuano, F.; Mülleder, M.; Kok, R. M.; Blom, H. J.; Ralser, M. (2014). «Cytosine DNA methylation is found in Drosophila melanogaster but absent in Saccharomyces cerevisiae, Schizosaccharomyces pombe and other yeast species». Analytical Chemistry 86 (8): 3697-702. PMC 4006885. PMID 24640988. doi:10.1021/ac500447w.
- ↑ Angéla Békési and Beáta G Vértessy "Uracil in DNA: error or signal?"
- ↑ Rana, Ajay K.; Ankri, Serge (1 de enero de 2016). «Reviving the RNA World: An Insight into the Appearance of RNA Methyltransferases». RNA: 99. doi:10.3389/fgene.2016.00099. Archivado desde el original el 7 de agosto de 2016. Consultado el 12 de julio de 2016.
- ↑ Iqbal, K.; Jin, S. -G.; Pfeifer, G. P.; Szabo, P. E. (2011). «Reprogramming of the paternal genome upon fertilization involves genome-wide oxidation of 5-methylcytosine». Proceedings of the National Academy of Sciences 108 (9): 3642-3647. PMC 3048122. PMID 21321204. doi:10.1073/pnas.1014033108.
- ↑ Wossidlo, M.; Nakamura, T.; Lepikhov, K.; Marques, C. J.; Zakhartchenko, V.; Boiani, M.; Arand, J.; Nakano, T.; Reik, W.; Walter, J. R. (2011). «5-Hydroxymethylcytosine in the mammalian zygote is linked with epigenetic reprogramming». Nature Communications 2: 241. PMID 21407207. doi:10.1038/ncomms1240.
- ↑ Jaenisch, R.; Bird, A. (2003). «Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals». Nature Genetics. 33 Suppl (3s): 245-254. PMID 12610534. doi:10.1038/ng1089.
- ↑ Dodge JE, Ramsahoye BH, Wo ZG, Okano M, Li E (2002). «De novo methylation of MMLV provirus in embryonic stem cells: CpG versus non-CpG methylation». Gene 289 (1–2): 41-48. doi:10.1016/S0378-1119(02)00469-9.
- ↑ Haines TR, Rodenhiser DI, Ainsworth PJ (2001). «Allele-Specific Non-CpG Methylation of the Nf1 Gene during Early Mouse Development». Developmental Biology 240 (2): 585-598. PMID 11784085. doi:10.1006/dbio.2001.0504.
- ↑ Lister R, Pelizzola M, Dowen RH (October 2009). «Human DNA methylomes at base resolution show widespread epigenomic differences». Nature 462 (7271): 315-22. PMC 2857523. PMID 19829295. doi:10.1038/nature08514.
- ↑ Lister, R.; Mukamel, E. A.; Nery, J. R.; Urich, M.; Puddifoot, C. A.; Johnson, N. D.; Lucero, J.; Huang, Y.; Dwork, A. J.; Schultz, M. D.; Yu, M.; Tonti-Filippini, J.; Heyn, H.; Hu, S.; Wu, J. C.; Rao, A.; Esteller, M.; He, C.; Haghighi, F. G.; Sejnowski, T. J.; Behrens, M. M.; Ecker, J. R. (4 de julio de 2013). «Global Epigenomic Reconfiguration During Mammalian Brain Development». Science 341 (6146): 1237905. doi:10.1126/science.1237905.
- ↑ a b Kulis, Marta; Merkel, Angelika; Heath, Simon; Queirós, Ana C.; Schuyler, Ronald P.; Castellano, Giancarlo; Beekman, Renée; Raineri, Emanuele et al. (1 de julio de 2015). «Whole-genome fingerprint of the DNA methylome during human B cell differentiation». Nature Genetics (en inglés) 47 (7): 746-756. ISSN 1061-4036. doi:10.1038/ng.3291.
- ↑ Ehrlich M; Gama Sosa MA; Huang L-H.; Midgett RM; Kuo KC; McCune RA; Gehrke C (April 1982). «Amount and distribution of 5-methylcytosine in human DNA from different types of tissues or cells». Nucleic Acids Research 10 (8): 2709-2721. PMC 320645. PMID 7079182. doi:10.1093/nar/10.8.2709.
- ↑ Tucker KL (June 2001). «Methylated cytosine and the brain: a new base for neuroscience». Neuron 30 (3): 649-652. PMID 11430798. doi:10.1016/S0896-6273(01)00325-7.
- ↑ International Human Genome Sequencing Consortium (February 2001). «Initial sequencing and analysis of the human genome». Nature 409 (6822): 860-921. PMID 11237011. doi:10.1038/35057062.
- ↑ «The Role of Methylation in Gene Expression | Learn Science at Scitable». www.nature.com. Consultado el 27 de septiembre de 2015.
- ↑ Daura-Oller E, Cabre M, Montero MA, Paternain JL, Romeu A (2009). «Specific gene hypomethylation and cancer: New insights into coding region feature trends». Bioinformation 3 (8): 340-343. PMC 2720671. PMID 19707296. doi:10.6026/97320630003340.
- ↑ Choy MK, Movassagh M, Goh HG, Bennett M, Down T, Foo R (2010). «Genome-wide conserved consensus transcription factor binding motifs are hyper-methylated». BMC Genomics 11 (1): 519. PMC 2997012. PMID 20875111. doi:10.1186/1471-2164-11-519.
- ↑ Miller C, Sweatt J (15 de marzo de 2007). «Covalent modification of DNA regulates memory formation». Neuron 53 (6): 857-869. PMID 17359920. doi:10.1016/j.neuron.2007.02.022.
- ↑ Powell, Devin (2 de diciembre de 2008). «Memories may be stored on your DNA». New Scientist. Consultado el 2 de diciembre de 2008.
- ↑ Horvath S (2013). «DNA methylation age of human tissues and cell types». Genome Biology 14 (R115): R115. PMC 4015143. PMID 24138928. doi:10.1186/gb-2013-14-10-r115. Archivado desde el original el 20 de enero de 2018. Consultado el 12 de julio de 2016.
- ↑ a b Zhang FF1, Cardarelli R, Carroll J, Zhang S, Fulda KG, Gonzalez K, Vishwanatha JK, Morabia A, Santella RM (2011). «Physical activity and global genomic DNA methylation in a cancer-free population». Epigenetics 6 (3): 293-299. PMC 3092677. PMID 21178401. doi:10.4161/epi.6.3.14378. Archivado desde el original el 17 de diciembre de 2013. Consultado el 12 de julio de 2016.
- ↑ Craig, JM; Wong, NC (editor) (2011). Epigenetics: A Reference Manual. Caister Academic Press. ISBN 978-1-904455-88-2.
- ↑ a b c Gonzalo S (2010). «Epigenetic alterations in aging». Journal of Applied Physiology 109 (2): 586-597. PMC 2928596. PMID 20448029. doi:10.1152/japplphysiol.00238.2010. Archivado desde el original el 13 de agosto de 2014. Consultado el 12 de julio de 2016.
- ↑ Alexandrov, Ludmil B.; Ju, Young Seok; Haase, Kerstin; Loo, Peter Van; Martincorena, Iñigo; Nik-Zainal, Serena; Totoki, Yasushi; Fujimoto, Akihiro et al. (4 de noviembre de 2016). «Mutational signatures associated with tobacco smoking in human cancer». Science (en inglés) 354 (6312): 618-622. ISSN 0036-8075. PMID 27811275. doi:10.1126/science.aag0299. Consultado el 21 de febrero de 2017.
- ↑ Lund, G.L.; Andersson, L.; Lauria, M.; Lindholm, M.; Fraga, M.F.; Villar-Garea, A.; Ballestar, E.; Esteller, M. et al. (2004). «DNA methylation polymorphisms precede any histological sign of atherosclerosis in mice lacking Apolipoprotein E.». J Biol Chem 279 (28): 29147-29154. doi:10.1074/jbc.m403618200.
- ↑ Castro, R.; Rivera, I.; Struys, E.A.; Jansen, E.E.; Ravasco, P.; Camilo, M.E.; Blom, H.J.; Jakobs, C.; Tavares; de Almeida, T. (2003). «Increased homocysteine concentrations and S-adenosylhomocysteine concentrations and DNA hypomethylation in vascular disease». Clin Chem 49 (8): 1292-1296. doi:10.1373/49.8.1292.
- ↑ Huang, Y.S.; Zhi, Y.F.; Wang, S.R. (2009). «Hypermethylation of estrogen receptor-α gene in atheromatosis patients and its correlation with homocysteine». Pathophysiology 16 (4): 259-265. doi:10.1016/j.pathophys.2009.02.010.
- ↑ Dong, C.D.; Yoon, W.; Goldschmidt-Clermont, P.J. (2002). «DNA methylation and atherosclerosis». J Nutr 132 (8): 2406S-2409S.
- ↑ Ying, A.K.; Hassanain, H.H.; Roos, C.M.; Smiraglia, D.J.; Issa, J.J.; Michler, R.E.; Caligiuri, M.; Plass, C. et al. (2000). «Methylation of the estrogen receptor- α gene promoter is selectively increased in proliferating human aortic smooth muscle cells». Cardiovas Res 46 (1): 172-179. doi:10.1016/s0008-6363(00)00004-3.
- ↑ Zhu, S.; Goldschmidt-Clermont, P.J.; Dong, C. (2005). «Inactivation of Monocarboxylate Transporter MCT3 by DNA methylation in atherosclerosis». Circulation 112 (9): 1353-1361. doi:10.1161/circulationaha.104.519025.
- ↑ Wong CC1, Caspi A, Williams B, Craig IW, Houts R, Ambler A, Moffitt TE, Mill J (2010). «A longitudinal study of epigenetic variation in twins». Epigenetics 5 (6): 516-526. PMC 3322496. PMID 20505345. doi:10.4161/epi.5.6.12226. Archivado desde el original el 27 de diciembre de 2015. Consultado el 12 de julio de 2016.
- ↑ Heyn, Holger; Li, Ning; Ferreira, Humberto J.; Moran, Sebastian; Pisano, David G.; Gomez, Antonio; Diez, Javier; Sanchez-Mut, Jose V. et al. (26 de junio de 2012). «Distinct DNA methylomes of newborns and centenarians». Proceedings of the National Academy of Sciences (en inglés) 109 (26): 10522-10527. ISSN 0027-8424. PMC 3387108. PMID 22689993. doi:10.1073/pnas.1120658109.
- ↑ Horvath S (2013). «DNA methylation age of human tissues and cell types». Genome Biology 14 (10): R115. PMC 4015143. PMID 24138928. doi:10.1186/gb-2013-14-10-r115. Archivado desde el original el 20 de enero de 2018. Consultado el 12 de julio de 2016.
- ↑ Jones, M. J.; Goodman, S. J.; Kobor, M. S. (2015). «DNA methylation and healthy human aging». Aging Cell 14: 924-932. doi:10.1111/acel.12349.
- ↑ a b Barrès R1, Yan J, Egan B, Treebak JT, Rasmussen M, Fritz T, Caidahl K, Krook A, O'Gorman DJ, Zierath JR (2012). «Acute exercise remodels promoter methylation in human skeletal muscle». Cell Metabolism 15 (3): 405-411. PMID 22405075. doi:10.1016/j.cmet.2012.01.001.
- ↑ Rönn T1, Volkov P, Davegårdh C, Dayeh T, Hall E, Olsson AH, Nilsson E, Tornberg A, Dekker Nitert M, Eriksson KF, Jones HA, Groop L, Ling C (2013). «A six months exercise intervention influences the genome-wide DNA methylation pattern in human adipose tissue». PLOS Genetics 9 (6): e1003572. PMC 3694844. PMID 23825961. doi:10.1371/journal.pgen.1003572.
- ↑ Zhou, Wanding; Liang, Gangning; Molloy, Peter L.; Jones, Peter A. (11 de agosto de 2020). «DNA methylation enables transposable element-driven genome expansion». Proceedings of the National Academy of Sciences (en inglés) 117 (32): 19359-19366. ISSN 0027-8424. PMID 32719115. doi:10.1073/pnas.1921719117. Consultado el 1 de enero de 2021.
- ↑ Gratchev, Alexei. Review on DNA Methylation. (n.d.) Retrieved from http://www.methods.info/Methods/DNA_methylation/Methylation_review.html
- ↑ Goll MG, Kirpekar F, Maggert KA, Yoder JA, Hsieh CL, Zhang X, Golic KG, Jacobsen SE, Bestor TH (January 2006). «Methylation of tRNAAsp by the DNA methyltransferase homolog Dnmt2». Science 311 (5759): 395-398. PMID 16424344. doi:10.1126/science.1120976.
- ↑ Cao X, Jacobsen SE (December 2002). «Locus-specific control of asymmetric and CpNpG methylation by the DRM and CMT3 methyltransferase genes». PNAS 99 (Suppl 4): 16491-16498. PMC 139913. PMID 12151602. doi:10.1073/pnas.162371599.
- ↑ a b Aufsatz W, Mette MF, van der Winden J, Matzke AJ, Matzke M (2002). «RNA-directed DNA methylation in Arabidopsis». PNAS 99 (90004): 16499-16506. PMC 139914. PMID 12169664. doi:10.1073/pnas.162371499.
- ↑ Antequera F, Tamame M, Villanueva JR, Santos T (July 1984). «DNA methylation in the fungi». J. Biol. Chem. 259 (13): 8033-8036. PMID 6330093.
- ↑ Binz T, D'Mello N, Horgen PA (1998). «A comparison of DNA methylation levels in selected isolates of higher fungi». Mycologia (Mycological Society of America) 90 (5): 785-790. JSTOR 3761319. doi:10.2307/3761319.
- ↑ Si-Yang, Liu; Jian-Qing, Lin; Hong-Long, Wu; Cheng-Cheng, Wang; Shu-Jia, Huang; Yan-Feng, Luo; Ji-Hua, Sun; Jian-Xiang, Zhou; Shu-Jing, Yan; Jian-Guo, He; Jun, Wang; Zhu-Mei, He (2012). «Bisulfite sequencing reveals that aspergillus flavus holds a hollow in DNA methylation». PLOS ONE 7 (1): e30349. doi:10.1371/journal.pone.0030349.
- ↑ Selker EU, Tountas NA, Cross SH, Margolin BS, Murphy JG, Bird AP, Freitag M (2003). «The methylated component of the Neurospora crassa genome». Nature 422 (6934): 893-897. PMID 12712205. doi:10.1038/nature01564.
- ↑ «Functional CpG Methylation System in a Social Insect». Science 314: 645-647. October 2006. PMID 17068262. doi:10.1126/science.1135213.
- ↑ Ying and Li-Byarlay. «Physiological and Molecular Mechanisms of Nutrition in Honey Bees». Advances in Insect Physiology: 25-58. doi:10.1016/bs.aiip.2015.06.002.
- ↑ Li-Byarlay H. «RNA interference knockdown of DNA methyl-transferase 3 affects gene alternative splicing in the honey bee». PNAS 110: 12750-12755. doi:10.1073/pnas.1310735110.
- ↑ Takayama, S.; Dhahbi, J.; Roberts, A.; Mao, G.; Heo, S.-J.; Pachter, L.; Martin, D. I. K.; Boffelli, D. (2014). «Genome methylation in D. melanogaster is found at specific short motifs and is independent of DNMT2 activity». Genome Research 24: 821-830. doi:10.1101/gr.162412.113.
- ↑ «N6-Methyladenine DNA Modification in Drosophila». Cell 161: 893-906. doi:10.1016/j.cell.2015.04.018.
- ↑ Palmer BR, Marinus MG (1994). «The dam and dcm strains of Escherichia coli—a review». Gene 143 (1): 1-12. PMID 8200522. doi:10.1016/0378-1119(94)90597-5.
- ↑ «Making unmethylated (dam-/dcm-) DNA». Archivado desde el original el 6 de enero de 2011.
- ↑ Hernández, H. G.; Tse, M. Y.; Pang, S. C.; Arboleda, H.; Forero, D. A. (2013). «Optimizing methodologies for PCR-based DNA methylation analysis». BioTechniques 55 (4): 181-197. PMID 24107250. doi:10.2144/000114087.
- ↑ Wood RJ, Maynard-Smith MD, Robinson VL, Oyston PC, Titball RW, Roach PL (2007). «Kinetic analysis of Yersinia pestis DNA adenine methyltransferase activity using a hemimethylated molecular break light oligonucleotide». En Fugmann, Sebastian, ed. PLoS ONE 2 (8): e801. PMC 1949145. PMID 17726531. doi:10.1371/journal.pone.0000801.
- ↑ Li J, Yan H, Wang K, Tan W, Zhou X (February 2007). «Hairpin fluorescence DNA probe for real-time monitoring of DNA methylation». Anal. Chem. 79 (3): 1050-1056. PMID 17263334. doi:10.1021/ac061694i.
- ↑ ^ David R. McCarthy, Philip D. Cotter, and Michelle M. Hanna (2012). MethylMeter(r): A Quantitative, Sensitive, and Bisulfite-Free Method for Analysis of DNA Methylation, DNA Methylation - From Genomics to Technology, Dr. Tatiana Tatarinova (Ed.), ISBN 978-953-51-0320-2, InTech, DOI: 10.5772/36090. Available from: http://www.intechopen.com/books/dna-methylation-from-genomics-to-technology/methylmeter-a-quantitative-sensititive-and-bisulfite-free-method-for-analysis-of-dna-methylation
- ↑ Wojdacz, TK; Dobrovic, A (2007). «Methylation-sensitive high resolution melting (MS-HRM): a new approach for sensitive and high-throughput assessment of methylation». Nucleic Acids Res. 35 (6): e41. PMC 1874596. PMID 17289753. doi:10.1093/nar/gkm013.
- ↑ Malentacchi, F; Forni, G; Vinci, S; Orlando, C (2009). «Quantitative evaluation of DNA methylation by optimization of a differential-high resolution melt analysis protocol». Nucleic Acids Res. 37 (12): e86. PMC 2709587. PMID 19454604. doi:10.1093/nar/gkp383.
- ↑ Gokhman D1, Lavi E, Prüfer K, Fraga MF, Riancho JA, Kelso J, Pääbo S, Meshorer E, Carmel L. (2014). «Reconstructing the DNA methylation maps of the Neandertal and the Denisovan.». Science 344 (6183): 523-7. PMID 24786081. doi:10.1126/science.1250368.
- ↑ Rakyan, VK; Down, TA; Thorne, NP; Flicek, P; Kulesha, E; Gräf, S; Tomazou, EM; Bäckdahl, L; Johnson, N; Herberth, M; Howe, KL; Jackson, DK; Miretti, MM; Fiegler, H; Marioni, JC; Birney, E; Hubbard, TJ; Carter, NP; Tavaré, S; Beck, S (September 2008). «An integrated resource for genome-wide identification and analysis of human tissue-specific differentially methylated regions (tDMRs).». Genome Research 18 (9): 1518-29. PMC 2527707. PMID 18577705. doi:10.1101/gr.077479.108.
- ↑ Lee, Hwan Young; Park, Myung Jin; Choi, Ajin; An, Ja Hyun; Yang, Woo Ick; Shin, Kyoung-Jin. «Potential forensic application of DNA methylation profiling to body fluid identification». International Journal of Legal Medicine 126 (1): 55-62. doi:10.1007/s00414-011-0569-2.
- ↑ Irizarry, RA; Ladd-Acosta, C; Wen, B; Wu, Z; Montano, C; Onyango, P; Cui, H; Gabo, K; Rongione, M; Webster, M; Ji, H; Potash, JB; Sabunciyan, S; Feinberg, AP (February 2009). «The human colon cancer methylome shows similar hypo- and hypermethylation at conserved tissue-specific CpG island shores.». Nature Genetics 41 (2): 178-86. PMC 2729128. PMID 19151715. doi:10.1038/ng.298.
- ↑ Reik, W; Dean, W; Walter, J (Aug 10, 2001). «Epigenetic reprogramming in mammalian development.». Science 293 (5532): 1089-93. PMID 11498579. doi:10.1126/science.1063443.
- ↑ Meissner, A; Mikkelsen, TS; Gu, H; Wernig, M; Hanna, J; Sivachenko, A; Zhang, X; Bernstein, BE; Nusbaum, C; Jaffe, DB; Gnirke, A; Jaenisch, R; Lander, ES (Aug 7, 2008). «Genome-scale DNA methylation maps of pluripotent and differentiated cells.». Nature 454 (7205): 766-70. PMC 2896277. PMID 18600261. doi:10.1038/nature07107.
- ↑ Doi, A; Park, IH; Wen, B; Murakami, P; Aryee, MJ; Irizarry, R; Herb, B; Ladd-Acosta, C; Rho, J; Loewer, S; Miller, J; Schlaeger, T; Daley, GQ; Feinberg, AP (December 2009). «Differential methylation of tissue- and cancer-specific CpG island shores distinguishes human induced pluripotent stem cells, embryonic stem cells and fibroblasts.». Nature Genetics 41 (12): 1350-3. PMC 2958040. PMID 19881528. doi:10.1038/ng.471.
- ↑ Bjornsson, HT; Sigurdsson, MI; Fallin, MD; Irizarry, RA; Aspelund, T; Cui, H; Yu, W; Rongione, MA; Ekström, TJ; Harris, TB; Launer, LJ; Eiriksdottir, G; Leppert, MF; Sapienza, C; Gudnason, V; Feinberg, AP (25 de junio de 2008). «Intra-individual change over time in DNA methylation with familial clustering.». JAMA: The Journal of the American Medical Association 299 (24): 2877-83. PMC 2581898. PMID 18577732. doi:10.1001/jama.299.24.2877.
- ↑ Bock, C; Walter, J; Paulsen, M; Lengauer, T (June 2008). «Inter-individual variation of DNA methylation and its implications for large-scale epigenome mapping.». Nucleic Acids Research 36 (10): e55. PMC 2425484. PMID 18413340. doi:10.1093/nar/gkn122.
- ↑ Zhang, Y; Liu, H; Lv, J; Xiao, X; Zhu, J; Liu, X; Su, J; Li, X; Wu, Q; Wang, F; Cui, Y (May 2011). «QDMR: a quantitative method for identification of differentially methylated regions by entropy.». Nucleic Acids Research 39 (9): e58. PMC 3089487. PMID 21306990. doi:10.1093/nar/gkr053.
- ↑ Geeleher P, Hartnett L, Egan LJ, Golden A, Raja Ali RA, Seoighe C (June 2013). «Gene-Set Analysis is Severely Biased When Applied to Genome-wide Methylation Data». Bioinformatics 29 (15): 1851-7. PMID 23732277. doi:10.1093/bioinformatics/btt311.
- ↑ Liu, Hongbo; Liu, Xiaojuan; Zhang, Shumei; Lv, Jie; Li, Song; Shang, Shipeng; Jia, Shanshan; Wei, Yanjun; Wang, Fang; Su, Jianzhong; Wu, Qiong; Zhang, Yan (8 de enero de 2016). «Systematic identification and annotation of human methylation marks based on bisulfite sequencing methylomes reveals distinct roles of cell type-specific hypomethylation in the regulation of cell identity genes». Nucleic Acids Research 44 (1): 75-94. doi:10.1093/nar/gkv1332.
- ↑ Liu, Hongbo. «Specific Methylation Analysis and Report Tool». SMART. Archivado desde el original el 9 de marzo de 2016. Consultado el 12 de julio de 2016.
- ↑ Liu, Hongbo. «Human Methylation Mark Atlas». Human Methylation Mark Atlas.
- ↑ Bhasin M, Zhang H, Reinherz EL, Reche PA (Aug 2005). «Prediction of methylated CpGs in DNA sequences using a support vector machine». FEBS Lett. 579 (20): 4302-8. PMID 16051225. doi:10.1016/j.febslet.2005.07.002.
- ↑ Bock C, Paulsen M, Tierling S, Mikeska T, Lengauer T, Walter J (Mar 2006). «CpG island methylation in human lymphocytes is highly correlated with DNA sequence, repeats, and predicted DNA structure». PLoS Genet. 2 (3): e26. PMC 1386721. PMID 16520826. doi:10.1371/journal.pgen.0020026.
- ↑ Zheng H, Jiang SW, Wu H (2011). «Enhancement on the predictive power of the prediction model for human genomic DNA methylation». International Conference on Bioinformatics and Computational Biology (BIOCOMP'11).
- ↑ Zheng H, Jiang SW, Li J, Wu H (2013). «CpGIMethPred: computational model for predicting methylation status of CpG islands in human genome». BMC Medical Genomics).
Bibliografía
[editar]- Law J, Jacobsen SE (2010). «Establishing, maintaining and modifying DNA methylation patterns in plants and animals». Nat. Rev. Genet. 11 (3): 204-220. PMC 3034103. PMID 20142834. doi:10.1038/nrg2719.
- Straussman R, Nejman D, Roberts D (2009). «Developmental programming of CpG island methylation profiles in the human genome». Nat. Struct. Mol. Biol. 16 (5): 564-571. PMID 19377480. doi:10.1038/nsmb.1594.
- Patra SK (2008). «Ras regulation of DNA-methylation and cancer». Exp Cell Res 314 (6): 1193-1201. PMID 18282569. doi:10.1016/j.yexcr.2008.01.012.
- Patra SK, Patra A, Ghosh TC (2008). «Demethylation of (cytosine-5-C-methyl) DNA and regulation of transcription in the epigenetic pathways of cancer development». Cancer Metast. Rev. 27 (2): 315-334. PMID 18246412. doi:10.1007/s10555-008-9118-y.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Metilación del ADN.
Wikimedia Commons alberga una categoría multimedia sobre Metilación del ADN.- MeSH: DNA+Methylation (en inglés)
- ENCODE threads explorer Caracterización del ARN no codificante Nature (journal)
- PCMdb Base de datos de la metilación del cáncer pancreático Nature Scientific Report 4:4197