Nicotinamida adenina dinucleótido

| Dinucleótido de nicotinamida y adenina | ||
|---|---|---|
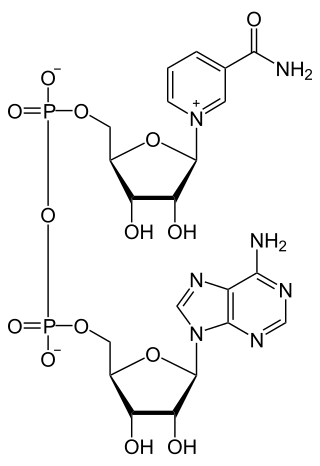 Fórmula química | ||
| Nombre IUPAC | ||
| NAD+ | ||
| General | ||
| Otros nombres | Difosfopiridina nucleótido (DPN+ ), Coenzima I. | |
| Fórmula estructural | Ver imagen | |
| Fórmula molecular | C 21H 27N 7O 14P 2 | |
| Identificadores | ||
| Número CAS | 53-84-9 58-68-4 (NADH)[1] | |
| Número RTECS | UU3450000 | |
| ChEBI | 13389 | |
| ChemSpider | 5681 | |
| DrugBank | DB14128 | |
| PubChem | 925 | |
| UNII | 0U46U6E8UK | |
| Propiedades físicas | ||
| Apariencia | Polvo blanco | |
| Masa molar | 663,43 g/mol | |
| Punto de fusión | 333 K (60 °C) | |
| Peligrosidad | ||
| NFPA 704 |
1 1 0 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El dinucleótido de nicotinamida y adenina, también conocido como nicotin adenin dinucleótido o nicotinamida adenina dinucleótido (abreviado NAD+ en su forma oxidada y NADH en su forma reducida), es una coenzima que se halla en las células vivas y que está compuesta por un dinucleótido, es decir, por dos nucleótidos, unidos a través de grupos fosfatos: uno de ellos es una base de adenina y el otro, una nicotinamida. Su función principal es el intercambio de electrones y protones y la producción de energía de todas las células.[cita requerida]
En el metabolismo, el NAD+
está implicado en reacciones de reducción-oxidación, llevando los electrones de una a otra. Debido a esto, la coenzima se encuentra en dos formas: como un agente oxidante, que acepta electrones de otras moléculas. Actuando de ese modo da como resultado la segunda forma de la coenzima, el NADH, la especie reducida del NAD+
, y puede ser usado como agente reductor para donar electrones. Las reacciones de transferencia de electrones son la principal función del NAD+
, que también se emplea en otros procesos celulares, siendo el más notable su actuación como sustrato de enzimas que adicionan o eliminan grupos químicos de las proteínas en las modificaciones postraduccionales. Debido a la importancia de estas funciones, las enzimas involucradas en el metabolismo del NAD+
son objetivos para el descubrimiento de fármacos.
Desde un punto de vista económico, el elevado precio del NADH/NAD+ suele ser una desventaja en el uso de enzimas dependientes de cofactores en procesos biotecnológicos industriales. Por lo tanto, el desarrollo de cofactores biomiméticos sintéticos baratos es una tarea de investigación de importancia estratégica[2][3].
En los organismos, el NAD+
puede ser sintetizado a partir de biomoléculas sencillas como los aminoácidos de triptófano o ácido aspártico. Como alternativa, se pueden obtener componentes más completos de la coenzima a partir de los alimentos, como la vitamina llamada niacina. Asimismo, se conocen compuestos similares que provienen de las reacciones que descomponen la estructura del NAD+
. Estos componentes preformados pasan entonces a través de un camino de rescate que los recicla de nuevo a la forma activa. Parte del NAD+
se convierte también en nicotinamida adenina dinucleótido fosfato (NADP+
); la química de estas coenzimas relacionadas es similar a la del NAD+
, pero tiene diferentes papeles en el metabolismo.
Historia
[editar] |  |
y NADH, representadas según el modelo de bolas y varillas.

La coenzima NAD+
fue descubierta por los bioquímicos británicos Arthur Harden y William Youndin en 1906.[4] Notificaron que al adherir extracto de levadura hervido y filtrado, se aceleraba en gran medida la fermentación alcohólica en extractos de levadura sin hervir. Cofermento fue como ellos llamaron al factor no identificado responsable de este efecto. A través de una larga y dificultosa purificación a partir de extractos de levadura, el sueco Hans von Euler-Chelpin identificó a este factor termoestable como un nucleótido de azúcar fosfato.[5] En 1936, el científico alemán Otto Heinrich Warburg demostró la función de la coenzima nucleótida en la transferencia de hidruro e identificó la porción de nicotinamida como el sitio de las reacciones redox.[6]
En 1938, fue identificada una fuente de nicotinamida cuando Conrad Elvehjem purificó niacina procedente del hígado y demostró que esta vitamina contenía ácido nicotínico y nicotinamida,[7] y luego, en 1939, proporcionó la primera evidencia sólida de que la niacina era usada para sintetizar NAD+
.[8] A principios de la década de 1940, Arthur Kornberg realizó otra importante contribución para el avance hacia la comprensión del metabolismo del NAD+
, pues fue el primer científico en detectar una enzima en la ruta biosintética.[9] Subsecuentemente, en 1949, los bioquímicos estadounidenses Morris Friedkin y Albert L. Lehninger descubrieron que el NADH se encontraba enlazado a rutas metabólicas como el ciclo del ácido cítrico con la síntesis de ATP en la fosforilación oxidativa.[10]
Finalmente, en 1959, Jack Preiss y Philip Handler descubrieron los intermediarios y enzimas involucrados en la biosíntesis de NAD+
;[11][12] debido a lo cual, la síntesis de novo es frecuente llamada «ruta de Preiss-Handler» en su honor.
Las funciones no redox del NAD y el NADP son un reciente descubrimiento.[13] La primera de estas funciones en ser identificada fue el uso del NAD+
como donante de ADP-ribosa en las reacciones de ADP-ribosilación observadas comienzos de la década de 1960.[14] Estudios posteriores en los años 80 y 90, revelaros las actividades de los metabolitos de NAD+
y NADP+
en la comunicación celular; tales como la acción de ADP-ribosa cíclica, que fue descubierta en 1987.[15] El metabolismo del NAD+
sigue siendo hoy en día un área de intensa investigación, con un mayor interés después de que en el año 2000 Shinichiro Imai y unos colaboradores, descubriesen en el Instituto Tecnológico de Massachusetts las llamadas sirtuinas; proteínas deacetilasas dependientes de la NAD+
.[16]
Propiedades físicas y químicas
[editar]El dinucleótido de nicotinamida adenina, al igual que todos los dinucleótidos, está formado por dos nucleótidos unidos por un par de grupos fosfato que actúan como puente. Dichos nucleótidos consisten en dos anillos de ribosa: uno con adenina unida al primer átomo de carbono (en la posición 1') y otro con nicotinamida en la misma posición. La porción de nicotinamida se puede unir con dos orientaciones distintas a su átomo de carbono anomérico. Debido a estas dos posibles estructuras, el compuesto existe como dos diastereoisómeros, de los cuales el diastereoisómero β-nicotinamida de NAD+
es la forma que se encuentra en los organismos. Estos nucleótidos se unen juntos por un puente de dos grupos fosfato a través de los carbonos de la posición 5'.[13]
En el metabolismo, el compuesto acepta o cede electrones en reacciones redox.[17] Tales reacciones (resumidas en la fórmula de abajo) implican la extracción de dos átomos de hidrógeno desde el reactivo (R), en la forma de un ion hidruro (H-), y un protón (H+). El protón se libera en la solución, mientras el reductor RH2 se oxida y el NAD+
se reduce a NADH debido a la transferencia del hidruro a los anillos de nicotinamida.
- RH
2 + NAD+
→ NADH + H+
+ R
Desde el par de electrones de hidruro se transfiere un electrón al nitrógeno con carga positiva del anillo de nicotinamida del NAD+
, y el segundo átomo de hidrógeno se transfiere al átomo de carbono C4 opuesto a dicho nitrógeno. El potencial del punto medio del par de reacciones redox entre el NAD+
y el NADH es -0.32 voltios, lo cual hace al NADH un fuerte agente reductor.[18] La reacción es fácilmente reversible cuando el NADH reduce otra molécula y es re-oxidada a NAD+
. Esto significa que esta coenzima puede permanecer continuamente en un ciclo entre sus formas de NAD+
y NADH sin ser consumida.[13]

En apariencia, todas las formas de esta coenzima son polvos blancos amorfos que son higroscópicos y altamente solubles en agua.[19] La forma sólida es estable si se conserva seca y en la oscuridad. Las soluciones de NAD+
son incoloras y estables durante aproximadamente una semana a 4 °C y un pH neutro (igual a 7), pero se descomponen rápidamente en ácidos o alcalinos. Tras su descomposición forman productos que son inhibidores enzimáticos.[20]
Tanto la NAD+
como el NADH absorben fuertemente en la banda ultravioleta debido a la base de adenina. Por ejemplo, el pico de absorción del NAD+
se sitúa en una longitud de onda de 259 nanómetros (nm), con un coeficiente molar de absorción de 16 900 M−1cm−1. Mientras que el NADH tiene una absorción de ultravioleta de 339 nm con un coeficiente molar de absorción de 6220 M−1cm.[21] Esta diferencia en la absorción de espectros ultravioleta entre la forma oxidada y la reducida de la coenzima a más altas longitudes de onda hace que sea simple el medir la conversión de una a otra forma mediante ensayos enzimáticos, midiendo la cantidad de absorción de rayos UV a 340 nm a través de un espectrómetro.[21]

y la NADH.
El NAD+
y el NADH también difieren en su fluorescencia, ya que el segundo, tiene en solución un pico de emisión a 460 nm y un tiempo de vida de fluorescencia de 0,4 nanosegundos (ns), mientras que la forma oxidada de la coenzima (NAD+
) no fluoresce.[22] Las propiedades de la señal de fluorescencia cambian cuando el NADH se une a las proteínas, por lo que estos cambios pueden ser utilizados para medir las constantes de disociación, las cuales son útiles en el estudio de la cinética enzimática.[22][23] Tales cambios son utilizados también para medir los cambios en el estado redox de células vivas, a través del microscopio de fluorescencia.[24]
Concentración y estado en las células
[editar]En un hígado de rata la cantidad total de NAD+
y NADH es aproximadamente de 1 μmol por gramo de peso fresco, unas 10 veces la concentración de NADP+
y NADPH en las mismas células.[25] La concentración real de NAD+
en el citosol de la célula es más difícil de medir, con estimaciones recientes en células animales que están en torno a un rango de 0,3 mM,[26][27] y aproximadamente de 1,0 a 2,0 mM en levaduras.[17] Sin embargo, más del 80 % está unido a proteínas, así que la concentración en solución es mucho más baja.[28]

Los datos sobre otros compartimentos celulares son limitados, aunque en la mitocondria la concentración de NAD+
es similar a la del citosol.[27] Este NAD+
es transportado al interior de la mitocondria por una proteína específica dentro de la membrana, ya que la coenzima no puede pasar a través de las membranas mediante difusión.[29]
El balance entre la forma oxidada y reducida de la nicotinamida adenina dinucleótido se llama proporción NAD+
/NADH. Esta proporción es un componente de lo que se llama estado redox de una célula, una medición que refleja tanto las actividades metabólicas como la salud de las células.[30] Los efectos de la proporción NAD+
/NADH son complejos, pues controlan la actividad de varias enzimas claves, incluyendo la gliceraldehído-3-fosfato deshidrogenasa y la piruvato deshidrogenasa. En los tejidos sanos de mamíferos la estimación de la proporción entre la NAD+
libre y la NADH en el citoplasma se encuentra típicamente alrededor de 700; por lo cual la proporción es favorable para reacciones de oxidación.[31][32] La proporción de NAD+
/NADH total es mucha más bajo, con rangos estimados de 0,05 a 4.[33] En cambio, la proporción de NADP+
/NADPH está normalmente alrededor de 0,005, así que el NADPH es la forma dominante de esta coenzima.[34] Estas distintas proporciones son la clave para los diferentes roles metabólicos del NADH y el NADPH.
Biosíntesis
[editar]El NAD+
se sintetiza a través de dos rutas metabólicas: ya sea una ruta de novo a partir de aminoácidos, o en rutas de rescate mediante el reciclado de componentes preformados como la nicotinamida convertida de nuevo en NAD+
.
Producción de novo
[editar]
en los vertebrados. Las abreviaciones están definidas en el texto.
La mayoría de los organismos sintetizan NAD+
a partir de componentes simples.[17] El sitio específico de la reacción es diferente entre los organismos, pero un rasgo común es la generación de ácido quinolínico (QA) a partir de un aminoácido; ya sea el triptófano (Trp) en animales y algunas bacterias, o el ácido aspártico en algunas bacterias y plantas.[35][36] El ácido quinolínico se convierte en ácido nicotínico mononucleótido (NaMN) mediante la transferencia del grupo fosforibosa. Un grupo adenina es transferido entonces para formar dinucleótido de ácido adenina (NaAD). Finalmente, el grupo de ácido nicotínico en NaAD es amidado a grupo nicotinamida (Nam), formando así nicotinamida de adenina dinucleótido.[17]
Tras esto, algunos NAD+
se convierten en NADP+
mediante la enzima NAD+
quinasa —que está especializada en ello—, mediante la fosforilación del NAD+
.[37] En la mayoría de los organismos, esta enzima utiliza ATP como fuente del grupo fosfato, aunque en algunas bacterias, como la Mycobacterium tuberculosis y algunas arqueobacterias hipertermofílas como la Pyrococcus horikoshii del género Pyrococcus, usan polifosfatos inorgánicos como un donante alternativo de fosforilo.[38][39]

.
Rutas de rescate
[editar]Además de ensamblar el NAD+
de novo a partir de aminoácidos precursores simples, las células también rescatan compuestos preformados que contienen nicotinamida. Aunque se conocen otros precursores, los tres compuestos naturales que contienen el anillo de nicotinamida y son usados en estas rutas metabólicas de rescate son el ácido nicotínico (Na), la nicotinamida (Nam) y la nicotinamida ribósido (NR).[40] Los precursores se introducen en la ruta biosintética de NAD(P)+
(mostrada abajo) a través de reacciones de adenilación y fosforibosilación.[17] Estos compuestos se pueden tomar a partir de la dieta, donde la mezcla de ácido nicotínico y nicotinamida se conoce como vitamina B3 o niacina. Sin embargo, estos compuestos también son producidos en el interior de las células, cuando el grupo nicotinamida es liberado del NAD+
en las reacciones de transferencia de ADP-ribosa. De hecho, las enzimas involucradas en dichas rutas de rescate parecen estar concentradas en el núcleo celular, lo que puede compensar el alto nivel de reacciones que consumen NAD+
en este orgánulo.[41] Las células pueden también tomar NAD+
extracelular a partir de sus alrededores.[42]
A pesar de la presencia de la ruta de novo, las reacciones de rescate son esenciales en los seres humanos; una carencia de niacina en la dieta provoca la enfermedad de déficit vitamínico conocida como pelagra.[43] Esta elevada exigencia de NAD+
resulta del constante consumo de la coenzima en reacciones tales como las modificaciones post-traduccionales, ya que el ciclado del NAD+
entre las forma oxidada y reducida en las reacciones redox no cambia en nada los niveles generales de la coenzima.[17]
Las rutas de rescate utilizadas en microorganismos difieren de las usadas en mamíferos.[44] Por ejemplo, algunos agentes patógenos, como la levadura Candida glabrata y la bacteria Haemophilus influenzae son auxótrofos de NAD+
, es decir, no pueden sintetizar NAD+
, pero poseen rutas de rescate y por ende son dependientes de fuentes externas de NAD+
o de sus precursores.[45][46]
Aún más sorprendente es el patógeno intracelular Chlamydia trachomatis, que carece de candidatos reconocibles para cualquiera de los genes implicados en la biosíntesis o el rescate tanto del NAD+
como del NADP+
, por lo cual debe adquirir estas coenzimas a partir su hospedante.[47]
Funciones
[editar]
en rojo, las beta-láminas en amarillo, y las hélices alfa en morado.[48]
La nicotinamida adenina dinucleótido tiene varias funciones esenciales en el metabolismo. Actúa como coenzima en las reacciones redox, como donante de grupos ADP-ribosa en las reacciones de ADP-ribosilación, como precursor del segundo mensajero de la molécula cíclica ADP-ribosa, así como también actúa como sustrato para las ADN ligasas bacterianas y un grupo de enzimas llamadas sirtuinas, que usan NAD+
para eliminar los grupos acetilo de las proteínas acetiladas.
Oxidorreductasas
[editar]El papel principal del NAD+
en el metabolismo es la transferencia de electrones de una molécula a otra. Las reacciones de este tipo son catalizadas por un gran grupo de enzimas llamadas oxidorreductasas. Los nombres correctos para estas enzimas contienen los nombres de sus dos sustratos: por ejemplo, la NADH-ubiquinona oxidorreductasa cataliza la oxidación del NADH por la coenzima Q.[49] Sin embargo, estas enzimas son también conocidas como deshidrogenasas o reductasas, con lo que la NADH-ubiquinona oxidorreductasa es comúnmente llamada NADH deshidrogenasa o coenzima Q reductasa.[50]
Cuando el NAD+
y el NADH están unidos a una proteína se mantienen habitualmente dentro de un motivo estructural conocido como pliegue o plegamiento de Rossmann.[51] Este motivo recibe su nombre del científico Michael Rossmann, que fue el primero en observar lo común que es esta estructura dentro de las proteínas que se unen a nucleótidos.[52] Este plegamiento contiene tres o más láminas beta paralelas unidas por dos hélices alfa en orden beta-alfa-beta-alfa-beta. Esto forma una hoja beta flanqueada por una capa de hélices alfa a cada lado. Debido a que cada pliegue de Rossmann se une a un nucleótido, los dominios de unión para el dinucleótido NAD+
están formados por dos pares de pliegues de Rossmann, con cada pliegue uniendo un nucleótido del cofactor.[52] Sin embargo, este pliegue no es universal entre las enzimas dependientes de NAD, ya que se ha descubierto recientemente que una clase de enzimas bacterianas involucradas en el metabolismo de los aminoácidos se une a la coenzima, pero carecen de este motivo.[53]

.
Cuando se une al sitio activo de una oxidorreductasa, el anillo de nicotinamida de la coenzima se coloca de modo que pueda aceptar un hidruro del otro sustrato. Debido a que el carbono C4 que acepta el hidrógeno es proquiral, esto puede ser aprovechado en la cinética enzimática para dar información sobre el mecanismo de la enzima. Esto se hace mediante la mezcla de una enzima con un sustrato que tiene átomos de deuterio que sustituyen sus hidrógenos, por lo que la enzima reducirá el NAD+
transfiriendo deuterio en lugar de hidrógeno. En este caso, una enzima puede producir uno de los dos estereoisómeros de NADH. En algunas enzimas, el hidrógeno se transfiere desde arriba del plano superior del anillo de nicotinamida; estas son llamadas oxidorreductasas de clase A, mientras que las enzimas de clase B transfieren el átomo desde abajo.[54]
A pesar de esta similitud en la forma en que las proteínas se unen a las dos coenzimas, las enzimas casi siempre muestran un alto nivel de especificidad, ya sea por el NAD+
o el NADP+
.[55] Esta especificidad refleja las distintas funciones metabólicas de las respectivas coenzimas, y es el resultado de diferentes series de residuos de aminoácidos en los dos tipos de sitio de unión a la coenzima. Por ejemplo, en el sitio activo de las enzimas dependientes de ADP, se forma un enlace iónico entre la cadena lateral de un aminoácido básico y el grupo fosfato ácido del NADP+
. Por el contrario, en las enzimas dependientes de NAD+
, la carga en este hueco se invierte, evitando que se una el NADP+
. Sin embargo, hay algunas pocas excepciones a esta regla general, y enzimas como la aldosa reductasa, Glucosa-6-fosfato deshidrogenasa (G6FD), y la metilentetrahidrofolato reductasa pueden utilizar ambas coenzimas en algunas especies.[56]
Papel en el metabolismo redox
[editar]
y el NADH enlazan el ciclo de Krebs y la fosforilación oxidativa.
Las reacciones redox catalizadas por oxidorreductasas son vitales en todo el metabolismo, pero dentro del proceso de estas reacciones es de particular importancia la liberación de energía a partir de los nutrientes, donde los compuestos reducidos, como la glucosa, se oxidan, liberando de este modo energía, que es transferida al NAD+
mediante la reducción hacia el NADH, como parte de la glucólisis y el ciclo de Krebs. En células eucariotas, los electrones transportados por el NADH que se produce en el citoplasma por glucólisis, son transferidos al interior de la mitocondria (para reducir el NAD+
mitocondrial) por lanzaderas mitocondriales, como la lanzadera malato-aspartato.[57] El NADH mitocondrial es entonces oxidado a su vez por la cadena de transporte de electrones, que bombea protones a lo largo de la membrana y genera ATP a través de fosforilación oxidativa.[58] Estos sistemas de lanzadera también tienen la misma función de transporte en los cloroplastos.[59]
Dado que las formas oxidada como reducida de la nicotinamida adenina dinucleótido son usadas en estos conjuntos enlazados de reacciones, la célula mantiene concentraciones significativas tanto de NAD+
como de NADH, con una alta proporción de NAD+
/NADH que permite a esta coenzima actuar como agente oxidante y agente reductor. En contraste, la función principal del NADH es la de agente reductor en el anabolismo, estando la coenzima implicada en rutas como la biosíntesis de ácidos grasos y la fotosíntesis. Puesto que el NADPH es necesario para conducir las reacciones redox como un fuerte agente reductor, la proporción NADP+
/NADPH se mantiene muy baja.[60]
Aunque es importante en el catabolismo, el NADH se utiliza también en reacciones anabólicas como la gluconeogénesis.[61] Esta necesidad de NADH en el anabolismo presenta un problema para los procariotas que crecen en nutrientes que liberan sólo una pequeña cantidad de energía. Por ejemplo, las bacterias nitrificantes como Nitrobacter oxidan el nitrito a nitrato, lo que libera energía suficiente para bombear los protones y generar ATP, pero no para producir NADH directamente.[62] Como el NADH sigue siendo necesario para las reacciones anabólicas, estas bacterias usan una nitrito oxidorreductasa para producir suficiente fuerza motriz de protones y dirigir parte de la cadena de transporte de electrones en sentido inverso, generando NADH.[63]
Funciones no redox
[editar]La coenzima NAD+
se consume también en las reacciones de transferencia de ADP-ribosa. Por ejemplo, las enzimas llamadas ADP-ribosiltransferasas añaden el grupo ADP-ribosa de esta molécula a las proteínas, en una modificación postraduccional llamada ADP-ribosilación.[64] La NAD+
puede ser también adherida dentro del ARN celular como una modificación de base.[65] La ADP-ribosilación implica ya sea la adición de un solo grupo ADP-ribosa; en mono-ADP-ribosilación, o la transferencia de ADP-ribosa a las proteínas en cadenas largas ramificadas, que es llamada poli(ADP-ribosil)ación.[66] La mono-ADP-ribosilación se identificó por primera vez como el mecanismo de un grupo de toxinas bacterianas, particularmente la toxina colérica, pero también se involucra en la comunicación celular normal.[67][68] La Poli(ADP-ribosil)ación es llevada a cabo por las poli(ADP-ribosa) polimerasas.[66][69] La estructura de la poli-(ADP-ribosa) está implicada en la regulación de varios eventos celulares, y es la más importante en el núcleo celular, actuando en procesos como la reparación del ADN y el mantenimiento del telómero.[69] En adición a estas funciones dentro de la célula, se ha descubierto recientemente un grupo de ADP-ribosiltransferasas extracelulares, pero sus funciones permanecen en duda.[70]

Esta coenzima actúa también dentro de la comunicación celular como precursora de la ADP-ribosa cíclica; que se produce a partir de NAD+
por ADP-ribosil ciclasas, siendo la coenzima un segundo mensajero.[71] Esta molécula actúa en la señalización de calcio liberando calcio de las reservas intracelulares.[72] Esto lo realiza abriendo y enlazando a una clase de canales de calcio llamados receptores de rianodina, que se encuentran localizadas en las membranas de los orgánulos como el retículo endoplasmático.[73]
El NAD+
también es consumido por las sirtuinas, que son deacetilasas dependientes de NAD, como la Sir2.[74] Estas enzimas actúan transfiriendo un grupo acetilo de sus proteínas sustrato al grupo ADP-ribosa del NAD+
; esto rompe la coenzima y libera nicotinamida y O-acetil-ADP-ribosa. Las sirtuinas más que todo parecen estar implicadas en la regulación de transcripción genética a través de histonas desacetilantes y la alteración de la estructura del nucleosoma.[75] Sin embargo, las proteínas no histonas pueden ser así mismo desacetilizadas por las sirtuinas. Estas actividades de las sirtuinas son particularmente interesantes debido a su importancia en la regulación del envejecimiento.[76]
Otras enzimas dependientes de la NAD incluyen las ADN ligasas bacterianas, que unen dos extremos del ADN usando NAD+
como un sustrato para donar un grupo de adenosín monofosfato (AMP) al fosfato 5' de un extremo de ADN. Este intermediario es entonces atacado por el grupo hidroxilo 3' del otro extremo de ADN, formando un nuevo enlace fosfodiéster.[77] Esto contrasta con las ADN ligasas eucariontes, que utilizan ATP para formar el intermediario ADN-AMP.[78]
Farmacología
[editar]Las enzimas que generan y utilizan NAD+
y NADH son importantes tanto para la farmacología actual como en la investigación para tratamientos de enfermedades.[79] El diseño y desarrollo de fármacos utiliza NAD+
de tres formas: como blanco directo de fármacos, mediante el diseño de inhibidores enzimáticos u otros activadores basados en su estructura que cambia la actividad de enzimas NAD dependientes, y también tratando de inhibir la biosíntesis de NAD+
.[80]
La coenzima NAD+
no se usa actualmente como tratamiento de ninguna enfermedad. No obstante, es potencialmente útil como agente terapéutico en las enfermedades neurodegenerativas como la enfermedad de Alzheimer y la enfermedad de Parkinson.[17] Las pruebas que existen sobre el uso de NAD + para evitar la degeneración neuronal son ambivalentes: en ratones son prometedoras,[81] mientras que un ensayo clínico en el que se incluían controles a los que se les administraba placebo no pudieron demostrar efectos apreciables.[82] La NAD+
también es un blanco directo del fármaco isoniazida, el cual se usa en el tratamiento de la tuberculosis, una infección producida por Mycobacterium tuberculosis. La Isoniazida es un profármaco y una vez que ha entrado en la bacteria, es activada por una peroxidasa, la cual oxida el compuesto en su forma de radical libre.[83] Este radical subsiguientemente reacciona con la NADH, para producir aductos que son inhibidores muy potentes de las enzimas enoil-ACP reductasas,[84] y dihidrofolato reductasa.[85]
Puesto que un gran número de oxidorreductasas utilizan NAD+
y NADH como sustratos, y se unen a ellas utilizando un motivo estructural altamente conservado, la idea de que inhibidores basados en NAD+
podrían ser específicos de una enzima es sorprendente.[86] No obstante, esto podría ser posible: por ejemplo, los inhibidores basados en los compuestos ácido micofenólico y tiazofurina inhiben la IMP deshidrogenasa en el lugar de unión de la NAD+
. Debido a la importancia de esta enzima en el metabolismo de las purinas, estos compuestos podrían ser útiles como fármacos anticancerígenos, antivirales o inmunosupresores.[86][87] Otros fármacos no son enzimas inhibidoras, sino que en lugar de ello activan enzimas implicadas en el metabolismo de la NAD+
. Las sirtuinas son un blanco particularmente interesante para estos fármacos, puesto que la activación de estas desacetilasas dependientes de NAD aumentan la longevidad.[88] Los compuestos tales como el resveratrol aumentan la actividad de estas enzimas, que pueden ser importantes dada su capacidad de retrasar el envejecimiento tanto en organismos modelo de vertebrados como de invertebrados.[89][90][91]
Debido a las diferencias en las rutas metabólicas de la biosíntesis de NAD+
entre organismos tan distintos como bacterias y humanos, esta área del metabolismo resulta prometedora para el desarrollo de nuevos antibióticos.[92][93] Por ejemplo, la enzima nicotinamidasa, que convierte la nicotinamida en ácido nicotínico, es un blanco para el diseño de fármacos, puesto que esta enzima está ausente en humanos, pero presente en hongos unicelulares y en bacterias.[44]
Referencias
[editar]- ↑
58-68-4 (NADH) Número CAS - ↑ Nowak, Claudia; Pick, André; Csepei, Lénárd‐István; Sieber, Volker (5 de octubre de 2017). «Characterization of Biomimetic Cofactors According to Stability, Redox Potentials, and Enzymatic Conversion by NADH Oxidase from Lactobacillus pentosus». ChemBioChem (en inglés) 18 (19): 1944-1949. ISSN 1439-4227. doi:10.1002/cbic.201700258. Consultado el 22 de junio de 2024.
- ↑ «A Biomimetic Cofactor May Lead to Less Expensive Drug Manufacture». www2.lbl.gov. Consultado el 22 de junio de 2024.
- ↑ Harden, A; Young, WJ (Octubre de 1906). «The Alcoholic Ferment of Yeast-Juice». Proceedings of the Royal Society of London (Series B, Containing Papers of a Biological Character edición) 78 (526): 369-375.
- ↑ «Fermentation of sugars and fermentative enzymes» (PDF). Nobel Lecture, 23 de mayo de 1930. Nobel Foundation. Consultado el 30 de septiembre de 2007.
- ↑ Warburg O, Christian W. (1936). «Pyridin, the hydrogen-transferring component of the fermentation enzymes (pyridine nucleotide)». Biochemische Zeitschrift 287: 291.
- ↑ Elvehjem CA, Madden RJ, Strong FM, Woolley DW. (1938). «The isolation and identification of the anti-black tongue factor» (PDF). J. Biol. Chem. 123 (1): 137-49. Archivado desde el original el 26 de marzo de 2009. Consultado el 31 de octubre de 2010.
- ↑ Axelrod AE, Madden RJ, Elvehjem CA (1939). «The effect of a nicotinic acid deficiency upon the coenzyme I content of animal tissues» (PDF). J. Biol. Chem. 131 (1): 85-93. Archivado desde el original el 26 de marzo de 2009. Consultado el 31 de octubre de 2010.
- ↑ Kornberg, A. (1948). «The participation of inorganic pyrophosphate in the reversible enzymatic synthesis of diphosphopyridine nucleotide» (PDF). J. Biol. Chem. 176 (3): 1475-76. Archivado desde el original el 26 de marzo de 2009. Consultado el 31 de octubre de 2010.
- ↑ Friedkin M, Lehninger AL. (1 de abril de 1949). «Esterification of inorganic phosphate coupled to electron transport between dihydrodiphosphopyridine nucleotide and oxygen». J. Biol. Chem. 178 (2): 611-23.
- ↑ Preiss J, Handler P. (1 de agosto de 1958). «Biosynthesis of diphosphopyridine nucleotide. I. Identification of intermediates». J. Biol. Chem. 233 (2): 488-92. PMID 13563526. Archivado desde el original el 14 de diciembre de 2007. Consultado el 31 de octubre de 2010.
- ↑ Preiss J, Handler P. (1 de agosto de 1958). «Biosynthesis of diphosphopyridine nucleotide. II. Enzymatic aspects». J. Biol. Chem. 233 (2): 493-500. PMID 13563527. Archivado desde el original el 13 de abril de 2020. Consultado el 31 de octubre de 2010.
- ↑ a b c Pollak, N; Dölle C, Ziegler M (2007). «The power to reduce: pyridine nucleotides—small molecules with a multitude of functions». Biochem. J. 402 (2): 205-18. PMC 1798440. PMID 17295611. doi:10.1042/BJ20061638.
- ↑ Chambon P, Weill JD, Mandel P (1963). «Nicotinamide mononucleotide activation of new DNA-dependent polyadenylic acid synthesizing nuclear enzyme». Biochem. Biophys. Res. Commun. 11: 39-43. PMID 14019961. doi:10.1016/0006-291X(63)90024-X.
- ↑ Clapper DL, Walseth TF, Dargie PJ, Lee HC (15 de julio de 1987). «Pyridine nucleotide metabolites stimulate calcium release from sea urchin egg microsomes desensitized to inositol trisphosphate». J. Biol. Chem. 262 (20): 9561-8. PMID 3496336. Archivado desde el original el 14 de diciembre de 2007. Consultado el 31 de octubre de 2010.
- ↑ Imai S, Armstrong CM, Kaeberlein M, Guarente L (2000). «Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase». Nature 403 (6771): 795-800. PMID 10693811. doi:10.1038/35001622.
- ↑ a b c d e f g Belenky P; Bogan KL; Brenner C (2007). «NAD+ metabolism in health and disease» (PDF). Trends Biochem. Sci. 32 (1): 12-9. PMID 17161604. doi:10.1016/j.tibs.2006.11.006. Archivado desde el original el 4 de julio de 2009. Consultado el 23 de diciembre de 2007.
- ↑ Unden G; Bongaerts J (1997). «Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors». Biochim. Biophys. Acta 1320 (3): 217-34. PMID 9230919. doi:10.1016/S0005-2728(97)00034-0.
- ↑ Windholz, Martha (1983). The Merck Index: an encyclopedia of chemicals, drugs, and biologicals (10th edición). Rahway NJ, US: Merck. p. 909. ISBN 911910271
|isbn=incorrecto (ayuda). - ↑ Biellmann JF, Lapinte C, Haid E, Weimann G (1979). «Structure of lactate dehydrogenase inhibitor generated from coenzyme». Biochemistry 18 (7): 1212-7. PMID 218616. doi:10.1021/bi00574a015.
- ↑ a b Dawson, R. Ben (1985). Data for biochemical research (3rd edición). Oxford: Clarendon Press. p. 122. ISBN 0-19-855358-7.
- ↑ a b Lakowicz JR, Szmacinski H, Nowaczyk K, Johnson ML (1992). «Fluorescence lifetime imaging of free and protein-bound NADH». Proc. Natl. Acad. Sci. U.S.A. 89 (4): 1271-5. PMC 48431. PMID 1741380. doi:10.1073/pnas.89.4.1271.
- ↑ Jameson DM, Thomas V, Zhou DM (1989). «Time-resolved fluorescence studies on NADH bound to mitochondrial malate dehydrogenase». Biochim. Biophys. Acta 994 (2): 187-90. PMID 2910350.
- ↑ Kasimova MR, Grigiene J, Krab K, et al. (2006). «The free NADH concentration is kept constant in plant mitochondria under different metabolic conditions». Plant Cell 18 (3): 688-98. PMC 1383643. PMID 16461578. doi:10.1105/tpc.105.039354.
- ↑ Reiss PD, Zuurendonk PF, Veech RL (1984). «Measurement of tissue purine, pyrimidine, and other nucleotides by radial compression high-performance liquid chromatography». Anal. Biochem. 140 (1): 162-71. PMID 6486402. doi:10.1016/0003-2697(84)90148-9.
- ↑ Yamada K, Hara N, Shibata T, Osago H, Tsuchiya M (2006). «The simultaneous measurement of nicotinamide adenine dinucleotide and related compounds by liquid chromatography/electrospray ionization tandem mass spectrometry». Anal. Biochem. 352 (2): 282-5. PMID 16574057. doi:10.1016/j.ab.2006.02.017.
- ↑ a b Yang H, Yang T, Baur JA, Perez E, Matsui T, Carmona JJ, Lamming DW, Souza-Pinto NC, Bohr VA, Rosenzweig A, de Cabo R, Sauve AA, Sinclair DA. (2007). «Nutrient-Sensitive Mitochondrial NAD+ Levels Dictate Cell Survival». Cell 130 (6): 1095-107. PMID 17889652. doi:10.1016/j.cell.2007.07.035.
- ↑ Blinova K, Carroll S, Bose S, et al. (2005). «Distribution of mitochondrial NADH fluorescence lifetimes: steady-state kinetics of matrix NADH interactions». Biochemistry 44 (7): 2585-94. PMID 15709771. doi:10.1021/bi0485124.
- ↑ Todisco S, Agrimi G, Castegna A, Palmieri F (2006). «Identification of the mitochondrial NAD+ transporter in Saccharomyces cerevisiae». J. Biol. Chem. 281 (3): 1524-31. PMID 16291748. doi:10.1074/jbc.M510425200. Archivado desde el original el 13 de abril de 2020. Consultado el 18 de octubre de 2010.
- ↑ Schafer F, Buettner G (2001). «Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple». Free Radic Biol Med 30 (11): 1191-212. PMID 11368918. doi:10.1016/S0891-5849(01)00480-4.
- ↑ Williamson DH, Lund P, Krebs HA (1967). «The redox state of free nicotinamide-adenine dinucleotide in the cytoplasm and mitochondria of rat liver». Biochem. J. 103 (2): 514-27. PMC 1270436. PMID 4291787.
- ↑ Zhang Q, Piston DW, Goodman RH (2002). «Regulation of corepressor function by nuclear NADH». Science 295 (5561): 1895-7. PMID 11847309. doi:10.1126/science.1069300.
- ↑ Lin SJ, Guarente L (abril de 2003). «Nicotinamide adenine dinucleotide, a metabolic regulator of transcription, longevity and disease». Curr. Opin. Cell Biol. 15 (2): 241-6. PMID 12648681. doi:10.1016/S0955-0674(03)00006-1.
- ↑ Veech RL, Eggleston LV, Krebs HA (1969). «The redox state of free nicotinamide-adenine dinucleotide phosphate in the cytoplasm of rat liver». Biochem. J. 115 (4): 609-19. PMC 1185185. PMID 4391039.
- ↑ Katoh A, Uenohara K, Akita M, Hashimoto T (2006). «Early steps in the biosynthesis of NAD in Arabidopsis start with aspartate and occur in the plastid». Plant Physiol. 141 (3): 851-7. PMC 1489895. PMID 16698895. doi:10.1104/pp.106.081091.
- ↑ Foster JW, Moat AG (1 de marzo de 1980). «Nicotinamide adenine dinucleotide biosynthesis and pyridine nucleotide cycle metabolism in microbial systems». Microbiol. Rev. 44 (1): 83-105. PMC 373235. PMID 6997723.
- ↑ Magni G, Orsomando G, Raffaelli N (2006). «Structural and functional properties of NAD kinase, a key enzyme in NADP biosynthesis». Mini reviews in medicinal chemistry 6 (7): 739-46. PMID 16842123. doi:10.2174/138955706777698688.
- ↑ Sakuraba H, Kawakami R, Ohshima T (2005). «First archaeal inorganic polyphosphate/ATP-dependent NAD kinase, from hyperthermophilic archaeon Pyrococcus horikoshii: cloning, expression, and characterization». Appl. Environ. Microbiol. 71 (8): 4352-8. PMC 1183369. PMID 16085824. doi:10.1128/AEM.71.8.4352-4358.2005.
- ↑ Raffaelli N, Finaurini L, Mazzola F, et al. (2004). «Characterization of Mycobacterium tuberculosis NAD kinase: functional analysis of the full-length enzyme by site-directed mutagenesis». Biochemistry 43 (23): 7610-7. PMID 15182203. doi:10.1021/bi049650w.
- ↑ Tempel W, Rabeh WM, Bogan KL, et al. (2007). «Nicotinamide riboside kinase structures reveal new pathways to NAD+». PLoS Biol. 5 (10): e263. PMC 1994991. PMID 17914902. doi:10.1371/journal.pbio.0050263.
- ↑ Anderson RM, Bitterman KJ, Wood JG, et al. (2002). «Manipulation of a nuclear NAD+ salvage pathway delays aging without altering steady-state NAD+ levels». J. Biol. Chem. 277 (21): 18881-90. PMID 11884393. doi:10.1074/jbc.M111773200. Archivado desde el original el 13 de abril de 2020. Consultado el 20 de octubre de 2010.
- ↑ Billington RA, Travelli C, Ercolano E, et al. (2008). «Characterization of NAD Uptake in Mammalian Cells». J. Biol. Chem. 283 (10): 6367-74. PMID 18180302. doi:10.1074/jbc.M706204200. Archivado desde el original el 28 de mayo de 2020. Consultado el 20 de octubre de 2010.
- ↑ Henderson LM (1983). «Niacin». Annu. Rev. Nutr. 3: 289-307. PMID 6357238. doi:10.1146/annurev.nu.03.070183.001445.
- ↑ a b Rongvaux A, Andris F, Van Gool F, Leo O (2003). «Reconstructing eukaryotic NAD metabolism». Bioessays 25 (7): 683-90. PMID 12815723. doi:10.1002/bies.10297.
- ↑ Ma B, Pan SJ, Zupancic ML, Cormack BP (2007). «Assimilation of NAD(+) precursors in Candida glabrata». Mol. Microbiol. 66 (1): 14-25. PMID 17725566. doi:10.1111/j.1365-2958.2007.05886.x.
- ↑ Reidl J, Schlör S, Kraiss A, Schmidt-Brauns J, Kemmer G, Soleva E (2000). «NADP and NAD utilization in Haemophilus influenzae». Mol. Microbiol. 35 (6): 1573-81. PMID 10760156. doi:10.1046/j.1365-2958.2000.01829.x.
- ↑ Gerdes SY, Scholle MD, D'Souza M, et al. (2002). «From genetic footprinting to antimicrobial drug targets: examples in cofactor biosynthetic pathways». J. Bacteriol. 184 (16): 4555-72. PMC 135229. PMID 12142426. doi:10.1128/JB.184.16.4555-4572.2002.
- ↑ Senkovich O, Speed H, Grigorian A, et al. (2005). «Crystallization of three key glycolytic enzymes of the opportunistic pathogen Cryptosporidium parvum». Biochim. Biophys. Acta 1750 (2): 166-72. PMID 15953771. doi:10.1016/j.bbapap.2005.04.009.
- ↑ «Enzyme Nomenclature, Recommendations for enzyme names from the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology». Archivado desde el original el 5 de diciembre de 2007. Consultado el 6 de diciembre de 2007.
- ↑ «NiceZyme View of ENZYME: EC 1.6.5.3». Expasy. Archivado desde el original el 19 de diciembre de 2007. Consultado el 16 de diciembre de 2007.
- ↑ Lesk AM (1995). «NAD-binding domains of dehydrogenases». Curr. Opin. Struct. Biol. 5 (6): 775-83. PMID 8749365. doi:10.1016/0959-440X(95)80010-7.
- ↑ a b Rao S, Rossmann M (1973). «Comparison of super-secondary structures in proteins». J Mol Biol 76 (2): 241-56. PMID 4737475. doi:10.1016/0022-2836(73)90388-4.
- ↑ Goto M, Muramatsu H, Mihara H, et al. (2005). «Crystal structures of Delta1-piperideine-2-carboxylate/Delta1-pyrroline-2-carboxylate reductase belonging to a new family of NAD(P)H-dependent oxidoreductases: conformational change, substrate recognition, and stereochemistry of the reaction». J. Biol. Chem. 280 (49): 40875-84. PMID 16192274. doi:10.1074/jbc.M507399200. Archivado desde el original el 11 de junio de 2008. Consultado el 28 de octubre de 2010.
- ↑ Bellamacina CR (1 de septiembre de 1996). «The nicotinamide dinucleotide binding motif: a comparison of nucleotide binding proteins». FASEB J. 10 (11): 1257-69. PMID 8836039.
- ↑ Carugo O, Argos P (1997). «NADP-dependent enzymes. I: Conserved stereochemistry of cofactor binding». Proteins 28 (1): 10-28. PMID 9144787. doi:10.1002/(SICI)1097-0134(199705)28:1<10::AID-PROT2>3.0.CO;2-N.
- ↑ Vickers TJ, Orsomando G, de la Garza RD, et al. (2006). «Biochemical and genetic analysis of methylenetetrahydrofolate reductase in Leishmania metabolism and virulence». J. Biol. Chem. 281 (50): 38150-8. PMID 17032644. doi:10.1074/jbc.M608387200. Archivado desde el original el 13 de octubre de 2008. Consultado el 28 de octubre de 2010.
- ↑ Bakker BM, Overkamp KM, van Maris AJ, et al. (2001). «Stoichiometry and compartmentation of NADH metabolism in Saccharomyces cerevisiae». FEMS Microbiol. Rev. 25 (1): 15-37. PMID 11152939. doi:10.1111/j.1574-6976.2001.tb00570.x.
- ↑ Rich PR (2003). «The molecular machinery of Keilin's respiratory chain». Biochem. Soc. Trans. 31 (Pt 6): 1095-105. PMID 14641005. doi:10.1042/BST0311095.
- ↑ Heineke D, Riens B, Grosse H, et al. (1991). «Redox Transfer across the Inner Chloroplast Envelope Membrane». Plant Physiol 95 (4): 1131-1137. PMC 1077662. PMID 16668101. doi:10.1104/pp.95.4.1131.
- ↑ Nicholls DG; Ferguson SJ (2002). Bioenergetics 3 (1st edición). Academic Press. ISBN 0-125-18121-3.
- ↑ Sistare FD, Haynes RC (15 de octubre de 1985). «The interaction between the cytosolic pyridine nucleotide redox potential and gluconeogenesis from lactate/pyruvate in isolated rat hepatocytes. Implications for investigations of hormone action». J. Biol. Chem. 260 (23): 12748-53. PMID 4044607. Archivado desde el original el 12 de abril de 2008. Consultado el 28 de octubre de 2010.
- ↑ Freitag A, Bock E (1990). «Energy conservation in Nitrobacter». FEMS Microbiology Letters 66 (1–3): 157-62. doi:10.1111/j.1574-6968.1990.tb03989.x.
- ↑ Starkenburg SR, Chain PS, Sayavedra-Soto LA, et al. (2006). «Genome sequence of the chemolithoautotrophic nitrite-oxidizing bacterium Nitrobacter winogradskyi Nb-255». Appl. Environ. Microbiol. 72 (3): 2050-63. PMC 1393235. PMID 16517654. doi:10.1128/AEM.72.3.2050-2063.2006.
- ↑ Ziegler M (2000). «New functions of a long-known molecule. Emerging roles of NAD in cellular signaling». Eur. J. Biochem. 267 (6): 1550-64. PMID 10712584. doi:10.1046/j.1432-1327.2000.01187.x.
- ↑ Chen, Y Grace; Walter E Kowtoniuk, Isha Agarwal, Yinghua Shen, David R Liu (diciembre de 2009). «LC/MS analysis of cellular RNA reveals NAD-linked RNA». Nat Chem Biol 5 (12): 879-881. PMC 2842606. PMID 19820715. doi:10.1038/nchembio.235.
- ↑ a b Diefenbach J, Bürkle A (2005). «Introduction to poly(ADP-ribose) metabolism». Cell. Mol. Life Sci. 62 (7–8): 721-30. PMID 15868397. doi:10.1007/s00018-004-4503-3.
- ↑ Berger F, Ramírez-Hernández MH, Ziegler M (2004). «The new life of a centenarian: signaling functions of NAD(P)». Trends Biochem. Sci. 29 (3): 111-8. PMID 15003268. doi:10.1016/j.tibs.2004.01.007.
- ↑ Corda D, Di Girolamo M (2003). «Functional aspects of protein mono-ADP-ribosylation». EMBO J. 22 (9): 1953-8. PMC 156081. PMID 12727863. doi:10.1093/emboj/cdg209.
- ↑ a b Burkle A (2005). «Poly(ADP-ribose). The most elaborate metabolite of NAD+
». FEBS J. 272 (18): 4576-89. PMID 16156780. doi:10.1111/j.1742-4658.2005.04864.x. - ↑ Seman M, Adriouch S, Haag F, Koch-Nolte F (2004). «Ecto-ADP-ribosyltransferases (ARTs): emerging actors in cell communication and signaling». Curr. Med. Chem. 11 (7): 857-72. PMID 15078170. doi:10.2174/0929867043455611.
- ↑ Guse AH (2004). «Biochemistry, biology, and pharmacology of cyclic adenosine diphosphoribose (cADPR)». Curr. Med. Chem. 11 (7): 847-55. PMID 15078169. doi:10.2174/0929867043455602.
- ↑ Guse AH (2004). «Regulation of calcium signaling by the second messenger cyclic adenosine diphosphoribose (cADPR)». Curr. Mol. Med. 4 (3): 239-48. PMID 15101682. doi:10.2174/1566524043360771.
- ↑ Guse AH (2005). «Second messenger function and the structure-activity relationship of cyclic adenosine diphosphoribose (cADPR)». FEBS J. 272 (18): 4590-7. PMID 16156781. doi:10.1111/j.1742-4658.2005.04863.x.
- ↑ North B, Verdin E (2004). «Sirtuins: Sir2-related NAD-dependent protein deacetylases». Genome Biol 5 (5): 224. PMC 416462. PMID 15128440. doi:10.1186/gb-2004-5-5-224.
- ↑ Blander G, Guarente L (2004). «The Sir2 family of protein deacetylases». Annu. Rev. Biochem. 73: 417-35. PMID 15189148. doi:10.1146/annurev.biochem.73.011303.073651.
- ↑ Trapp J, Jung M (2006). «The role of NAD+ dependent histone deacetylases (sirtuins) in ageing». Curr Drug Targets 7 (11): 1553-60. PMID 17100594.
- ↑ Wilkinson A, Day J, Bowater R (2001). «Bacterial DNA ligases». Mol. Microbiol. 40 (6): 1241-8. PMID 11442824. doi:10.1046/j.1365-2958.2001.02479.x.
- ↑ Schär P, Herrmann G, Daly G, Lindahl T (1997). «A newly identified DNA ligase of Saccharomyces cerevisiae involved in RAD52-independent repair of DNA double-strand breaks». Genes and Development 11 (15): 1912-24. PMC 316416. PMID 9271115. doi:10.1101/gad.11.15.1912.
- ↑ Sauve AA (March de 2008). «NAD+ and vitamin B3: from metabolism to therapies». The Journal of pharmacology and experimental therapeutics 324 (3): 883-93. PMID 18165311. doi:10.1124/jpet.107.120758.
- ↑ Khan JA, Forouhar F, Tao X, Tong L (2007). «Nicotinamide adenine dinucleotide metabolism as an attractive target for drug discovery». Expert Opin. Ther. Targets 11 (5): 695-705. PMID 17465726. doi:10.1517/14728222.11.5.695.
- ↑ Kaneko S, Wang J, Kaneko M, et al. (2006). «Protecting axonal degeneration by increasing nicotinamide adenine dinucleotide levels in experimental autoimmune encephalomyelitis models». J. Neurosci. 26 (38): 9794-804. PMID 16988050. doi:10.1523/JNEUROSCI.2116-06.2006.
- ↑ Swerdlow RH (1998). «Is NADH effective in the treatment of Parkinson's disease?». Drugs Aging 13 (4): 263-8. PMID 9805207. doi:10.2165/00002512-199813040-00002.
- ↑ Timmins GS, Deretic V (2006). «Mechanisms of action of isoniazid». Mol. Microbiol. 62 (5): 1220-7. PMID 17074073. doi:10.1111/j.1365-2958.2006.05467.x. Archivado desde el original el 22 de diciembre de 2007. Consultado el 21 de noviembre de 2010.
- ↑ Rawat R, Whitty A, Tonge PJ (2003). «The isoniazid-NAD adduct is a slow, tight-binding inhibitor of InhA, the Mycobacterium tuberculosis enoyl reductase: adduct affinity and drug resistance». Proc. Natl. Acad. Sci. U.S.A. 100 (24): 13881-6. PMC 283515. PMID 14623976. doi:10.1073/pnas.2235848100.
- ↑ Argyrou A, Vetting MW, Aladegbami B, Blanchard JS (2006). «Mycobacterium tuberculosis dihydrofolate reductase is a target for isoniazid». Nat. Struct. Mol. Biol. 13 (5): 408-13. PMID 16648861. doi:10.1038/nsmb1089.
- ↑ a b Pankiewicz KW, Patterson SE, Black PL, et al. (2004). «Cofactor mimics as selective inhibitors of NAD-dependent inosine monophosphate dehydrogenase (IMPDH)—the major therapeutic target». Curr. Med. Chem. 11 (7): 887-900. PMID 15083807. doi:10.2174/0929867043455648.
- ↑ Franchetti P, Grifantini M (1999). «Nucleoside and non-nucleoside IMP dehydrogenase inhibitors as antitumor and antiviral agents». Curr. Med. Chem. 6 (7): 599-614. PMID 10390603.
- ↑ Kim EJ, Um SJ (2008). «SIRT1: roles in aging and cancer». BMB Rep 41 (11): 751-6. PMID 19017485.
- ↑ Valenzano DR, Terzibasi E, Genade T, Cattaneo A, Domenici L, Cellerino A (2006). «Resveratrol prolongs lifespan and retards the onset of age-related markers in a short-lived vertebrate». Curr. Biol. 16 (3): 296-300. PMID 16461283. doi:10.1016/j.cub.2005.12.038.
- ↑ Howitz KT, Bitterman KJ, Cohen HY, et al. (2003). «Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan». Nature 425 (6954): 191-6. PMID 12939617. doi:10.1038/nature01960.
- ↑ Wood JG, Rogina B, Lavu S, et al. (2004). «Sirtuin activators mimic caloric restriction and delay ageing in metazoans». Nature 430 (7000): 686-9. PMID 15254550. doi:10.1038/nature02789.
- ↑ Rizzi M, Schindelin H (2002). «Structural biology of enzymes involved in NAD and molybdenum cofactor biosynthesis». Curr. Opin. Struct. Biol. 12 (6): 709-20. PMID 12504674. doi:10.1016/S0959-440X(02)00385-8.
- ↑ Begley TP, Kinsland C, Mehl RA, Osterman A, Dorrestein P (2001). «The biosynthesis of nicotinamide adenine dinucleotides in bacteria». Vitam. Horm. 61: 103-19. PMID 11153263. doi:10.1016/S0083-6729(01)61003-3.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Nicotinamida adenina dinucleótido.
Wikimedia Commons alberga una categoría multimedia sobre Nicotinamida adenina dinucleótido.
