Recombinación genética

La recombinación genética es el proceso por el cual una hebra de material genético (usualmente ADN, pero también puede ser ARN) se corta y luego se une a una molécula de material genético diferente. En eucariotas la recombinación comúnmente se produce durante la meiosis de la reproducción sexual[3] (el proceso mediante el cual los eucariotas generan gametos), como entrecruzamiento cromosómico entre los cromosomas apareados. Este proceso conduce a que la progenie tenga combinaciones de genes diferentes a las de sus padres y puede producir alelos quiméricos. En biología evolutiva se cree que esta mezcla de genes tiene varias ventajas, incluyendo que permite a los organismos que se reproducen sexualmente y evitar el trinquete de Muller. En los vertebrados también hay un tipo de recombinación genética especial en las células B y T del sistema inmune, llamada recombinación V(D)J, que es la responsable de generar la tremenda variabilidad de anticuerpos y de receptores de células T necesaria para la respuesta inmune. La recombinación específica de sitio es un tipo especial de recombinación homóloga que ocurre en regiones específicas, cortas y homólogas, existentes en ambos fragmentos a recombinar. Suele ser típica de virus, los cuales la utilizan para integrarse en el genoma del hospedador.[4]
En biología molecular, "recombinación" también se refiere a la recombinación artificial y deliberada de piezas de ADN distintas, a menudo de diferentes organismos, creando lo que se llama ADN recombinante.[5]
Tipos de recombinación genética
[editar]Existen varios tipos de recombinación genética en las [[célula]]s eucariotas:
Recombinación homóloga
[editar]La recombinación homóloga (también llamada recombinación general) sucede durante la profase I de la meiosis y tiene lugar entre las largas regiones de ADN cuyas secuencias son homólogas, es decir altamente similares aunque no idénticas.[5]
Entrecruzamiento cromosómico
[editar]Se denomina así a la recombinación entre los cromosomas apareados, generalmente durante la meiosis. Durante la profase I, en la sub-fase de paquitene, las cuatro cromátidas disponibles están estrechamente posicionadas una con respecto a la otra. En esta disposición los sitios homólogos en las dos cromátidas pueden coincidir entre sí, y pueden intercambiar información genética.[6]
Como la recombinación puede producirse en cualquier lugar del cromosoma, la frecuencia de recombinación entre dos puntos depende de la distancia entre ambos. Por lo tanto, para genes suficientemente distantes en el mismo cromosoma la frecuencia de recombinación es lo suficientemente alta para destruir la correlación entre alelos recombinantes.[7]
En células B
[editar]Las células B del sistema inmunitario realizan una recombinación genética llamada cambio de clase de inmunoglobulinas. Es un mecanismo biológico que cambia un anticuerpo de una clase a otra, por ejemplo, de un isotipo llamado IgM a otro llamado IgG.[8]

Conversión génica
[editar]En la conversión génica, una sección de material genético se copia de un cromosoma a otro, pero deja el cromosoma donante sin cambios.[5]
Recombinación no homóloga
[editar]La recombinación puede ocurrir entre secuencias de ADN que no contienen secuencias homólogas. Esto se conoce como recombinación no homóloga. Acontece raramente en procariotas y levaduras, pero es más frecuente en células de mamíferos.[5]
Recombinación específica de sitio
[editar]Este otro tipo de recombinación tiene lugar por rotura y posterior unión de regiones de homología corta y específica de dos ADN diferentes, o dentro de la misma molécula. Ocurre en virus (por ejemplo, el bacteriófago T4) y en plásmidos.[10]
Mecanismo
[editar]La recombinación genética es catalizada por varias enzimas. Las recombinasas son las enzimas clave que catalizan la etapa de transferencia de la hebra durante la recombinación. La RecA (recombinasa encontrada en Escherichia coli) es responsable de la reparación de las roturas de cadena doble en el ADN. En levaduras y otros organismos eucariotas es necesario utilizar dos recombinasas para la reparación de las roturas de cadena doble en el ADN. La proteína RAD51 es necesaria para la recombinación mitótica y meiótica, mientras que la proteína de reparación del ADN, DMC1, es específica para la recombinación meiótica. En las arqueas, el ortólogo de la proteína bacteriana RecA es la RadA.[11]
Ingeniería genética
[editar]En la ingeniería genética, la recombinación también puede referirse a la recombinación artificial y deliberada de fragmentos de ADN, a menudo de diferentes organismos, creando lo que se llama ADN recombinante. Un ejemplo de recombinación genética es el gene targeting, que puede usarse para añadir, eliminar o cambiar los genes de un organismo. Esta técnica es importante para los investigadores biomédicos, ya que les permite estudiar los efectos de genes específicos. Técnicas basadas en recombinación genética también se aplican en la ingeniería de proteínas para desarrollar nuevas proteínas de interés biológico.[3]
Recombinación meiótica
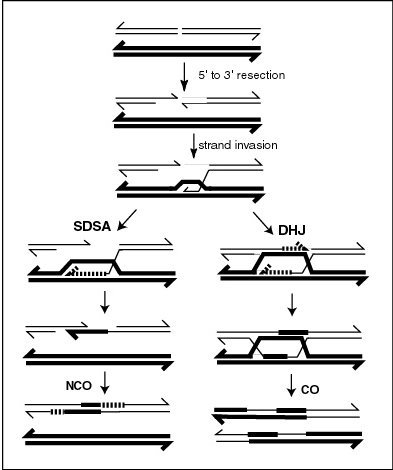
[editar]Los modelos moleculares de recombinación meiótica han evolucionado a lo largo de los años proporcionando así una gran cantidad de evidencia. La comprensión fundamental del mecanismo de la recombinación meiótica es crucial para resolver el problema de la función adaptativa del sexo, una cuestión que no ha sido resuelta en la biología. Un modelo que refleja la comprensión actual fue presentado por Anderson y Sekelsky[12] y se describe en la primera figura de este artículo. La figura muestra que dos de las cuatro cromátidas presentes en la meiosis (profase I) están emparejadas entre sí y son capaces de interactuar. La recombinación, en esta versión del modelo, se inicia por una ruptura de doble cadena que se muestra en la molécula de ADN (cromátida). Sin embargo, otros tipos de daño del ADN también pueden iniciar la recombinación. Por ejemplo, una reticulación entre hebras (causada por la exposición a un agente reticulante tal como mitomicina C) puede ser reparada por HRR.[11]
Como se indica en la primera figura, arriba, se producen dos tipos de producto recombinante. En el lado derecho se encuentra un tipo "cross over" (CO), donde se intercambian las cromátidas de los cromosomas homólogos y en el lado izquierdo, un tipo "no crossover" (NCO) donde las cromátidas no se intercambian. El tipo de recombinación de CO implica la formación intermedia de dos "Holliday Junction" indicadas en la parte inferior derecha de la figura por dos estructuras en forma de X en cada una de las cuales hay un intercambio de hebras individuales entre las dos cromátidas participantes. Esta vía está etiquetada en la figura como la vía Double Holliday Junction (DHJ).[12]
Los recombinantes NCO (ilustrados a la izquierda en la figura) se producen mediante un proceso denominado Synthesis-dependent strand annealing (SDSA). Los eventos de recombinación del tipo NCO / SDSA parecen ser más comunes que el tipo CO / DHJ.[11] La vía de NCO / SDSA contribuye poco a la variación genética ya que los brazos de los cromosomas que flanquean el evento de recombinación permanecen en la configuración parental. Por lo tanto, las explicaciones de la función adaptativa de la meiosis que se centran exclusivamente en el cross over son inadecuados para explicar la mayoría de los eventos de recombinación.[11]
Reparación recombinante
[editar]La reparación recombinante requiere la presencia de una secuencia idéntica o casi idéntica que sea utilizada como plantilla para reparar la rotura. La maquinaria enzimática responsable de este proceso es casi idéntica a la maquinaria responsable del cruce cromosómico durante la meiosis. Esta ruta permite que un cromosoma dañado sea reparado utilizando una cromátida hermana (disponible en G2 después de la replicación del ADN) o un cromosoma homólogo como plantilla.[13]
Durante la mitosis y la meiosis, los daños del ADN causados por una variedad de agentes exógenos (por ejemplo, luz UV, rayos X, agentes reticulantes químicos) pueden repararse mediante reparación recombinante homóloga (HRR del inglés Homologous Recombinational Repair). Estos hallazgos sugieren que los daños del ADN que surgen de procesos naturales, como la exposición a especies reactivas del oxígeno (ROS) que son subproductos del metabolismo normal, también son reparados por HRR. En humanos y roedores, problema en los genes necesarios para HRR durante la meiosis causan infertilidad.[11] Mientras que en los seres humanos problema en los genes como BRCA1 y BRCA2, aumentan el riesgo de cáncer.[13]
En las bacterias, la transformación es un proceso de transferencia génica que ocurre normalmente entre células individuales de la misma especie bacteriana. La transformación implica la integración del ADN del donante en el cromosoma receptor mediante recombinación. Este proceso parece ser una adaptación para la reparación de daños en el DNA del cromosoma receptor por HRR.[13] La transformación puede proporcionar un beneficio a las bacterias patógenas al permitir la reparación del daño del ADN.
Cuando dos o más virus, cada uno de ellos con daños genómicos letales infectan a la misma célula huésped, los genomas del virus a menudo pueden emparejarse entre sí y son reparados mediante HRR para poder producir una progenie viable. Este proceso denominado reactivación de multiplicidad ha sido estudiado en bacteriófagos T4 y lambda,[14] así como en varios virus patógenos. En el caso de los virus patógenos, la reactivación de la multiplicidad puede ser un beneficio adaptativo para el virus, ya que permite la reparación de los daños del ADN causados por la exposición al medio oxidante producido durante la infección del huésped.[13]
Referencias
[editar]- ↑ Andersen, Sabrina L.; Sekelsky, Jeff (11 de diciembre de 2016). «Meiotic versus Mitotic Recombination: Two Different Routes for Double-Strand Break Repair». BioEssays : news and reviews in molecular, cellular and developmental biology 32 (12): 1058-1066. ISSN 0265-9247. PMC 3090628. PMID 20967781. doi:10.1002/bies.201000087. Consultado el 11 de diciembre de 2016.
- ↑ Bernstein, Harris; Bernstein, Carol; E., Richard (1 de enero de 2011). Meiosis as an Evolutionary Adaptation for DNA Repair (en inglés). InTech. doi:10.5772/25117. Consultado el 11 de diciembre de 2016.
- ↑ a b Sexualidad y recombinación genética
- ↑ «Recombinación - Medicina molecular». medmol.es. Archivado desde el original el 28 de noviembre de 2016. Consultado el 4 de diciembre de 2016.
- ↑ a b c d Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (1 de enero de 2000). Molecular Cell Biology (4th edición). W. H. Freeman. ISBN 0716731363. Consultado el 11 de diciembre de 2016.
- ↑ Creighton, H. B.; McClintock, B. (1 de agosto de 1931). «A Correlation of Cytological and Genetical Crossing-Over in Zea Mays». Proceedings of the National Academy of Sciences of the United States of America 17 (8): 492-497. ISSN 0027-8424. PMC 1076098. PMID 16587654. Consultado el 11 de diciembre de 2016.
- ↑ Li, Xuan; Heyer, Wolf-Dietrich (1 de enero de 2008). «Homologous recombination in DNA repair and DNA damage tolerance». Cell Research 18 (1): 99-113. ISSN 1748-7838. PMC 3087377. PMID 18166982. doi:10.1038/cr.2008.1. Consultado el 11 de diciembre de 2016.
- ↑ «Immunobiology: The Immune System in Health and Disease by Charles A. Janeway: Churchill Livingstone 9780443073106 - Anybook Ltd.». www.abebooks.com. Consultado el 11 de diciembre de 2016.
- ↑ Morgan, Thomas Hunt; Louis Clark Vanuxem Foundation (1 de enero de 1916). A critique of the theory of evolution. Princeton, Princeton University Press; [etc., etc.] Consultado el 11 de diciembre de 2016.
- ↑ Miller, Eric S.; Kutter, Elizabeth; Mosig, Gisela; Arisaka, Fumio; Kunisawa, Takashi; Rüger, Wolfgang (1 de marzo de 2003). «Bacteriophage T4 genome». Microbiology and molecular biology reviews: MMBR 67 (1): 86-156, table of contents. ISSN 1092-2172. PMC 150520. PMID 12626685. doi:10.1128/MMBR.67.1.86-156.2003. Consultado el 11 de diciembre de 2016.
- ↑ a b c d e Bernstein, Harris; Bernstein, Carol; E., Richard (1 de enero de 2011). Meiosis as an Evolutionary Adaptation for DNA Repair (en inglés). InTech. doi:10.5772/25117. Consultado el 1 de diciembre de 2016.
- ↑ a b Andersen, Sabrina L.; Sekelsky, Jeff (5 de diciembre de 2016). «Meiotic versus Mitotic Recombination: Two Different Routes for Double-Strand Break Repair». BioEssays : news and reviews in molecular, cellular and developmental biology 32 (12): 1058-1066. ISSN 0265-9247. PMC 3090628. PMID 20967781. doi:10.1002/bies.201000087. Consultado el 5 de diciembre de 2016.
- ↑ a b c d Michod, Richard E. (16 de enero de 2008). «Adaptive value of sex in microbial pathogens». ELSEVIER. PMID 18295550. doi:10.1016/j.meegid.2008.01.002. Archivado desde el original el 30 de diciembre de 2016. Consultado el 30 de noviembre de 2016.
- ↑ Bernstein, C (1 de marzo de 1981). «Deoxyribonucleic acid repair in bacteriophage.». Microbiological Reviews 45 (1): 72-98. ISSN 0146-0749. PMC 281499. PMID 6261109. Consultado el 1 de diciembre de 2016.
Véase también
[editar]- Intercambio de Cassette Recombinasa Mediada
- Evolución del sexo
- Transferencia horizontal de genes
- Transposón