Silicato (mineral)

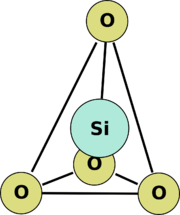
base de los silicatos
Los silicatos son el grupo de minerales de mayor abundancia, pues constituyen el 95 % de la corteza terrestre, además del grupo de más importancia geológica por ser petrogénicos, es decir, los minerales que forman las rocas. Todos los silicatos están compuestos por silicio y oxígeno. Estos elementos pueden estar acompañados de otros entre los que destacan aluminio, hierro, magnesio o calcio. Los silicatos forman parte de la mayoría de las rocas, arenas y arcillas. También se puede obtener vidrio a partir de muchos silicatos
Químicamente son sales del ácido silícico. Los silicatos, así como los aluminosilicatos —en los que un átomo de silicio es sustituido por uno de aluminio—, son la base de numerosos minerales que tienen al tetraedro de silicio-oxígeno (un átomo de silicio coordinado tetraédricamente a cuatro átomos de oxígeno) como su estructura básica: feldespatos, micas, arcillas. En situaciones de muy altas presiones, el silicio estará coordinado seis veces, o en coordinación octaédrica, como en la estructura de perovskita o en el cuarzo polimorfo stishovita (SiO2). (En el último caso, el mineral ya no tiene una estructura de silicato, sino de rutilo (TiO
2) y su grupo asociado, que son óxidos simples.)
Los silicatos forman materiales basados en la repetición de la unidad tetraédrica [SiO4]4−
. El anión [SiO4]4−
tiene cuatro cargas negativas que generalmente son compensadas por la presencia de iones de metales alcalinos o alcalinotérreos, así como de otros metales como el aluminio. Es común que el Si4+
sea sustituido por Al3+
debido a la similitud en radio iónico y en carga; en otros casos, los tetraedros de [AlO
4]5−
forman las mismas estructuras que lo hacían los tetraedros no sustituidos, pero los requisitos del equilibrio de cargas son diferentes.[1] Los átomos de oxígeno pueden compartirse entre dos de estas unidades [SiO4]4−
, es decir, se comparte uno de los vértices del tetraedro. Por ejemplo, el disilicato tiene como fórmula [Si
2O
5]6−
y, en general, los silicatos tienen como fórmula [SiO
3]2−
n. En el caso de que todos los átomos de oxígeno estén compartidos, y por tanto la carga esté neutralizada, se tiene un cristal, una red tridimensional denominada sílice o dióxido de silicio, SiO
2.
Clasificación
[editar]Las propiedades de los silicatos dependen más de la estructura cristalina en que se disponen sus átomos que de los elementos químicos que constituyen su fórmula. Más concretamente, dependen de la forma en que se dispone y enlaza con los iones la unidad fundamental de los silicatos, el tetraedro de SiO4−
4.
La diferencia entre los distintos grupos es la forma en que estos tetraedros se unen. Se distinguen así las siguientes subclases:
- Nesosilicatos: con tetraedros sueltos, de forma que cada valencia libre del tetraedro queda saturada por un catión distinto del silicio. Sus fórmulas serán SiO4−
4. - Sorosilicatos: con dos tetraedros unidos por un vértice para formar un grupo.
- Ciclosilicatos: con grupos de tres, cuatro o seis tetraedros, unidos en anillo.
- Inosilicatos: con grupos de tetraedros unidos en largas cadenas de longitud indefinida. Los más comunes son los que presentan cadenas simples, los llamados piroxeno, mientras que los llamados anfíbol tienen cadenas dobles. Esta estructura dota a estos minerales de hábito fibroso.
- Filosilicatos: con tetraedros unidos por tres vértices a otros, formando una red plana que se extiende en un plano de dimensiones indefinidas. Esta estructura dota a estos silicatos de hábito foliado.
- Tectosilicatos: con tetraedros unidos por sus cuatro vértices a otros tetraedros, produciendo una malla de extensión tridimensional, compleja. La sustitución de silicio por aluminio en algunos tetraedros permite que en la malla se coloquen cationes.
El grado de polimerización puede ser descrito tanto por la estructura formada como por el número de vértices tetraédricos (u oxígenos de coordinación) compartidos (por el aluminio y el silicio en sitios tetraédricos): los ortosilicatos (o nesosilicatos) no tienen ninguna vinculación de poliedros, así que los tetraedros no comparten vértices; los disilicatos (o sorosilicatos) tienen dos tetraedros que comparten un átomo de oxígeno; los inosilicatos son silicatos en cadena: los de cadena simple tienen dos vértices compartidos y los de cadena doble dos o tres; los filosilicatos forman una estructura de lámina que requiere tres oxígenos compartidos (en el caso de silicatos de cadena doble, algunos tetraedros deben compartir dos vértices en lugar de tres como harían si resultase una estructura de lámina); los silicatos en armazón o tectosilicatos, tienen tetraedros que comparten los cuatro vértices; los silicatos de anillo, o ciclosilicatos, solo necesitan tetraedros que compartan dos vértices para formar la estructura cíclica.[1]: 104–117
Se describen a continuación en orden decreciente de polimerización, las subclases de silicato.
- Enlaces de tetraedros
- Ortosilicato o nesosilicato: tetraedros simples
- Sorosilicatos: dobles tetraedros
- Ciclosilicatos: Anillos de tetraedros
- Tectosilicatos: uniones espaciales de tetraedros (zeolita)
- Inosilicatos: cadenas de tetraedros
- Inosilicatos: cadenas dobles de tetraedros
Nesosilicatos u ortosilicatos
[editar]
Los nesosilicatos (del griego νησος nēsos, isla), u ortosilicatos, poseen un tetraedro aislado (insular) de SiO4−
4 que se encuentra conectado solo mediante cationes intersticiales.
- Grupo de la fenacita:
- Grupo del olivino:
- Forsterita - Mg
2SiO
4 - Fayalita - Fe
2SiO
4
- Forsterita - Mg
- Grupo del granate:
- Piropo (Rodolita) - Mg
3Al
2(SiO
4)
3 - Almandino - Fe
3Al
2(SiO
4)
3 - Espesartina - Mn
3Al
2(SiO
4)
3 - Grosularia - Ca
3Al
2(SiO
4)
3 - Andradita - Ca
3Fe
2(SiO
4)
3 - Uvarovita - Ca
3Cr
2(SiO
4)
3 - Hidrogrosularia - Ca
3Al
2Si
2O
8(SiO
4)
3-m(OH)
4m
- Piropo (Rodolita) - Mg
- Grupo del zirconio:
- Grupo de los aluminosilicatos (Al
2SiO
5):
- Andalucita - Al
2SiO
5 - Cianita - Al
2SiO
5 - Sillimanita - Al
2SiO
5 - Dumortierita - Al−
BO
3(SiO
4)
3(O,OH)
3 - Topacio - Al
2SiO
4(F,OH)
2 - Estaurolita - Fe
2Al
9(SiO
4)
4(O,OH)
2
- Andalucita - Al
- Grupo de la humita - (Mg,Fe)
7(SiO
4)
3(F,OH)
2
- Norbergita - Mg
3(SiO
4)(F,OH)
2 - Condrodita - Mg
5(SiO
4)(F,OH)
2 - Humita - Mg
7(SiO
4)(F,OH)
2 - Clinohumita - Mg
9(SiO
4)(F,OH)
2
- Norbergita - Mg
- Datolita - CaBSiO
4(OH) - Mongolita - CaTiSiO
5 - Cloritoide - (Fe,Mg,Mn)
2Al
4Si
2O
10(OH)
4
Sorosilicatos
[editar]Los sorosilicatos poseen doble grupos de tetraedros con (Si
2O
7)6−
o una relación de 2:7.
- Hemimorfita (calamina) - Zn
4(Si
2O
7)(OH)
2·H
2O - Lawsonita - CaAl
2(Si
2O
7)(OH)
2·H
2O - Ilvaíta - CaFe2+
2Fe3+
O(Si
2O
7)(OH) - Grupo de la epidota (contiene a los grupos (SiO|4|)|4−| y (Si|2|O|7|)|6−| )}}
- Epidota - Ca
2(Al,Fe)
3O(SiO
4)(Si
2O
7)(OH) - Zoisita - Ca
2Al
3O(SiO
4)(Si
2O
7)(OH) - Clinozoisita - Ca
2Al
3O(SiO
4)(Si
2O
7)(OH) - Tanzanita - Ca
2Al
3O(SiO
4)(Si
2O
7)(OH) - Allanita - Ca(Ce,La,Y,Ca)Al
2(Fe2+
,Fe3+
)O(SiO
4)(Si
2O
7)(OH) - Dollaseíta-(Ce) - CaCeMg
2AlSi
3O
11F(OH)
- Epidota - Ca
- Vesubiana (idocrasa) - Ca
10(Mg,Fe)
2Al
4(SiO
4)
5(Si
2O
7)
2(OH)
4
Ciclosilicatos
[editar]Los ciclosilicatos, o silicatos de anillo, poseen tetraedros con (Si
xO2x-
3x) o una relación 1:3. Los mismos se presentan como anillos de 3 miembros (Si
3O
9)6−
, 4-miembros (Si
4O
12)8−
y 6 miembros (Si
6O
18)12−
.
- Anillo de 3 miembros
- Benitoíta - BaTi(Si
3O
9)
- Benitoíta - BaTi(Si
- Anillo de 4 miembros:
- Axinita - (Ca,Fe,Mn)
3Al
2(BO
3)(Si
4O
12)(OH)
- Axinita - (Ca,Fe,Mn)
- Anillo de 6 miembros:
- Berilo/Esmeralda - Be
3Al
2(Si
6O
18) - Cordierita - (Mg,Fe)
2Al
3(Si
5AlO
18) - Turmalina - (Na,Ca)(Al,Li,Mg)3−
(Al,Fe,Mn)
6(Si
6O
18)(BO
3)
3(OH)
4
- Berilo/Esmeralda - Be
- 6 unidades [Si
6O
18], beryl (rojo: Si, azul: O) - 3 unidades [Si
3O
9], benitoita - 4 unidades [Si
4O
12], papagoita - 9 unidades [Si
9O
27], eudialyta - 6 unidades, doble anillo [Si
6O
15], milarita



Inosilicatos
[editar]Los inosilicatos (del griego ις [genitivo: ινος inos], fibra), o silicatos de cadena, posee cadenas de silicatos tetraedros entrelazadas tanto con SiO
3, en una relación 1:3, para cadenas simples o Si
4O
11, en una relación 4:11, para cadenas dobles.
- Inosilicatos de cadena simple:
- Grupo de los piroxenos
- Serie de la enstatita - ortoferrosilita
- Enstatita - MgSiO
3
- Enstatita - MgSiO
- Pigeonita - Ca
0.25(Mg,Fe)
1.75Si
2O
6
- Espodumena - LiAlSi
2O
6
- Grupo del pyroxenoide
- Wollastonita - CaSiO
3 - Rodonita - MnSiO
3 - Pectolita - NaCa
2(Si
3O
8)(OH)
- Wollastonita - CaSiO
- Inosilicatos de cadena doble:
- Grupo de los anfíboles:
- Antofilita - (Mg,Fe)
7Si
8O
22(OH)
2
- Cummingtonita - Fe
2Mg
5Si
8O
22(OH)
2 - Grunerita - Fe
7Si
8O
22(OH)
2
- Cummingtonita - Fe
- Antofilita - (Mg,Fe)
- Serie de la tremolita:
- Tremolita - Ca
2Mg
5Si
8O
22(OH)
2 - Actinolita - Ca
2(Mg,Fe)
5Si
8O
22(OH)
2
- Tremolita - Ca
- Hornblenda - (Ca,Na)−
(Mg,Fe,Al)
5Si
6(Al,Si)
2O
22(OH)
2
- Grupo del sodio anfibol:
- Glaucofana - Na
2Mg
3Al
2Si
8O
22(OH)
2 - Riebeckita (asbesto) - Na
2Fe2+
3Fe3+
2Si
8O
22(OH)
2 - Arfvedsonita - Na
3(Fe,Mg)
4FeSi
8O
22(OH)
2
- Glaucofana - Na
Filosilicatos
[editar]Los filosilicatos (del griego φύλλον filon, hoja), o silicatos de hojas, forman hojas paralelas de tetaredros silicatos con Si
2O
5 o en una relación de 2:5.

- Grupo de la serpentina:
- Antigorita - Mg
3Si
2O
5(OH)
4 - Crisotilo - Mg
3Si
2O
5(OH)
4 - Lizardita - Mg
3Si
2O
5(OH)
4
- Antigorita - Mg
- Grupo de minerales de arcilla:
- Halloysita - Al
2Si
2O
5(OH)
4 - Caolinita - Al
2Si
2O
5(OH)
4 - Illita - (K,H
3O)(Al,Mg,Fe)
2(Si,Al)
4O
10[(OH)
2,(H
2O)] - Montmorillonita - (Na,Ca)
0.33(Al,Mg)
2(Si
4O
10)(OH)
2·nH
2O - Vermiculita - (MgFe,Al)
3(Al,Si)
4O
10(OH)
2·4H
2O - Talco - Mg
3Si
4O
10(OH)
2 - Palygorskita - (Mg,Al)
2Si
4O
10(OH)·4(H
2O) - Pirofilita - Al
2Si
4O
10(OH)
2
- Halloysita - Al
- Grupo de la mica:
- Biotita - K(Mg,Fe)
3(AlSi
3O
10)(OH)
2 - Moscovita - KAl
2(AlSi
3O
10)(OH)
2 - Flogopita - KMg
3Si
4O
10(OH)
2 - Lepidolita - K(Li,Al)−
(AlSi
3O
10)(OH)
2 - margarita - CaAl
2(Al
2Si
2O
10)(OH)
2 - Glauconita - (K,Na)(Al,Mg,Fe)
2(Si,Al)
4O
10(OH)
2
- Biotita - K(Mg,Fe)
- Grupo de la clorita:
- Clorita - (Mg,Fe)
3(Si,Al)
4O
10(OH)
2•(Mg,Fe)
3(OH)
6
- Clorita - (Mg,Fe)
Tectosilicatos
[editar]Los tectosilicatos, o "silicatos de marco," poseen una red tridimensional de tetraedros de silicato con SiO
2 o en una relación de 1:2. Este grupo abarca aproximadamente el 75% de la corteza de la Tierra. Los tectosilicatos, con la excepción del grupo del cuarzo, son aluminosilicatos.


- Grupo del cuarzo:
- Cuarzo - SiO
2 - Tridimita - SiO
2 - Cristobalita - SiO
2
- Cuarzo - SiO
- Grupo del feldespato:
- Alkali-feldespato:
- Potasio-feldespato:
- Microclina - KAlSi
3O
8 - Ortoclasa - KAlSi
3O
8 - Sanidina - KAlSi
3O
8
- Microclina - KAlSi
- Anortoclasa - (Na,K)AlSi
3O
8
- Plagioclasa feldespatos
- Albita - NaAlSi
3O
8 - Oligoclasa - (Na,Ca)(Si,Al)
4O
8 (Na:Ca 4:1) - Andesina - (Na,Ca)(Si,Al)
4O
8 (Na:Ca 3:2) - Labradorita - (Na,Ca)(Si,Al)
4O
8 (Na:Ca 2:3) - Bytownita - (Na,Ca)(Si,Al)
4O
8 (Na:Ca 1:4) - Anortita - CaAl
2Si
2O
8
- Albita - NaAlSi
- Grupo del feldespatoide:
- Noseana - Na
8Al
6Si
6O
24(SO
4) - Cancrinita - Na
6Ca
2(CO
3,Al
6Si
6O
24).2H
2O - Leucita - KAlSi
2O
6 - Nefelina - (Na,K)AlSiO
4 - Sodalita - Na
8(AlSiO
4)
6Cl
2
- Haüyna - (Na,Ca)−
Al
6Si
6(O,S)24(SO
4,Cl)−
- Haüyna - (Na,Ca)−
- Lazurita - (Na,Ca)
8(AlSiO
4)
6(SO
4,S,Cl)
2
- Noseana - Na
- Petalita - LiAlSi
4O
10 - Grupo de la escapolita:
- Natrolita - Na
2Al
2Si
3O
10• 2H
2O - Chabazita - CaAl
2Si
4O
12• 6H
2O - Heulandita - CaAl
2Si
7O
18• 6H
2O - Estilbita - NaCa
2Al
5Si
13O
36• 17H
2O
- Natrolita - Na
Referencias
[editar]- Deer, W.A.; Howie, R.A., y Zussman, J. (1992). An introduction to the rock-forming minerals (2.ª edición). Londres: Longman. ISBN 0582300940.
- Deer, W.A.; Howie, R.A., Wise, W.S. y Zussman, J. (2004). Rock-forming minerals. Volume 4B. Framework silicates: silica minerals. Feldspathoids and the zeolites (2.ª edición). Londres: Geological Society of London. p. 982 pp.
- Hurlbut, Cornelius S. (1966). Dana's Manual of Mineralogy (17.ª edición). ISBN 0-471-03288-3.
- Hurlbut, Cornelius S.; Klein, Cornelis (1985). Manual of Mineralogy (20.ª edición). Wiley. ISBN 0-471-80580-7.
Bibliografía adicional
[editar]- Jean Pierre Mercier, Gérald Zambelli, Wilfried Kurz, Traité des matériaux, Vol.1 - Introduction à la science des matériaux, 3a ed., Presses polytechniques et universitaires romandes, 1999 ISBN 2-88074-402-4, p. 95-96, 120-124. (en francés)
- Maurice Bernard, Cours de chimie minérale, 2a ed., Éditions Dunod, 1994 ISBN 2 10 002067 6, p. 259-263. (en francés)
- André Guinier, La structure de la matière – du ciel bleu à la matière plastique, Éditions Hachette, 1980 ISBN 2-01-007095-X, p. 130-132. (en francés)
- Raymond Quelet, Précis de chimie, Tome 1 - Chimie générale, 9a ed., Presses universitaires de France, 1966, p. 186-192. (en francés)
- Huheey, Keiter et al., Chimie inorganique, De Boeck Université, 1996 ISBN 2804121127. (en francés)
- Jacques Angenault, La Chimie – dictionnaire encyclopédique, 2a ed, Éditions Dunod, 1995 ISBN 2100024973, p. 509-516. (en francés)
Véase también
[editar]Notas
[editar]- ↑ a b Dyar, Gunter, and Tasa (2007). Mineralogy and Optical Mineralogy. Mineralogical Society of America. pp. 104-120. ISBN 978-0939950812.






![6 unidades [Si 6O 18], beryl (rojo: Si, azul: O)](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/Beryll.ring.combined.png/120px-Beryll.ring.combined.png)
![3 unidades [Si 3O 9], benitoita](http://upload.wikimedia.org/wikipedia/commons/thumb/6/60/Benitoid.2200.png/120px-Benitoid.2200.png)
![4 unidades [Si 4O 12], papagoita](http://upload.wikimedia.org/wikipedia/commons/thumb/0/08/Papagoite.2200.png/120px-Papagoite.2200.png)
![9 unidades [Si 9O 27], eudialyta](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5d/Eudialyte.2200.png/120px-Eudialyte.2200.png)
![6 unidades, doble anillo [Si 6O 15], milarita](http://upload.wikimedia.org/wikipedia/commons/thumb/2/29/Milarite.png/120px-Milarite.png)