Hiilidioksidi

| Hiilidioksidi | |
|---|---|
 | |
 | |
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | CO2 |
| Moolimassa | 44,0 g/mol |
| Ulkomuoto | Väritön kaasu |
| Sulamispiste | −78 °C (195 K) |
| Kiehumispiste | −57 °C (216 K) (5,812 barissa) |
| Tiheys | 1 600 kg/m3 (kiinteä) 1,98 kg/m3 (kaasu) |
| Liukoisuus veteen | 1,45 kg / 1 000 l |

Hiilidioksidi, molekyylikaavaltaan CO2, on hiilestä ja hapesta koostuva kemiallinen yhdiste. Normaaliolosuhteissa hiilidioksidi on hajuton, väritön, myrkytön, huonosti reagoiva ja ilmaa raskaampi kaasu. Puhtaana kaasuna se syrjäyttää hapen ja voi tukehduttaa ihmisen.
Hiilidioksidia esiintyy paitsi nykyisen asuinplaneettamme Maan ilmakehässä luontaisesti pieninä pitoisuuksina, mutta NASAn instumentit havaitsivat sitä vuonna 2022 myös aurinkokuntamme ulkopuoliselta eksoplaneetalta.[1]
Hiilidioksidin pitoisuus ilmakehässä on vaihdellut luontaisesti eri aikakausina ja oli ennen teollistumista noin 0,028 % eli 280 miljoonasosaa tilavuudesta.[2] Vuoden 2019 lopulla ilmakehän hiilidioksidipitoisuus on keskimäärin 0,04 % (411 ppm).[3]
Hiilidioksidia syntyy hiilipitoisten aineiden palamistuotteena, kuten palaessa sekä soluhengityksessä. Hiilidioksidin lähteitä ovat myös tulivuorien purkaukset, kuumat lähteet, geysirit, ja sitä vapautuu karbonaattikivistä.lähde?
Kasvit käyttävät hiilidioksidia raaka-aineena orgaanisten yhdisteiden valmistuksessa eli yhteyttämisessä. Hiilidioksidi sisältää painon mukaan 27 % hiiltä, ja siinä on lähes kaikki ilmakehässä esiintyvä hiili, jos muun muassa kivihiilen, turpeen ja puun polttamisessa syntyviä PAH-yhdisteitä ei oteta huomioon.lähde?
Hiilidioksidi on merkittävin ihmistoiminnan tuottama kasvihuonekaasu.[4] Hiilidioksidi on merkittävä ilmastoa lämmittävä[5] kasvihuonekaasu, koska se päästää näkyvän valon lävitseen, mutta absorboi voimakkaasti infrapuna- eli lämpösäteilyä. Yhden henkilön verestä siirtyy ulkoilmaan hiilidioksidia pääasiassa hengityksen kautta noin 200 millilitraa minuutissa (8 millimoolia).[6]
Löytöhistoria
[muokkaa | muokkaa wikitekstiä]Hiilidioksidin löytäjänä on pidetty Jan Baptist van Helmontia (1577–1644). Koska puuhiilen palaessa syntynyt tuhka painoi vain pienen osan alkuperäisen puuhiilen painosta, hän päätteli, että loppuosa siitä muuttui kaasuksi ja poistui ilmaan. Tälle kaasulle hän antoi nimen "metsäkaasu" (gas sylvestre).[7] Tarkemmin sen ominaisuuksia tutki Joseph Black, joka vuonna 1756 havaitsi sitä muodostuvan kuumennettaessa magnesia albaa eli magnesiumkarbonaattia.[8] Hän kutsui sitä "sitoutuneeksi ilmaksi".[9] Vuonna 1778 Joseph Priestley havaitsi, että tätä kaasua sisältävässä vedessä kasvit tuottivat "deflogistoitunutta ilmaa" eli happea[10], mikä havainto pian johti fotosynteesin luonteen selvittämiseen.[11] Samoihin aikoihin Antoine Laurent Lavoisier selvitti palamisen luonteen ja osoitti, että tämä kaasu on hiilen ja hapen yhdiste.lähde?
Ominaisuudet
[muokkaa | muokkaa wikitekstiä]Hiilidioksidimolekyyli (O=C=O) on lineaarinen, ja siinä on kaksi kaksoissidosta. Hiilidioksidilla ei ole sähköistä dipolimomenttia. Vesi pystyy liuottamaan normaaliolosuhteissa hieman yli oman tilavuutensa verran hiilidioksidia. Osa liuenneesta hiilidioksidista muuttuu hiilihapoksi.lähde?
Normaalin ilmanpaineen vallitessa hiilidioksidi ei esiinny nesteenä missään lämpötilassa vaan muuttuu suoraan kiinteäksi alle −78 °C:n lämpötiloissa. Nesteenä se voi esiintyä vain, kun paine on vähintään 5,2 baaria. Kiinteää hiilidioksidia kutsutaan kuivajääksi tai "hiilihappojääksi".lähde?
Hiilidioksidi ei ylläpidä palamista, joten sitä voidaan käyttää sammuttimissa. Vastaavasti se ei myöskään ylläpidä hengitystä, joten liian suurina pitoisuuksina hiilidioksidi aiheuttaa tukehtumisen, tajuttomuuden ja kuoleman.lähde?
Käyttö
[muokkaa | muokkaa wikitekstiä]Hiilidioksidia käytetään teollisuudessa muun muassa elintarvikkeiden jäähdytyksessä ja pakastamisessa, virvoitusjuomien hiilihapotuksessa sekä elintarvikkeiden suojakaasupakkaamisessa. Hiilidioksidikaasua käytetään myös juoma-, pesu-, prosessi- ja jäteveden käsittelyssä, selluteollisuudessa massan pesun tehostuksessa, mäntyöljyn valmistuksessa, kutistusliitoksissa, putkenjäädytyksessä, hiilidioksidilannoituksessa kasvihuoneissa sekä eläinten tainnutuksessa. Koska hiilidioksidikaasu on kemiallisesti inerttiä, sitä käytetään hapettumissuojauksessa, hitsaussuojakaasuissa, laserkaasuissa, palojen ja räjähdysten ehkäisyssä ja palonsammutuksessa. Hiilidioksidia käytetään myös lääkkeellisessä karbogeenissa (lääkkeellisen hapen ja lääkkeellisen hiilidioksidin seos).[12] Lisäksi hiilidioksidia käytetään kirurgisissa leikkauksissa.[13]
Yhdistämällä hiilidioksidia ja vetyä voidaan valmistaa erilaisia hiilivetyjä kuten polttoaineita, muoveja ja kemikaaleja. Teoriassa kaikki öljytuotteet voitaisiin korvata tällä tavalla.[14]
Käyttöä varten hiilidioksidia otetaan talteen joissakin suurissa voimaloissa, sellutehtaissa ja öljyteollisuudessa.[14]
Kuivajää
[muokkaa | muokkaa wikitekstiä]
Lämpötilassa −78,5 °C hiilidioksidikaasu härmistyy kiinteäksi hiilidioksidijääksi eli hiilihappojääksi (”kuivajääksi”). Hiilidioksidijää on kätevä jäähdytin, koska se muuttuu lämmetessään suoraan kaasuksi, eikä se siten kastele pintoja. Paljain käsin kosketeltuna kuivajää aiheuttaa iholle palovamman kaltaisia vaurioita.
Hiilidioksidijään ja veden avulla voidaan synnyttää "savua" esimerkiksi elokuvia ja esityksiä varten. Kuivajäätä valmistettiin ensi kertaa vuonna 1825, kun avattiin nestemäistä suurpaineista hiilidioksidia sisältävä säiliö. Säiliöistä karkasi kaasumaista hiilidioksidia ja sinne jäi kuivajäätä.
Biologia
[muokkaa | muokkaa wikitekstiä]Ilmakehän hiilidioksidi on välttämätön edellytys kasvien fotosynteesille ja muiden auringonvaloa hyödyntävien autotrofien elintoiminnoille.
Orgaanisten yhdisteiden hapetus, toisin sanoen hengitys, on monen eliölajin, kuten eläinten, energianlähde. Tällöin niissä oleva hiili yhtyy ilman hapen kanssa hiilidioksidiksi vapauttaen samalla energiaa. Samoin tapahtuu myös, kun orgaaninen aines palaa täydellisesti. Kasvit ja muut auringonvalosta energiansa saavat eliöt, alkutuottajat, puolestaan sitovat auringonvalon energiaa yhteyttäessään ja varastoivat sen orgaanisiin yhdisteisiin, lähinnä hiilihydraatteihin. Rakennusaineeksi tarvitaan hiilidioksidin hiiltä, ja sivutuotteena ilmaan vapautuu happea. Näin hiili kiertää ilmasta alkutuottajiin, alkutuottajista ravintoketjun muihin osiin ja lopulta taas ilmakehään.
Ilmakehässä
[muokkaa | muokkaa wikitekstiä]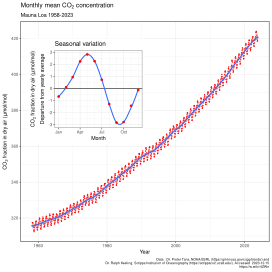
2020-luvulla hiilidioksidia on ulkoilmassa keskimäärin 0,038–0,044 % eli 380–440 ppm kaikista kaasuista. Lukema vaihtelee muun muassa vuodenajasta riippuen.[15] Pitoisuus on vaihdellut huomattavasti maapallon eri geologisina aikakausina. Esiteollisella ajalla (noin 1800-luvun alkuun saakka) pitoisuus pysyi 260–280 ppm:n tasolla noin kymmenen tuhannen vuoden ajan. Merenpohjan sedimenteistä ja kasvien fossiileista tehtyjen mittausten perusteella on voitu arvioida, että esimerkiksi 150–200 miljoonaa vuotta sitten hiilidioksidin pitoisuus oli kuitenkin ilmeisesti paljon nykyistä suurempi, yli 2 000 ppm, ja 400–600 miljoonaa vuotta sitten ajoittain jopa yli 5 000 ppm.[16]
Hiilidioksidi on kasvihuonekaasu, eli sen määrän lisääntyminen ilmakehässä kasvattaa maapallon lämpötilaa. Fossiilisten polttoaineiden käyttö nostaa ilmakehän hiilidioksidipitoisuutta, kun syvällä maaperässä ollut hiili poltettaessa muuttuu hiilidioksidiksi ja siirtyy ilmakehään. Ihmistoiminta lisää ilmakehän hiilidioksidipitoisuutta ja lämmittää ilmastoa silloin kun poltetaan öljyä, maakaasua, hiiltä ja muita fossiilisia polttoaineita.lähde?
Jos CO2-pitoisuus nousisi yli 450 ppm, Grönlanti ja läntinen Antarktis todennäköisesti sulaisivat. Tämä nostaisi merten pintaa noin 6 metriä, sillä nykyisin jäätiköt ovat osin maa-alueiden päällä eivätkä siten vaikuta pinnan tasoon.[17]
| 1990 | 1995 | 2000 | 2005 | 2010 | 2015 | 2020 | |
|---|---|---|---|---|---|---|---|
| Öljy | 27,3 | 25,2 | 25,3 | 25,8 | 24,3 | 20,0 | 18,8 |
| Hiili | 14,5 | 14,2 | 12,9 | 11,1 | 16,2 | 8,3 | 5,2 |
| Maakaasu | 5,0 | 6,4 | 7,6 | 8,0 | 8,0 | 4,4 | 4,0 |
| Turve | 5,6 | 8,3 | 6,6 | 7,4 | 10,2 | 6,1 | 4,5 |
| Muut fossiiliset | 0,1 | 0,2 | 0,3 | 0,3 | 0,4 | 0,8 | 1,0 |
| Yhteensä | 52,5 | 54,2 | 52,7 | 52,7 | 59,1 | 39,6 | 33,6 |
| Hiilidioksidin ominaispäästökertoimia | |
|---|---|
| Polttoaine (g CO2 / kWh)[19] | |
| Maakaasu | 198 |
| Nestekaasut | 234 |
| Lentopetroli | 264 |
| Moottoribensiinit | 262 |
| Dieselöljy | 265 |
| Kevyt polttoöljy | 267 |
| Raskas polttoöljy | 284 |
| Kivihiili | 341 |
| Jyrsinturve | 381 |
| Koksi | 389 |
| Puutähde | 395 |
| Mustalipeä | 395 |
On huomattava, että kasvipohjaiset polttoaineet (puutähde, mustalipeä) eivät lisää ilmakehän hiilidioksidikuormaa, jos samoille paikoille kasvatetaan uudelleen metsää. Vuosina 2000–2006 Suomen hiilidioksidipäästöt kasvoivat 20,7 %. Polttoainekohtainen päästöjen kasvu oli hiilellä 58 % ja turpeella 31 %.
Hengitysilmassa
[muokkaa | muokkaa wikitekstiä]Hiilidioksidi on melko vaaraton kaasu, eikä sen pitoisuus sisäilmassa normaalisti nouse terveydelle haitalliselle tasolle.[15] Pitoisuutta voidaan kuitenkin pitää ihmisestä peräisin olevien epäpuhtauksien esiintymisen indikaattorina, joka määrittää ilmanvaihdon tarpeen.[20] Ympäristöministeriön ohje hiilidioksidin enimmäispitoisuudelle sisäilmassa tavanomaisissa sääoloissa ja huonetilan käyttöaikana on 1 200 ppm.[21] Tämän arvon ylittyminen voi kertoa siitä, että ilmanvaihto ei poista sisätiloissa syntyviä epäpuhtauksia ja kosteutta tarpeeksi hyvin ilmasta.[15] Työpaikoilla hyväksyttävä altistusraja 8 tunnin työpäivän aikana on 5 000 ppm.[22] Edes lyhytaikaisen altistumisen alle 20 000 ppm:n hiilidioksidipitoisuuksille ei ole todettu aiheuttavan haitallisia terveysvaikutuksia.[23] Sitä korkeammat pitoisuudet aiheuttavat hengityksen kiihtymistä, päänsärkyä, vakavampia terveydellisiä vaurioita, ja lopulta yli 100 000 ppm:n tasolla tajuttomuuden.[15]
Katso myös
[muokkaa | muokkaa wikitekstiä]- Bosch-reaktio
- Hiilisuboksidi
- Luettelo valtioiden hiilidioksidipäästöistä henkeä kohti
- Kioton pöytäkirja
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ https://www.nasa.gov/feature/goddard/2022/nasa-s-webb-detects-carbon-dioxide-in-exoplanet-atmosphere
- ↑ Eggleton, R. A.: A short introduction to climate change, s. 52. Cambridge: Cambridge University Press, 2012. 819572508 ISBN 9781139524353, 1139524356, 9781139627399, 1139627392, 9781283943024, 1283943026, 9781139627948, 1139627945, 1139627058, 9781139627054 Teoksen verkkoversio (viitattu 15.11.2019).
- ↑ ESRL monitoring: Trends in Atmospheric Carbon Dioxide NOAA. (englanniksi)
- ↑ toim. Virtanen, Anne & Rohweder, Liisa: ”Sanasto”, Ilmastonmuutos käytännössä, s. 410. Helsinki: Gaudeamus, 2011. ISBN 978-952-495-178-4
- ↑ Causes of Climate Change United States Environmental Protection Agency. Viitattu 22.3.2013. (englanniksi)
- ↑ Walter Nienstedt ym.: Ihmisen fysiologia ja anatomia, s. 279, WSOY, 2000, ISBN 951-0-23265-3
- ↑ Löytöretki happamuuteen – kemian historiaa, Jan Babtist van Helmont (1577–1644) Helsingin yliopisto. Viitattu 17.7.2010.
- ↑ John Hudson: Suurin tiede – kemian historia, s. 87–88. Suomentanut Kimmo Pietiläinen. Art House, 2002. ISBN 951-884-346-5
- ↑ Reijo Rasinkangas: Tieteen ja ajattelun historiaa – Uusi aika I Oulun yliopisto. Arkistoitu 7.6.2007. Viitattu 21.6.2007.
- ↑ Hudson, s. 94
- ↑ A. G. Morton: Kasvitieteen historia. Suomentanut Johannes Enroth, Ilkka Kukkonen. Gaudeamus, 1999. ISBN 951-662-756-0
- ↑ (OVA-kortti: Hiilidioksidi) (Arkistoitu – Internet Archive)
- ↑ http://www.aga.fi/international/web/lg/fi/like35agafi.nsf/docbyalias/gasschool_co2_sol%7C AGA Oy, hiilidioksidin käyttökohteet [vanhentunut linkki]
- ↑ a b Tässä kontissa puhdistetaan ja pullotetaan ilmastopahis hiilidioksidia – yhdessä vedyn kanssa se voisi korvata vaikka kaikki öljytuotteet Yle Uutiset. 7.3.2023. Viitattu 7.3.2023.
- ↑ a b c d Juulia Mikkola: Sisäilman hiilidioksidilla pelotellaan turhaan 2022. Rakennustarkastusyhdistys. Viitattu 19.7.2023.
- ↑ Climate Change 2001: The Scientific Basis (Arkistoitu – Internet Archive)
- ↑ Carbon’s New Math, National Geography 10 3007 s. 33 (englanniksi)
- ↑ Energiakäytön polttoperäiset kasvihuonekaasupäästöt (1A) polttoaineryhmittäin muuttujina Vuosi, Päästöluokka, Kasvihuonekaasu, Polttoaine ja Tiedot PxWeb. Viitattu 7.3.2023.[vanhentunut linkki]
- ↑ Energiatilasto, Vuosikirja 2006, Tilastokeskus, Helsinki 2006
- ↑ Asumisterveysohje, tiivistelmä Sosiaali- ja terveysministeriö. Viitattu 24.11.2014.
- ↑ D2 SRMK Rakennusten sisäilmasto ja ilmanvaihto. Määräykset ja ohjeet 2012 julkaisija = Oikeusministeriö finlex.fi. Viitattu 24.11.2014.
- ↑ HTP-arvot 2014. Haitallisiksi tunnetut pitoisuudet HTP-arvot 2014. Haitallisiksi tunnetut pitoisuudet. Sosiaali- ja terveysministeriö.. Viitattu 24.11.2011.
- ↑ OVA-ohjeet: Hiilidioksidi Onnettomuuden vaaraa aiheuttavat aineet -turvallisuusohjeet. Työturvallisuuslaitos. Arkistoitu 3.9.2014. Viitattu 24.11.2014.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Hiilidioksidin kansainvälinen kemikaalikortti
- Hiilidioksidi – Onnettomuuden vaaraa aiheuttavat aineet -turvallisuusohjeet (Arkistoitu – Internet Archive)
- Kemian työsuojeluneuvottelukunta (KETSU): Hiilidioksidi (Arkistoitu – Internet Archive)
- Hiilidioksidi ja kasvihuoneilmiö – Opetushallitus (Arkistoitu – Internet Archive)
- Ilmastosivut
- Hiilidioksidin määrä ilmakehässä kasvaa rajusti YLE 11.9.2007
- PubChem: Carbon Dioxide (englanniksi)
- Human Metabolome Database: Carbon dioxide (englanniksi)
- KEGG: Carbon dioxide (englanniksi)
- Pherobase: Semiochemical – CO2
argon (E 398) | butaani (E 943a) | happi (E 948) | helium (E 939) | hiilidioksidi (E 290) | isobutaani (E 943b) | propaani (E 944) | typpi (E 941) | typpimonoksidi (E 942) | vety (E 949)
| Syyt | |
|---|---|
| Vaikutukset | |
| Tiede | |
| Keskustelu ja politiikka |