Vetyfluoridi

| Vetyfluoridi | |
|---|---|
 | |
| Tunnisteet | |
| Muut nimet | Fluorivety, Fluorivetyhappo |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | HF |
| Moolimassa | 20,008 g/mol |
| Ulkomuoto | Väritön neste tai kaasu |
| Sulamispiste | −84 °C (189,15 K) |
| Kiehumispiste | 19,54 °C (292,69 K) |
| Tiheys | 0,922 kg/m3 |
| Liukoisuus veteen | Erittäin hyvä |

Vetyfluoridi eli fluorivety (HF) on vedyn ja fluorin muodostama molekyyliyhdiste. Muista halideista poiketen vetyfluoridin kiehumispiste on hyvin lähellä huoneenlämpötilaa. Fluorivety on väritön kaasu kiehumispistettä korkeammassa lämpötilassa ja alemmassa lämpötilassa höyryjä helposti muodostava savuava neste. Fluorivedyllä on voimakas ja ärsyttävä haju. Aine on heikko happo[1]. Fluorivety reagoi veden kanssa vapauttaen myrkyllisiä ja syövyttäviä höyryjä. Aineen liuetessa veteen syntyy lämpöä, joka voi aiheuttaa roiskevaaran. Fluorivety syövyttää lasia, nahkaa ja useita metalleja. Aineen reaktiossa metallien kanssa voi muodostua helposti syttyvää vetykaasua. Vetyfluoridin vesiliuosta kutsutaan fluorivetyhapoksi, joka on vain heikosti hapan, mutta vahvasti korrosoiva. Ainetta käytetään laajasti petrokemianteollisuudessa, ja se on tärkeä yhdiste niin kutsuttujen superhappojen valmistuksessa.
Vetyfluoridin happovakio (pKa) vedessä on 3,17 [2].
Vetyfluoridin rakenne
[muokkaa | muokkaa wikitekstiä]Vetyfluoridikiteet koostuvat siksakmaisista molekyyliketjuista. Molekyylien sisäiset kovalenttiset sidokset ovat noin 95 pikometriä pitkiä. Molekyylit ovat kiinni toisissaan sähköisellä vetovoimalla, vetysidoksilla. (Merkitty kuvaan katkoviivoilla.)
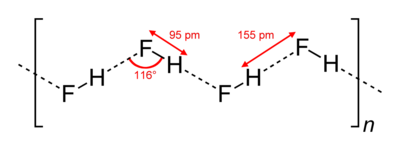
Myös nestemäisessä olomuodossa vetyfluoridimolekyylit muodostavat ketjuja, tosin lyhyempiä, noin viiden tai kuuden molekyylin mittaisia. Vetyfluoridin korkeampi kiehumispiste muihin halideihin verrattuna johtuu pitkälti vahvoista vetysidoksista.
Käyttö ja valmistus
[muokkaa | muokkaa wikitekstiä]Vetyfluoridia käytetään muun muassa polymeerien fluorauksessa, maaöljyn jalostuksessa, lasinvalmistuksessa ja etsauksessa, alumiinin tuotannossa ja uraaniheksafluoridin syntetisoinnissa. Vetyfluoridin vesiliuos myös syövyttää oksideja, joten sitä käytetään teräksen valmistuksessa ja puolijohdeteollisuudessa piin epäpuhtauksien poistossa.
Vetyfluoridia valmistetaan kalsiumfluoridista ja rikkihaposta.
- CaF2 + H2SO4 → CaSO4 + 2 HF
Ainetta myydään yleensä anhydridinä tai 70- tai 49-prosenttisina vesiliuoksina eli fluorivetyhappona. Voimakkaan reaktiivisuutensa ja syövyttävyytensä takia vetyfluoridia ja sen vesiliuosta säilytetään yleensä teflon-astioissa. Fluori ei reagoi teflonin kanssa, joka itse on fluoriyhdiste.
Terveysvaikutukset
[muokkaa | muokkaa wikitekstiä]Aine on myrkyllistä ja voi olla jopa kuolettavaa pieninäkin annoksina ravinnossa tai ihon läpi imeytyneenä. Iholle joutuessaan aine voi aiheuttaa vakavia vaurioita ja hengitettynä tai nieltynä pahoinvointia.[1] Suuret vetyfluoridin pitoisuudet aiheuttavat vaikeita, tuskallisia vammoja iholla, silmissä ja limakalvoilla.
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b Vetyfluoridin kansainvälinen kemikaalikortti
- ↑ D.A. Evans: pKa's of Inorganic and Oxo-Acids 19.6.2020. Pittsburghin yliopisto, Kemian laitos.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä] Kuvia tai muita tiedostoja aiheesta Vetyfluoridi Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Vetyfluoridi Wikimedia Commonsissa
- OVA-ohje: Työterveyslaitos, OVA-ohje: Fluorivety ja fluorivetyhappo (Arkistoitu – Internet Archive)
- PubChem: Hydrofluoric acid (englanniksi)
- Toxin and Toxin Target Database (T3DB): Hydrogen fluoride (englanniksi)
- Kyoto Encyclopedia of Genes and Genomes (KEGG): Hydrofluoric acid (englanniksi)
- ChemBlink: Hydrofluoric acid (englanniksi)
- Bristol University School of Chemistry, Molecule of the Month: Hydrogen Fluoride (englanniksi)