Chikungunya

| Causes | Chikungunya virus |
|---|---|
| Transmission | Transmission par les moustiques (d) |
| Incubation min | 3 j |
| Incubation max | 12 j |
| Symptômes | Fièvre, nausée, myalgie, exanthème, arthralgie, céphalée, fatigue, conjonctivite et trouble neurologique |
| Traitement | Soins de support (d) |
|---|---|
| Médicament | Anti-inflammatoire non stéroïdien |
| Spécialité | Infectiologie |
| CISP-2 | A78 |
|---|---|
| CIM-10 | A92.0 |
| CIM-9 | 065.4, 066.3 |
| DiseasesDB | 32213 |
| MeSH | D018354 |
Le chikungunya (en abrégé, le chik), est une maladie infectieuse tropicale provoquée par le virus du chikungunya (CHIKV), un arbovirus du genre Alphavirus, famille des Togaviridae. Elle est transmise par des moustiques du genre Aedes. Le nom est d'origine makondée[1] et signifie : « qui se recourbe, qui se recroqueville », à l'image des feuilles tombées des arbres qui se recourbent en séchant ; la traduction de chikungunya en français signifie « maladie qui brise les os » ou « maladie de l'homme courbé » car elle occasionne de très fortes douleurs articulaires associées à une raideur, ce qui donne aux patients infectés une attitude courbée très caractéristique.
La transmission du virus d'un humain malade à un moustique se fait par le sang aspiré lors de la piqûre. La contamination d'un homme sain est réalisée par la salive de moustiques qui ont été infectés quelques jours ou quelques semaines auparavant. Seuls les moustiques femelles piquent. Plusieurs espèces de moustiques sont susceptibles de transmettre le chikungunya, mais seules Aedes aegypti et Aedes albopictus ont été à ce jour identifiées comme vecteurs épidémiques, à cause de leur adaptation aux zones d'habitat humain. Ces mêmes espèces sont également impliquées dans la transmission d'autres arbovirus : virus de la dengue (incluant la fièvre dengue hémorragique - DHF), virus de la fièvre jaune, etc.
Un virus, des réservoirs, des vecteurs, des récepteurs humains
[modifier | modifier le code]Le virus
[modifier | modifier le code]
Il s’agit d’un arbovirus (alphavirus à ARN thermosensible de la famille des Togaviridae). Il est proche du virus O'nyong-nyong et comprend deux types génétiques, un situé en Afrique occidentale, l'autre en Afrique orientale et du sud[2]. Il est possible que la mutation sur un gène codant une protéine de l'enveloppe virale puisse modifier le caractère infectant du moustique vecteur et expliquer, en partie, la grande dissémination au cours des années 2000[3]. Le génome du virus isolé à La Réunion a été séquencé, il contient 14 500 nucléotides et dérive de la souche africaine.
Après amplification sur cellules de moustique, qui le multiplient très efficacement en plusieurs dizaines de millions de particules virales par millilitre de surnageant de culture, le virus a été analysé par microscopie électronique, par la technique de coloration négative. Sa taille est de 70 nanomètres, il a une forme ronde, on peut distinguer sa capside entourée d'une enveloppe (Institut Pasteur Paris). Les virus à ARN possèdent des polymérases « peu fiables », elles commettent de nombreuses erreurs de transcription car elles sont dépourvues de système de correction[4]. Cela est à l’origine de nombreuses variations ou mutations, ce qui permet au virus de s'adapter et d'évoluer plus rapidement. In vitro, sa croissance est inhibée par la chloroquine[réf. nécessaire] dont les effets anti-viraux avaient déjà été démontrées sur le virus Sindbis[réf. nécessaire] dans les années 1980. Il est également sensible à la ribavirine et à l’interféron, mais dans une moindre mesure[réf. nécessaire].
Les alphavirus comprennent 28 virus, dont les virus Chikungunya, O’Nyong Nyong, Ross River, Sindbis, Mayaro. Tous les arbovirus connus appartiennent à cinq familles de virus. Il y a 537 arbovirus et apparentés recensés (1996, source Institut Pasteur), dont 168 en Afrique, 91 en Amérique du Nord et 137 en Amérique du Sud. Environ cent dix d’entre eux sont pathogènes pour l’homme et responsables d’autant d’arboviroses humaines. Une quarantaine d’entre eux est cause de maladies animales identifiées.
Le cycle du virus
[modifier | modifier le code]Comme chez la majorité des espèces culicidiennes, seule la femelle est hématophage (c'est-à-dire qu'elle doit se nourrir de sang pour assurer le développement de ses ovaires et de ses œufs) et donc capable de transmettre le chikungunya. Cette capacité « vectorielle » de la femelle Aedes s’explique par une faculté à dupliquer le virus (et non pas par la quantité de sang absorbé, bien insuffisante). Et contrairement aux idées reçues, ce n’est pas en absorbant le sang mais juste avant, en injectant un peu de salive anticoagulante et anesthésiante dans un vaisseau sanguin de sa victime, que le moustique infecte l'hôte. Les mâles étant des suceurs de sève d'herbacées ou de nectars de fruit, ils sont donc démunis de pièces buccales capables de transpercer la peau des vertébrés.
Un moustique femelle s’infecte en piquant un humain ou un animal contaminé. Le sang traverse ensuite la frontière stomacale de l’animal. L'Aedes femelle ne sera alors infectante qu'après plusieurs jours de développement du virus dans son corps jusqu'à ce qu'il arrive aux glandes salivaires. La femelle devenue infectante le reste toute sa vie, soit environ un mois. Or, elle pique et pond tous les quatre jours environ. Sept à huit transmissions du virus par le moustique sont donc possibles avec contamination d'autant de personnes. Une femelle Aedes pond environ 300 œufs au cours de son existence.
Il existe une transmission verticale du virus de la femelle infectée à ses œufs, c’est-à-dire que les œufs pondus par une femelle infectée sont contaminés, cependant dans une très faible proportion (1 à 2 %), et donc sans répercussion réelle sur la transmission de la maladie.
La transmission directe du virus d'homme à homme n’a jamais été observée. La transmission est dite indirecte car elle nécessite la présence d'un moustique vecteur : Stegomyia albopicta ou St. aegypti essentiellement. Côtoyer des « chikungunyés » ne présente pas de risque direct, y compris si ceux-ci sont piqués par des Aedes qui se gorgent ainsi de leur sang riche en virus, car ceux-ci ne deviendront infectants que plusieurs jours après leur repas de sang. Il existe une transmission in utero du virus de la mère à l'enfant (une quarantaine de cas ont été décrits en 2005-2006 à La Réunion). Le chikungunya peut alors induire des lésions neurologiques graves chez le fœtus, pouvant entraîner son décès in utero au cours du second trimestre (3 cas à La Réunion). Mais le risque essentiel est constitué par l'accouchement en période virémique, c’est-à-dire pendant que la future maman est malade du chikungunya. Dans la moitié des cas, l'enfant est alors contaminé par le virus et fait une encéphalite dans 10 % des cas.
Le réservoir non-humain est constitué de primates et de petits mammifères[5].
Le réservoir
[modifier | modifier le code]En Afrique et en Asie, il est principalement représenté par les singes et d’autres vertébrés. D’autres espèces peuvent être infectées, notamment l’humain.
Dans l’océan Indien, plusieurs réservoirs animaux ont été suspectés : singes macaques (île Maurice), lémuriens et chauves-souris (Mayotte, Madagascar) et sont en cours[Quand ?] d’investigation (programmes EntomoChik et AniChik). Deux campagnes de prélèvements biologiques ont été menées. Les premiers résultats ne montrent pas de présence virale (PCR) chez l’animal (l’étude a débuté après le pic épidémique), par contre toutes les espèces étudiées sauvages ou domestiques présentent dans plus de la moitié des cas, des anticorps spécifiques, témoignant d’un contact avec le virus.
En ce qui concerne le réservoir animal, citons P. Brémont[réf. nécessaire], de l’UR 892 Virologie immunologie moléculaire : « La question d’un potentiel réservoir animal pour le Chikungunya a été peu abordée et seules quelques hypothèses ont été avancées. La raison principale de cette méconnaissance est que jusqu’à aujourd’hui les études menées sur le Chikungunya ont été réalisées en condition épidémique, et donc en situation où homme et faune sauvage sont nécessairement séroconvertis. Les espèces animales pour lesquelles une analyse sérologique a établi la présence du vCHIK sont le singe Macaca Fascicularis aux Philippines[6] et en Malaisie[7]. À noter dans cette étude une prévalence du virus Getah (Alphavirus du même groupe que vCHIK) chez le porc domestique. Toujours chez le singe, prévalence du vCHIK dans l’espèce Cercopithecus Aethiop Pygerythrus en Afrique du Sud[8]. Les orang-outans à Bornéo semblent également constituer des porteurs sains du vCHIK ou même d’autres arboviroses[9]. Une étude basée sur des infections expérimentales de souris montre que les oiseaux tels que l’hirondelle Hirundo Rustica ou le moineau Passer domesticus peuvent constituer des réservoirs potentiels[10] via l’infestation par des ectoparasites nidicoles. Concernant les oiseaux migrateurs, une étude réalisée en Russie[11] montre qu’un grand nombre d’espèces sont séropositives pour les arboviroses, incluant le Chikungunya. Les espèces recensées sont Sterna Hirundo, Egretta garzetta, Larus malanocephalus, Streptopelia Turtus, Ardea cinerea, Ardeola ralloides, Larus ridibundus et Nycticorax nycticorus. Une étude menée au Sénégal[12] semble également confirmer le rôle important des oiseaux migrateurs comme vecteur potentiel des arboviroses, et en particulier pour le Chikungunya. Le cheval peut également constituer un potentiel réservoir pour le vCHIK mais aussi pour beaucoup d’autres arboviroses[13]. Une description de tiques de la famille des Ixodidae les propose comme potentiel réservoir pour le vCHIK[14]. C’est la seule description de ce type. Les tiques examinées étaient principalement Amblyomma variegatum, Boophilus et Rhipicephalus. Les données sont parcellaires, souvent obtenues en phase de crise épidémique et donc peu favorables à une analyse claire de la question des réservoirs animaux. De toute évidence, des recherches actives doivent être menées pour identifier de façon plus fiable l’existence d’un réservoir animal pour le Chikungunya, en dehors bien entendu de l’homme lui-même. »
Les vecteurs
[modifier | modifier le code]
Diverses espèces de moustiques, telles que Aedes (Diceromyia) furcifer, Aedes (Diceromyia) taylori, Aedes africanus, Aedes luteocephalus (en), Aedes (Stegomyia) albopictus et Aedes (Stegomyia) aegypti sont les vecteurs du virus du chikungunya. Quelques cas de contaminations sanguines existent toutefois dans la littérature médicale. Ils sont extrêmement rares et concernent du personnel soignant qui s’est involontairement inoculé le virus.
Stegomyia albopicta ne pond que dans l’eau stagnante, préférentiellement à l’ombre. L'œuf résiste à la dessiccation et survit en absence d'eau, n'éclosant qu'à la remise en eau de son lieu de ponte. En France, l'œuf de Stegomyia albopicta entre en diapause dans le courant de l'automne et n'éclora qu'au printemps.
Il ne faut pas limiter la lutte anti-moustiques au seul contrôle des adultes. Il est plus simple et efficace d'éliminer les gîtes larvaires, que de courir derrière autant de moustiques adultes et donc volants.
En septembre 2013, des chercheurs de l'IRD (Institut de Recherche pour le Développement) ont découvert à Mayotte une nouvelle espèce de moustique, Stegomyia pia, soupçonnée de transmettre également ces arbovirus[15].
Tableau clinique classique de l’adulte
[modifier | modifier le code]Le chikungunya est une arbovirose classée algo-éruptive avec un syndrome similaire à celui de la dengue, classiquement décrite comme bénigne, d’évolution aiguë ou sub-aiguë.
Après une incubation de 4 à 7 jours en moyenne (mais qui pourrait être comprise entre 1 et 12 jours, selon la littérature[5]), apparaît brutalement une fièvre élevée accompagnée d’arthralgies qui peuvent être intenses touchant principalement les extrémités des membres (poignets, chevilles, phalanges), mais également le rachis et qui peuvent confiner le patient en position couchée paralytique pendant plusieurs heures. L'atteinte articulaire est, en général, bilatérale, atteignant plusieurs cibles : doigts, poignets, coudes, orteils, genoux… Les douleurs sont fréquemment décrites comme atroces et « poussant au suicide ». Surviennent également des myalgies (douleurs musculaires), des céphalées et une éruption maculo-papuleuse dans plus de la moitié des cas. Des hémorragies bénignes à type de gingivorragies sont observées, surtout chez les enfants. Enfin, il existe des infections asymptomatiques et l’immunité acquise paraît précoce et durable.
L’évolution clinique est variable. Elle peut être rapidement favorable, le malade répondant bien au traitement symptomatique, mais la maladie peut aussi évoluer vers une phase chronique marquée par des arthralgies persistantes, incapacitantes, erratiques, symétriques ou non, causes de dépression. Une phase matinale de dérouillage parfois longue (une demi-heure à une heure) est parfois nécessaire avant le démarrage des activités. D’autres signes sont décrits à La Réunion : agueusie, sensation de vives brûlures de la plante des pieds, gênant la marche…
Pendant la convalescence qui peut durer plusieurs semaines, le malade est en proie à une asthénie importante et souvent à des arthropathies (atteinte des articulations) douloureuses et invalidantes. Si la maladie est réputée bénigne et très souvent inapparente, ont été notées à La Réunion des formes plus graves non décrites dans la littérature médicale.
Les enfants ne présentent que rarement ces douleurs articulaires. Chez eux le chikungunya se traduit comme une simple grippe.
L'éruption est présente essentiellement sur le torse, les jambes et la face, de type maculo-papulaire (ressemblant à celle de la rougeole) mais d'autres formes sont possibles[16].
Des syndromes digestifs sont présents dans près de la moitié des cas[17] : douleurs abdominales, diarrhée…
Environ 10 % des cas sont asymptomatiques (ne présentant aucun signe et découverts uniquement sur des arguments biologiques)[18].
Complications chez l’adulte et le nouveau-né
[modifier | modifier le code]Formes douloureuses persistantes et récurrentes
[modifier | modifier le code]Des symptômes persistent chez plus de 80 % des personnes infectées à 3 mois, chez 57 % à 15 mois et chez 47 % à 24 mois[19].
Chez plus de la moitié des personnes infectées, les douleurs articulaires peuvent persister ou réapparaître pendant plusieurs mois, voire plus d'un an, notamment aux articulations fragilisées (anciennes entorses ou fractures chez des sportifs, rhumatisme ou arthrose préexistente par exemple), chez les personnes les plus âgées et celles dont les manifestations initiales ont été les plus importantes[20]. Cette prolongation des symptômes pourrait être secondaire à la persistance du virus et du syndrome inflammatoire[21]. De même, une fatigue peut se poursuivre au-delà d'un an[22].
Personnes fragilisées par d’autres maladies
[modifier | modifier le code]Une attention particulière doit toutefois être portée aux personnes fragiles : les nourrissons dont les douleurs peuvent bloquer la mâchoire et rendre impossible toute alimentation, les personnes âgées aux défaillances d'organes particulièrement sensibles aux effets de la fièvre (accélération de la fréquence cardiaque, déshydratation). Sont particulièrement exposées à ces risques secondaires à toute fièvre les personnes atteintes de diabète, insuffisance cardiaque, rénale, respiratoire… Les alcooliques chroniques atteints de chikungunya ont présenté des risques accrus d'hépatite mortelle.
Les cas graves nécessitent d’être hospitalisés en service de réanimation[23],[24].
Atteintes neurologiques et cardiaques
[modifier | modifier le code]Des cas d'encéphalites[25], des syndromes de Guillain-Barré[26], de paralysie[27] et des myocardites[28] ont été décrits.
Transmission materno-fœtale
[modifier | modifier le code]La transmission materno-fœtale d'arbovirus est connue pour le virus West Nile[29]. Le virus de l’encéphalite équine est et nord-américaine (depuis 1953 et 1959) le virus Getah chez les mammifères. À La Réunion, une étude sur toutes les naissances depuis fin septembre 2005 recense 151 infections par le chikungunya de femmes enceintes, au-delà de 22 semaines d’aménorrhée, sur 3 192 grossesses (5 %), dont 33 infections per-partum. Dix-huit nouveau-nés ont été infectés sur ces 33 derniers cas (54 %). Les cas observés se situent lors de l’accouchement en période virémique avec transmission du virus au nouveau-né. Une cinquantaine de nouveau-nés ont été ainsi contaminés à La Réunion[30],[31], dont certains présentent des séquelles neurologiques[32]. L’infection est apparue de J3 à J7 après la naissance, avec des manifestations neurologiques, une thrombopénie, avec 70 % de PCR positive, 50 % de nouveau-nés symptomatiques et pas d’admission en réanimation pour méningo-encéphalites néonatales[33]. D’importantes lésions sont visualisées en IRM. Il n’a pas été observé à ce jour de malformations physiques. La césarienne ne semble pas avoir une action protectrice vis-à-vis de l’infection de l’enfant, sauf en cas de lésions bulleuses vulvaires chez la mère. Il s’agit d’une transmission per partum, les cellules placentaires étant infectées.
En matière d’allaitement maternel, et bien que les premières études n’aient pas permis de retrouver le virus dans le lait, il est préconisé par principe de précaution pendant la période de virémie, de tirer le lait et de le porter à ébullition ou de le jeter transitoirement.
Taux de mortalité
[modifier | modifier le code]Le taux de mortalité moyen est, selon l'Agence de la santé publique du Canada, évalué à « 0,4 % (2,8 % chez les enfants et 1,6 % chez les personnes âgées) »[34]. La Haute Autorité de santé, dans un document de janvier 2013, mentionne que la « mortalité du chikungunya est estimée à 1 pour 1000 »[35].
Diagnostic et physiopathologie
[modifier | modifier le code]Diagnostic différentiel
[modifier | modifier le code]Les premiers symptômes peuvent faire penser à une crise de paludisme ou de grippe, ou de leptospirose, ou à une septicémie, une méningite, etc. Le chikungunya est une maladie qui présente des similitudes avec la dengue : douleurs musculaires et articulaires, forte fièvre, maux de tête, éruption sur la peau…
Biologie
[modifier | modifier le code]La virémie, c’est-à-dire la période de présence du virus dans le sang et donc de transmission possible, s’étale pendant cette période pendant laquelle le génome viral peut être mis en évidence dans l'organisme par RT-PCR. Les anticorps immunoglobulines M (IgM) apparaissent vers le 5e jour de la maladie et persistent plusieurs mois. Les IgM sont assez peu spécifiques et des faux positifs sont dus à des mécanismes de stimulation polyclonale par d'autres maladies infectieuses. Puis, apparaissent les IgG à partir du 15e jour, qui durant plusieurs années, voire décennies, sont spécifiques du chikungunya (anticorps dirigés contre les protéines de la membrane du virus) et protecteurs. L’immunité est donc estimée acquise à vie, ce qui signifie en l'état actuel des connaissances qu'une personne ayant eu le chikungunya ne peut être atteinte une deuxième fois.
Physiopathologie
[modifier | modifier le code]En 2013, a été mis en évidence un facteur cellulaire humain impliqué dans la réplication du virus qui rend compte de la spécificité d’espèce de ce virus[36]. Ainsi sont précisées les bases moléculaires de l’infection par le virus Chikungunya.
Précautions et traitement
[modifier | modifier le code]Traitement préventif
[modifier | modifier le code]
La protection individuelle s'appuie sur le port de vêtements longs et clairs et l'usage de lotions répulsives tôt le matin et en fin de journée, mais celles-ci ont une durée d'efficacité limitée (4 à 8 heures selon les produits), la moustiquaire imprégnée de répulsifs, la pose de grillages sur les ouvertures des maisons. En raison de la très forte virémie pendant la maladie (jusqu'à 1012 copies de virus par millilitre de sang chez le malade pendant la première semaine de la maladie), il faut également insister sur la nécessité d'isoler les malades (confinement à domicile, répulsifs…), afin de limiter la propagation de la maladie via les moustiques. En effet, en période épidémique, c'est l'homme malade qui constitue le réservoir principal de virus et qui contribue donc au développement ultérieur de l'épidémie.
Outre la lutte individuelle contre les piqûres de moustique, la seule véritable prévention à ce jour[37] consiste donc à combattre la reproduction et la prolifération des moustiques par élimination des gîtes larvaires d'eau stagnante par exemple les vases des cimetières, les bâches des piscines, les récipients abandonnés, les gouttières, les pneus entreposés à l'extérieur, les déchets. Aedes albopictus, moustique vecteur du chikungunya est très lié aux activités humaines.
Le chikungunya fait partie de la liste des maladies à déclaration obligatoire en France métropolitaine, aux Antilles, dans le Pacifique français, et à la Réunion depuis le 19 décembre 2008[38]. Il ne suffit pas de se protéger soi-même, il faut aussi penser à la communauté. Il existe pour ce faire un dispositif de surveillance à l'INVS et un site consacré au signalement des moustiques tigres observés en métropole[39].
Vaccination
[modifier | modifier le code]Un vaccin expérimental a été développé par le United States Army Medical Research Institute of Infectious Diseases (en)[40]. La souche vaccinale (souche thaïlandaise datant de 1962 atténuée par passages successifs sur cellule Vero de singes), a été cédée par l'Institut de recherche de l'armée des États-Unis à l'INSERM, mais n’a pu être requalifiée en raison de l’impossibilité de satisfaire aux exigences actuelles en matière de produits sanitaires en France[réf. nécessaire] et a donc été abandonnée[41]. Plusieurs équipes travaillent sur d’autres candidats vaccins :
- juin 2014 : candidat vaccin français développé par l’Institut Pasteur[42],[43] en utilisant le vaccin de la rougeole comme support. Un premier essai clinique sur l’homme, mené en 2013 sur 42 volontaires sains par la société autrichienne Themis Bioscience qui a acheté la licence, a démontré son innocuité et « sa capacité à induire une immunité sur le long terme », selon le Pr Philippe Desprès qui a participé à l'élaboration du vaccin mis au point par l'équipe de génomique virale et vaccination dirigée par Frédéric Tangy. Ce candidat vaccin va désormais devoir être testé en zone endémique. Les recherches portent également sur un vaccin pédiatrique qui pourrait être utilisée dès l'âge de 9 mois ;
- août 2014 : un candidat vaccin américain[44] à pseudo-particules virales (VLP) a été testé sur 25 volontaires sains ayant reçu trois injections du vaccin, dans le cadre d'un essai clinique de phase 1, c’est-à-dire destiné à tester l’innocuité du vaccin. Les volontaires ont pour la plupart d’entre eux développé une réponse immunitaire dès la première injection avec une bonne tolérance vaccinale. Après la seconde injection, tous ont développé d’importants niveaux d'anticorps. « Onze mois après la vaccination, les niveaux d’anticorps étaient comparables à ceux observés chez des personnes ayant récupéré après une infection par le chikungunya, ce qui semble indiquer que le vaccin VLP pourrait assurer une protection à long terme contre le virus[réf. souhaitée] », selon le Dr Julie Ledgerwood du National Institute of Health américain ;
- Scott C. Weaver, Université du Texas, et son équipe ont publié en janvier 2014, dans la revue Journal of Infectious Diseases, l'existence d'un vaccin efficace en une seule dose chez le macaque, qui avait été fabriqué à partir d'un virus du chikungunya génétiquement très atténué[45] ;
- les Suédois de l'Institut Karolinska, alliés à des chercheurs français, ont publié avec la même approche, un vaccin qui protège les souris dans la revue Journal of Virology[46] ;
- une équipe espagnole et une équipe néerlandaise ont fait état de résultats prometteurs chez la souris avec un vaccin composé de particules formées par des protéines du virus produites en masse[47],[48].
Premier vaccin commercialisé
[modifier | modifier le code]En juillet 2021, la FDA américaine accorde le statut de « breakthrough therapy » au vaccin VLA1553 développé par le laboratoire franco-autrichien Valneva SE. Un mois plus tard, l'étude pivot de phase III annonce un taux d'efficacité de 98,9% pour ce candidat vaccin[49]. En novembre 2023, le vaccin est autorisé à la mise sur le marché par la Food and Drug Administration (FDA). Commercialisé sous le nom de « Ixchiq », il s'agit du premier vaccin au monde. Ce vaccin est destiné aux personnes de 18 ans et plus qui ont un risque accru d'être exposées au virus[50].
Traitement curatif
[modifier | modifier le code]Il n’existe pas de traitement anti-viral spécifique et le traitement reste donc purement symptomatique.
Ex vivo, la chloroquine (Nivaquine) s'est montrée efficace sur le virus mais pas in vivo chez l'être humain[51] lors des essais cliniques menés à La Réunion en fin d’épidémie de 2006 en population générale. Le traitement à la chloroquine sur l'humain a montré un effet paradoxal en augmentant l’infection au virus du chikungunya[52]. La chloroquine s’est également montrée inefficace sur le modèle animal (Macaca fascicularis) testé au CEA.
En 2014, le traitement reste donc uniquement symptomatique : antalgiques non salicylés, dont le paracétamol puis les anti-inflammatoires non stéroïdiens dans le respect des contre-indications (enfant de moins de trois mois, grossesse), corticoïdes à doses rapidement dégressives dans les formes chroniques invalidantes, avec parfois rebond en deçà d’un certain seuil. Les formes rhumatismales chroniques invalidantes répondent au traitement par méthotrexate ou aux anti-TNF alpha.
Traitement en milieu de réanimation pour les formes les plus graves : ventilation mécanique, épuration extra-rénale, amines pressives.
La ribavirine est un médicament anti-viral et semble réduire l'importance ou la durée des manifestations de l'infection[53]. L'interféron-alpha possède une activité antivirale in vitro[54] mais n'a pas été testé chez l'être humain.
Historique
[modifier | modifier le code]Premiers cas identifiés en Afrique en 1952
[modifier | modifier le code]Le chikungunya n’est pas une maladie nouvelle. Le virus a été isolé pour la première fois en 1952-1953 lors d'une épidémie de fièvre qui sévissait sur le plateau du Makonde dans la province de Newala au Tanganyika (actuelle Tanzanie)[55] mais il est possible que quelques épidémies de dengue soient en réalité conséquence du CHIKV[56]. La maladie est responsable d'affections sévissant sous forme endémique en zones rurales d'Afrique subtropicale, et sous forme épidémique dans des populations immunologiquement naïves, en particulier urbaines, aussi bien en Afrique qu'en Asie du sud (Inde, Viêt Nam).
Epidémies suspectées de chikungunya antérieures à 1952
[modifier | modifier le code]Des épidémies de chikungunya antérieures à 1952 ont pu être identifiées rétrospectivement à la lumière des connaissances actuelles de la maladie. Ainsi, Carey a avancé que certaines épidémies attribuées au virus de la dengue, étaient en fait des épidémies de chikungunya : Le Caire et Batavia-Jakarta en 1779, Zanzibar en 1823 et 1870, l'Inde en 1823, 1824-1825 et 1871-1872, Hong Kong, la Birmanie (actuel Myanmar) et Madras en 1901-1902. La réattribution rétrospective de ces épidémies au virus chikungunya repose d'une part sur la coexistence des virus de la dengue et du chikungunya dans ces régions, et d'autre part sur les descriptions faisant état de douleurs articulaires et de complications à type d'arthrite plus compatibles avec une fièvre chikungunya qu'avec une dengue.
Le tableau clinique évocateur avait déjà été documenté, dominé par une fièvre élevée comme celle de la dengue (dengue et chikungunya ont souvent été confondues) associée à des douleurs articulaires invalidantes et parfois une éruption cutanée. Mais il y a des formes sévères ignorées jusque-là : des hépatites fulminantes, des attaques du muscle cardiaque, des méningo-encéphalites… De nombreux autres togavirus du genre alphavirus et appartenant au complexe de la Semliki Forest, comme Ross River, O'nyong-nyong, Sindbis et Mayaro sont associés à des symptômes similaires[57].
Foyers asiatiques et africains
[modifier | modifier le code]Deux principaux foyers de chikungunya sont dénombrés : l’un asiatique, qui frappe régulièrement Java, l’Asie du sud-est (Thaïlande, Vietnam, Birmanie, Malaisie, Laos et Cambodge), et l'Inde (près de 1,3 million de personnes infectées[58]), l’autre africain. l’Institut de veille sanitaire (InVS), a publié un bilan épidémiologique mondial[59] sur le Chikungunya (Bilan à fin 2011-Mise à jour juin 2012). Ce bilan reprend notamment une synthèse sur les épidémies documentées en Afrique, dans l’océan indien et le sous-continent indien, et en Asie du sud-est.
Épidémie de chikungunya à La Réunion en 2005, puis en 2009 et 2010
[modifier | modifier le code]Le Centre national de référence sur les arbovirus de l'Institut Pasteur a identifié dès le mois de mai 2005 le virus à La Réunion. Le premier cas y a été enregistré le 22 février. Fin novembre, 4 500 personnes étaient contaminées. En date d'avril 2006, le virus du chikungunya infectait plus de 244 000 personnes, soit un tiers de la population de l’île, avec 203 décès[60], avec près de 120 000 nouveaux cas rien que pour le début de l'année 2006. Le vecteur principal identifié est Aedes albopictus.
La Réunion n’a d’ailleurs pas été la seule île touchée dans cette région. Le chikungunya a fait son apparition aux Comores en juillet 2004. Le nord de Madagascar, Maurice, les Seychelles et Mayotte, avec plus de 5 000 cas officiellement déclarés, ne sont pas épargnés, même si les médias s'en font peu l'écho (si les chiffres annoncés à la Réunion sont proches de la réalité, de sérieux doutes peuvent être émis concernant les 4 autres régions précitées). Les maladies importées dépassent les 1 000 cas[61] entraînant un risque de dissémination s'il existe un insecte vecteur. En , trois nouveaux cas sont identifiés à Saint-Gilles-les-Bains sur l'île de la Réunion[62]. Par la suite, l’année 2010 a été marquée par la résurgence du chikungunya à La Réunion avec le premier foyer d’importance depuis 2006 (150 cas).
Épidémie dans les départements français d’Amérique en 2014
[modifier | modifier le code]Le chikungunya s’est implanté dans les départements français d’Amérique, aux Antilles à la fin 2013, avec des cas autochtones[63]. Les premiers cas ont été identifiés à Saint-Martin, l’Institut de veille sanitaire (InVS) commence à éditer des bulletins hebdomadaires sur la situation épidémiologique du chikungunya dans les Antilles à partir du 11 décembre 2013 (les bulletins sont archivés sur le site de l’InVS[64]). L’InVS a placé successivement en phase épidémique Saint-Martin dès le 6 décembre 2013, puis la Martinique le 23 janvier 2014 et enfin la Guadeloupe le 19 avril 2014[65],[66],[67]. La Guyane a été placée en situation de circulation autochtone modérée le 19 février 2014. La répartition est la suivante selon un point de l’Institut de veille sanitaire (InVS) au 28 juillet 2014[68],[69] :
- Guyane : 881 cas probables ou confirmés depuis la mi-décembre 2013 et jusqu’au 13 juillet 2014 ; la situation épidémiologique correspond à la phase 2b du programme de surveillance d'alerte et de gestion des épidémies (Psage) : transmission autochtone modérée avec foyers épidémiques et chaînes de transmission localisées ;
- Guadeloupe : 69 740 cas cliniquement évocateurs depuis la mi-décembre 2013 et jusqu’au 13 juillet 2014, intensification de l’épidémie en Guadeloupe à partir de la fin du mois de mai. 7 décès ont été enregistrés parmi les cas biologiquement confirmés hospitalisés dont un seul classé comme directement lié au chikungunya. La Guadeloupe est en phase 3b du Psage : épidémie généralisée avec une tendance à la stabilité sur les dernières semaines.
- Martinique : 52 560 cas cliniquement évocateurs. 19 décès indirectement liés à l’infection ont été enregistrés parmi les patients hospitalisés avec une confirmation biologique. D’autre part, 16 certificats de décès avec mention chikungunya dans l’une des causes de décès ont été comptabilisés pour des personnes décédées à domicile ou en maison de retraite. La Martinique est en phase 3b du Psage : épidémie généralisée avec une tendance à la stabilité voire à la baisse qui reste à confirmer au cours des prochaines semaines.
- Saint-Martin : 3 760 cas cliniquement évocateurs, trois décès, tous indirectement liés au chikungunya. Saint-Martin est en phase 2 du Psage : transmission virale modérée ;
- Saint-Barthélémy : 800 cas cliniquement évocateurs. Saint Barthélemy est en phase 2 du Psage : transmission virale modérée ;
- Polynésie française : 1 cas importé déclaré le 29 mai 2014[70]. La Polynésie avait déjà connu une épidémie de dengue et de zika au cours des mois précédents. L'épidémie prend de l'ampleur et le bureau de veille sanitaire de Polynésie annonce le 14 novembre que plus de 5 000 cas sont déjà répertoriés et que l'épidémie ne fait que commencer[71]. Le 21 novembre, les autorités locales annoncent les deux premiers décès à la suite de l'épidémie[72]. L'épidémie s'étend très rapidement : le 1er décembre, l'autorité sanitaire polynésienne annonce que 18 352 cas ont été recensés[73].
Généralisation de l'épidémie à l’ensemble du continent américain
[modifier | modifier le code]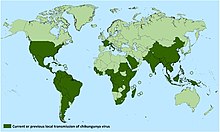
La situation épidémiologique dans les îles non françaises des caraïbes communiquée par la PAHO (Pan American Health Organization) et les autorités sanitaires locales pour la semaine 1430 (21 au 27 juillet 2014) fait apparaître une situation épidémique établie en Haïti, en République Dominicaine, ainsi qu’à la Dominique. Une situation épidémique émergente est suspectée à Porto Rico avec 241 cas autochtones recensés et une situation réelle probablement pire. La quasi-totalité des autres îles des petites et des grandes Antilles a connu des cas importés et redoute l'établissement d'une épidémie.
Le 22 juillet 2014, le premier cas autochtone a officiellement été déclaré aux États-Unis, avec déjà 79 cas confirmés en laboratoire en Floride, 302 sur l’ensemble du territoire des États-Unis, et de nombreux cas évocateurs. Les inquiétudes liées au développement d'une épidémie ont conduit les autorités à ajouter le chikungunya à la liste des maladies à déclaration obligatoire[74].
La situation épidémiologique en Amérique centrale, du nord et du sud communiquée par la PAHO et les autorités sanitaires locales pour la semaine 1430 (21 au 27 juillet 2014) plaçait la quasi-totalité des pays d'Amérique centrale et d'Amérique du Sud comme désormais concernés par des cas importés de chikungunya. La liste des pays avec des cas autochtones s’allonge : le Salvador compte déjà 1 969 cas locaux recensés[réf. nécessaire], après la Guyane, le Suriname, le Guyana, le Venezuela et même la Colombie[75] sont désormais concernés par des cas locaux. Présence de moustiques vecteurs (Aedes albopictus et Aedes aegypti), multiplication des cas importés et des cas locaux, tous les ingrédients sont là pour alimenter les craintes d'une épidémie s'étendant à tout l’ensemble du continent américain.
Présence du virus chikungunya en France en Europe
[modifier | modifier le code]Le premier foyer européen est identifié durant l'été 2007. Le 30 août 2007, les autorités sanitaires italiennes informent leurs homologues européennes qu’une centaine de cas d’infection à virus chikungunya sont à déplorer dans le nord-est de l'Italie (district de Ravenne, région d'Émilie-Romagne), information relayée par le ministère français de la Santé[76],[77]. À ce stade, le nombre de nouveaux cas hebdomadaires décroît selon ces mêmes autorités.
Des cas de chikungunya autochtones, c’est-à-dire acquis sur place et non importés ont été pour la première fois détectée sur le territoire métropolitain français le 25 septembre 2010, dans le Var[78]. Un deuxième cas a été détecté, le lendemain, à Fréjus, toujours dans le Var[79].
Multiplication des cas importés, risque d’épidémie en France en 2014 à la suite de l'épidémie dans les départements français d'Amérique
[modifier | modifier le code]Selon l’InVS, aucun cas autochtone n'a encore été confirmé en juillet 2014, mais le nombre important de cas importés de chikungunya en France métropolitaine représente un défi pour la surveillance et l’intervention. « Pendant l'été 2014, toutes les conditions sont réunies pour une transmission autochtone du virus du chikungunya » dans les 18 départements du sud de la France métropolitaine pour une transmission du virus du chikungunya et, dans une moindre mesure, du virus de la dengue : « un vecteur compétent, Aedes albopictus, et un grand nombre de voyageurs revenant des départements français d’Amérique où sévit une épidémie de chikungunya »[80]. La France est le pays le plus touché avec 475 cas importés entre le 1er novembre 2013 et juillet 2014, dont 126 biologiquement confirmés du 1er mai au 4 juillet 2014 dans les 18 départements de France métropolitaine colonisée par Ae. albopictus et placés en surveillance renforcée (2 avaient été biologiquement confirmés en 2011 et 6 en 2012 sur la même période). Un plan anti-dissémination du chikungunya et de la dengue en métropole a été mis en place le 29 avril 2014[81]. Pendant l’été 2014, période d’activité du moustique en métropole, un grand nombre de voyageurs en provenance des Antilles va venir en France métropolitaine. Certains de ces voyageurs pourraient être en phase virémique au moment de leur arrivée, augmentant la probabilité de survenue de cas autochtones de chikungunya dans les départements colonisés par Stegomyia albopicta et rendant ainsi réel le risque d’épidémie de chikungunya en France métropolitaine ». Les services de santé espèrent « éviter l'instauration d'un cycle de transmission autochtone du chikungunya en France métropolitaine et, au-delà, dans d'autres zones en Europe où des vecteurs compétents sont également présents ».
De nombreux cas de chikungunya importé en Europe en 2014
[modifier | modifier le code]L’Espagne, l’Italie, la Suisse et l’Allemagne commencent pendant l’été à compter en dizaines le nombre de cas importés.
Coût d’une épidémie de chikungunya
[modifier | modifier le code]L’épidémie réunionnaise a permis de mieux cerner le coût d’une épidémie[82]. La Caisse générale de Sécurité sociale de la Réunion a relevé une augmentation de 6,5 % des dépenses de l’Assurance Maladie en 2006 par rapport à 2005. Dans une étude parue en 2011, les coûts directs et indirects de l’épidémie de chikungunya de 2005-2006 sont estimés à 43,9 millions €, soit 117 € par patient externe et 2 000 € par patient hospitalisé (coût moyen : 1 370 €). Soixante pour cent des coûts sont directement attribués aux frais médicaux (consultations, hospitalisations, tests biologiques et médicaments). L’absentéisme attribué à l’épidémie a été évalué à 112 400 journées de travail de 12 800 sujets soit un coût de 17,4 millions €. Cependant, cette étude n’a pas pris en compte les dépenses liées aux manifestations tardives et chroniques de la maladie et les conséquences économiques indirectes de l’épidémie : fléchissement du tourisme, de la restauration et de l’hôtellerie, des activités… Néanmoins, cette étude permet d'éclairer sur le rapport coût-bénéfice des programmes de surveillance, de prévention et de contrôle des arboviroses.
Notes et références
[modifier | modifier le code]- Sources : Houghton Mifflin et Dr Gerald Eder L'affection se propagea si rapidement, au sein et à la périphérie des villages durant la saison des pluies de juillet jusqu'à février, qu'elle fut nommée par les villageois chikungunya, terme de la langue makondé, trouvé pour la première fois dans une publication anglaise en 1954. Le makondé est une langue bantoue parlée au sud de la Tanzanie et au nord du Mozambique. La langue nationale de la Tanzanie étant le swahili, langue bantoue également, la plupart des articles qui paraissent donnent par erreur le swahili comme langue d'origine du mot.
- (en) Powers AM, Brault AC, Tesh RB, Weaver SC. « Re-emergence of chikungunya and o'nyong-nyong viruses: evidence for distinct geographical lineages and distant evolutionary relationships » J Gen Virol. 2000;81:471-9.
- (en) Tsetsarkin KA, Vanlandingham DL, McGee CE, Higgs S. « A single mutation in chikungunya virus affects vector specificity and epidemic potential » PLoS Pathog. 2007;3:1895-1906. .
- (en) Sangita Venkataraman, Burra V L S Prasad et Ramasamy Selvarajan, « RNA Dependent RNA Polymerases: Insights from Structure, Function and Evolution », Viruses, (lire en ligne)
- (en) Burt FJ, Rolph MS, Rulli NE, Mahalingam S, Heise MT, Chikungunya: a re-emerging virus, Lancet, 2012;379:662-671.
- (en) Inoue S1, Morita K, Matias RR, Tuplano JV, Resuello RR, Candelario JR, Cruz DJ, Mapua CA, Hasebe F, Igarashi A, Natividad FF, « Distribution of three arbovirus antibodies among monkeys (Macaca fascicularis) in the Philippines », J Med Primatol, vol. 32, no 2, , p. 89-94 (PMID 12823631)
- (en) Marchette NJ, Halstead SB, « Phytohemagglutinin enhancement of dengue-2 virus replication in nonimmune rhesus monkey peripheral blood leukocytes », Infect Immun, vol. 19, no 1, , p. 40-5 (PMID 203535, PMCID PMC414045, lire en ligne [html])
- (en) Kaschula VR, Van Dellen AF, de Vos V, « Some infectious diseases of wild vervet monkeys (Cercopithecus aethiops pygerythrus) in South Africa », J S Afr Vet Assoc, vol. 49, no 3, , p. 223-7. (PMID 218005)
- (en) Wolfe ND, Kilbourn AM, Karesh WB, Rahman HA, Bosi EJ, Cropp BC, Andau M, Spielman A, Gubler DJ, « Sylvatic transmission of arboviruses among Bornean orangutans », Am J Trop Med Hyg, vol. 64, nos 5-6, , p. 310-6. (PMID 11463123, lire en ligne [PDF])
- (en) Sixl W, Stünzner D, Withalm H, « Serological examinations for antibodies against West Nile virus, Semlikivirus and chikungunyavirus in laboratory mice, parasitized by nidicole fauna from swallow's nests », Geogr Med Suppl, no 1, , p. 51-5. (PMID 3139492)
- (ru)(en) Sidenko VP, Stepankovskaia LD, Solomko RM, Poliakov EM, Grekov VS, « [Results of a study of West Nile fever in the South of the European part of the USSR] », Zh Mikrobiol Epidemiol Immunobiol, vol. 00, no 5, , p. 129. (PMID 4454878)
- Renaudet J, Jan C, Ridet J, Adam C, Robin Y, « [A serological survey of arboviruses in the human population of Senegal] », Bull Soc Pathol Exot Filiales, vol. 71, no 2, , p. 131-40. (PMID 33772)
- (en) Olaleye OD, Oladosu LA, Omilabu SA, Baba SS, Fagbami AH, « Complement fixing antibodies against arboviruses in horses at Lagos, Nigeria », Rev Elev Med Vet Pays Trop, vol. 42, no 3, , p. 321-5. (PMID 2485538)
- Konstantinov OK, « Les tiques de la famille Ixodidae comme réservoir d'arbovirus en République de Guinée. II. Les arbovirus [Ticks of the Ixodidae family as reservoir of arboviruses in the Republic of Guinea. II. Arboviruses] », Rev Elev Med Vet Pays Trop, vol. 43, no 1, , p. 15-22 (PMID 2263738, résumé)
- (en) Le Goff G, Brengues C & Robert V « Stegomyia mosquitoes in Mayotte, taxonomic study and description of Stegomyia pia n. sp. » Parasite, 2013;20:31. http://www.parasite-journal.org/articles/parasite/pdf/2013/01/parasite130032.pdf
- (en) Bandyopadhyay D, Ghosh SK, Mucocutaneous features of Chikungunya fever: a study from an outbreak in West Bengal, India, Int J Dermatol, 2008;47:1148-1152
- (en) Borgherini G, Poubeau P, Staikowsky F et al. Outbreak of chikungunya on Reunion Island: early clinical and laboratory features in 157 adult patients, Clin Infect Dis, 2007;44:1401-1407
- (en) Sissoko D, Moendandze A, Denis Malvy et al. « Seroprevalence and risk factors of chikungunya virus infection in Mayotte, Indian Ocean, 2005—2006: a population-based survey » PLoS One 2008;3:e3066
- Fabrice SIMON, « Manifestations chroniques des arboviroses », CEMI 17 : ACTUALITES SUR LES ARBOVIROSE, Institut Pasteur, 15 et 16 mars 2012, p. 33 (lire en ligne)
- (en) Sissoko D, Denis Malvy, Ezzedine K et al. « Post-epidemic Chikungunya disease on Reunion Island: course of rheumatic manifestations and associated factors over a 15-month period » PLoS Negl Trop Dis. 2009;3:e389
- (en) Hoarau JJ, Jaffar-Bandjee MC, Kreijbich TP et al. « Persistent chronic inflamation and infection by Chikungunya arthritogenic alphavirus in spite of a robust host immune response » J Immunol. 2010;184:5914-5927
- (en) Soumahoro MK, Gérardin P, Boëlle PY et al. « Impact of Chikungunya virus infection on health status and quality of life: a retrospective cohort study » PLoS One 2009;4:e7800
- Gaüzère B-A, Bohrer M, Drouet D, Gasque Ph, Jaffar-Bandjee MC, Filleul L, Vandroux D. « Infection à virus Chikungunya à La Réunion en 2005-2006 : formes graves “émergentes” de l’adulte en service de réanimation » Réanimation 2011;20:211-222. Résumé
- (en) Lemant J, Boisson V, Winer A, Thibault L, André H, Tixier F, Lemercier M, Antok E, Cresta MP, Grivard P, Besnard M, Rollot O, Favier F, Huerre M, Campinos JL, Michault A, « Serious acute chikungunya virus infection requiring intensive care during the Reunion Island outbreak in 2005-2006 », Crit Care Med, vol. 36, no 9, , p. 2536-41 (PMID 18679124, DOI 10.1097/CCM.0b013e318183f2d2)
- (en) Rampal M, Sharda M, Meena H. « Neurological complications in Chikungunya fever » J Assoc Physicians India 2007;55:765-769
- (en) Wielanek AC, Monredon JD, Amrani ME, Roger JC, Serveaux JP. « Guillain-Barre syndrome complicating a Chikungunya virus infection » Neurology 2007;69:2105-2107.
- Singh SS, Manimunda SP, Sugunan AP, Sahina, Vijayachari P, Four cases of acute flaccid paralysis associated with chikungunya virus infection, Epidemiol Infect, 2008;136:1277-1280
- I Obeyesekere et Y Hermon, « Myocarditis and cardiomyopathy after arbovirus infections (dengue and chikungunya fever). », British Heart Journal, vol. 34, no 8, , p. 821–827 (ISSN 0007-0769, PMID 4262698, lire en ligne, consulté le )
- (en-US) « Mother to Baby during Pregnancy, Delivery, or Breast Feeding | West Nile Virus | CDC », sur cdc.gov, (consulté le ).
- (en) Fritel X, Rollot O, Gerardin P, Gauzere BA, Bideault J, Lagarde L, Dhuime B, Orvain E, Cuillier F, Ramful D, Samperiz S, Jaffar-Bandjee MC, Michault A, Cotte L, Kaminski M, Fourmaintraux A; Chikungunya-Mere-Enfant Team. Chikungunya virus infection during pregnancy, Reunion, France, 2006. Emerg Infect Dis. 2010 Mar;16(3):418-25.
- (en) Gérardin P, Barau G, Michault A, Bintner M, Randrianaivo H, Choker G, Lenglet Y, Touret Y, Bouveret A, Grivard P, Le Roux K, Blanc S, Schuffenecker I, Couderc T, Arenzana-Seisdedos F, Lecuit M, Robillard PY. Multidisciplinary prospective study of mother-to-child chikungunya virus infections on the island of La Réunion. PLoS Med. 2008 Mar 18;5(3):e60
- Boumahni B, Bintner M. Five-year outcome of mother-to-child transmission of chikungunya virus. Med Trop (mars). 2012 Mar;72 Spec No:94-6.
- Pellot AS, Alessandri JL, Robin S, Sampériz S, Attali T, Brayer C, Pasquet M, Jaffar-Bandjee MC, Benhamou LS, Tiran-Rajaofera I, Ramful D. Severe forms of chikungunya virus infection in a pediatric intensive care unit on Reunion Island. Med Trop (mars). 2012 Mar;72 Spec No:88-93.
- « Virus Chikungunya - Fiche technique santé-sécurité : agents pathogènes », sur phac-aspc.gc.ca, (consulté le ).
- [PDF]« Diagnostic biologique direct précoce du chikungunya par détection génomique du virus avec RT-PCR » [Rapport d'évaluation technologique], sur has-sante.fr, (consulté le ), p. 8.
- (en) Judith D, Mostowy S, Bourai M, Gangneux N, Lelek M, Lucas-Hourani M, Cayet N, Jacob Y, Prévost MC, Pierre P, Tangy F, Zimmer C, Vidalain PO, Couderc T, Lecuit M, « Species-specific impact of the autophagy machinery on Chikungunya virus infection », EMBO Rep, vol. 14, no 6, , p. 534-44 (PMID 23619093, DOI 10.1038/embor.2013.51, résumé)
- Santé publique France - InVS, « Points sur les connaissances / Chikungunya / Maladies à transmission vectorielle / Maladies infectieuses / Dossiers thématiques / Accueil », sur invs.santepubliquefrance.fr (consulté le ).
- décret du 19 décembre 2008
- « site de signalement du moustique tigre. », sur signalement-moustique.anses.fr (consulté le ).
- (en) Edelman R, Tacket CO, Wasserman SS, Bodison SA, Perry JG, Mangiafico JA, « Phase II safety and immunogenicity study of live chikungunya virus vaccine TSI-GSD-218 » Am J Trop Med Hyg. 2000;62:681-5.
- Bernard-Alex Gaüzère, « L’infection à virus chikungunya dans l’océan Indien : quelles leçons ? », Revue Francophone des Laboratoires, vol. 2011, no 431, , p. 67–77 (ISSN 1773-035X, DOI 10.1016/s1773-035x(11)70903-0, lire en ligne, consulté le )
- Interview de Philippe Desprès de l’unité Interactions Moléculaires Flavivirus-Hôtes de l’Institut Pasteur - Themis Bioscience, 6 juin 2014 – CDC d’Atlanta, 8 août 2014
- « Espace presse | Fiches info | chikungunya », sur pasteur.fr, (consulté le ).
- (en) « Safety and tolerability of chikungunya virus-like particle vaccine in healthy adults: a phase 1 dose-escalation trial », The Lancet, vol. 384, no 9959, , p. 2046–2052 (ISSN 0140-6736, DOI 10.1016/S0140-6736(14)61185-5, lire en ligne, consulté le )
- (en) C. J. Roy, A. P. Adams, E. Wang et K. Plante, « Chikungunya Vaccine Candidate Is Highly Attenuated and Protects Nonhuman Primates Against Telemetrically Monitored Disease Following a Single Dose », Journal of Infectious Diseases, vol. 209, no 12, , p. 1891–1899 (ISSN 0022-1899, DOI 10.1093/infdis/jiu014, lire en ligne, consulté le )
- (en) David Hallengärd, Maria Kakoulidou, Aleksei Lulla et Beate M. Kümmerer, « Novel Attenuated Chikungunya Vaccine Candidates Elicit Protective Immunity in C57BL/6 mice », Journal of Virology, vol. 88, no 5, , p. 2858–2866 (ISSN 0022-538X et 1098-5514, PMID 24371047, DOI 10.1128/JVI.03453-13, lire en ligne, consulté le )
- Juan García-Arriaza, Victoria Cepeda, David Hallengärd et Carlos Óscar S. Sorzano, « A Novel Poxvirus-Based Vaccine, MVA-CHIKV, Is Highly Immunogenic and Protects Mice against Chikungunya Infection », Journal of Virology, vol. 88, no 6, , p. 3527–3547 (ISSN 0022-538X, PMID 24403588, PMCID PMC3957920, DOI 10.1128/JVI.03418-13, lire en ligne, consulté le )
- « Le franco-autrichien Valneva évoque des résultats positifs pour son vaccin contre le chikungunya », L'usine nouvelle, (lire en ligne, consulté le )
- « Les Etats-Unis autorisent le premier vaccin contre le chikungunya », sur Les Echos, (consulté le )
- (en) de Lamballerie X, Boisson V, Reynier JC. et al. « On chikungunya acute infection and chloroquine treatment » Vector Borne Zoonotic Dis. 2008;8:837-9.
- (en) de Roques P., Thiberville SD., Dupuis-Maguiraga L., Lum FM., Labadie K., Martinon F., Gras G., Lebon P., Ng LFP., de Lamballerie X., Le Grand R. « Paradoxical Effect of Chloroquine Treatment in Enhancing Chikungunya Virus Infection. » Vector Borne Zoonotic Dis. 2008;.
- (en) Ravichandran R, Manian M, « Ribavirin therapy for Chikungunya arthritis » J Infect Dev Ctries 2008;2:140-2.
- (en) Briolant S, Garin D, Scaramizzino N, Jouan A, Crance JM, « In vitro inhibition of Chikungunya and Semliki Forest viruses replication by antiviral compounds: synergistic effect of interferon-alpha and ribavirin combination » Antiviral Res. 2004;61:111-7.
- Robinson MC, An epidemic of virus disease in Southern Province, Tanganyika Territory, in 1952-53—1: Clinical features, Trans R Soc Trop Med Hyg, 1955;49:28
- Carey DE, Chikungunya and dengue: a case of mistaken identity, J Hist Med Allied Sci, 1971;26:243-262
- Source : lionel.suz.free.fr
- (en) Failure to control mosquitoes has led to two fever epidemics in India, Ganapati Mudur, BMJ 2006;333:773
- CIRE Département international, « Le chikungunya Bilan épidémiologique Monde (Bilan à fin 2011-Mise à jour juin 2012) » [PDF], sur invs.sante.fr.
- Renault P, Solet J-L, Sissoko D. et al. « A major epidemic of chikungunya virus infection on Reunion Island, France, 2005—2006 » Am J Trop Med Hyg. 2007;77:727-31.
- (en) Rémi N. Charrel, Xavier de Lamballerie, Didier Raoult, « Chikungunya outbreaks — The globalization of vectorborne diseases » New En g J Med. 2007;356:769-71.
- « Le chikungunya est de retour », Le Quotidien de La Réunion, (lire en ligne)
- (en) « Chikungunya », sur paho.org : « PAHO / WHO received on December 6, 2013 the confirmation of the first cases of autochthonous transmission of Chikungunya virus in the Americas. ».
- « Situation épidémiologique du chikungunya dans les Antilles. Points hebdomadaires. », sur invs.sante.fr.
- [1]
- Chikungunya : une lente intensification "Le dernier point épidémiologique indique que l'épidémie de chikungunya continue de s'étendre. Des cas ont été relevés dans 18 communes." - FranceAntilles - 8 février 2014
- Boris Colombet, « Chikungunya : deux nouveaux cas confirmés », sur guadeloupe.franceantilles.fr, France-Antilles, (consulté le ).
- « Situation épidémiologique du chikungunya dans les Antilles. Point au 20 juin 2014. », sur invs.sante.fr, .
- CIRE Antilles Guyane, « Le chikungunya dans les Antilles-Guyane | Bulletin 14 au 27 juillet 2014 (Semaines S2014-29 et S2014-30) » [PDF], sur invs.sante.fr.
- AFP, « Premier cas de chikungunya détecté en Polynésie », sur lemonde.fr, Le Monde, (consulté le ).
- « L'épidémie de chikungunya explose en Polynésie française », Le Monde, (lire en ligne).
- http://www.lequotidiendumedecin.fr/actualite/sante-publique/chikungunya-deux-premiers-deces-en-polynesie
- 20 Minutes avec agence, « Chikungunya: 18 352 cas déclarés en Polynésie française », 20 minutes, (lire en ligne, consulté le ).
- (en) « Chikungunya: Health officials monitoring new virus spread by mosquitoes »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur news-sentinel.com : « the CDC confirmed two Floridians were the first confirmed U.S. locally-transmitted CHIKV cases, meaning they had not traveled outside the United States. Florida has had 79 confirmed cases, with 302 U.S. laboratory-confirmed cases overall as of July 22. ».
- (es) Vida/Salud, « El virus del chikunguña llegó a Colombia: ¿qué es y cómo combatirlo? : En Mahates (Bolívar) se confirmaron los primeros cuatro casos del país. Se cree que puede haber más », El Tiempo, (lire en ligne)
- Communiqué de presse : Cas groupés de Chikungunya autochtone en Italie, Ministère de la Santé, de la Jeunesse et des Sports
- Romandie :: toute l’info suisse romande :: votre multi-portails régional
- « Var: Un cas de chikungunya », sur lejdd.fr, (consulté le ).
- « Chikungunya: deuxième cas autochtone dans le Var », sur 20minutes.fr, (consulté le ).
- « Le nombre important de cas importés de chikungunya en France métropolitaine représente un défi pour la surveillance et l’intervention », sur lejdd.fr, (consulté le ).
- « Un plan anti-dissémination du chikungunya et de la dengue en métropole », sur legifrance.gouv.fr, (consulté le ).
- Soumahoro MK, Boelle PY, Gaüzere BA, Atsou K, Pelat C, Lambert B, La Ruche G, Gastellu-Etchegorry M, Renault P, Sarazin M, Yazdanpanah Y, Flahault A, Denis Malvy, Hanslik T. The Chikungunya Epidemic on La Réunion Island in 2005-2006: A Cost-of-Illness Study. PLoS Negl Trop Dis. 2011 Jun;5(6):e1197.
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- Bernard-Alex Gaüzère, Pierre Aubry, Le chik, le choc, le chèque : l'épidémie de chikungunya à la Réunion 2005-2006 en questions, Azalées Éditions, 2006 - (ISBN 2-915923-13-2)
- Jean Lombard L'épidémie moderne et la culture du malheur, petit traité du chikungunya, L'Harmattan, 2006 - (ISBN 2-296-01091-1)
- Bernard-Alex Gaüzère : Enseignement de médecine tropicale dans les pays de l’océan Indien : http://medecinetropicale.free.fr/cours/chik.pdf
Articles connexes
[modifier | modifier le code]- Épidémie de chikungunya à La Réunion
- Arthralgie (polyarthralgie)
- Maladie à virus Zika
- Épidémiologie du chikungunya (en)
Liens externes
[modifier | modifier le code]- Institut Pasteur : les souches de Chikungunya identifiées en Afrique.
- OMS : http://www.who.int/mediacentre/factsheets/fs327/fr/
- INSERM : http://www.inserm.fr/thematiques/microbiologie-et-maladies-infectieuses/dossiers-d-information/chikungunya
- Film d'animation scientifique de santé publique pour se prémunir du Chikungunya Sept 2014 (Institut de Recherche pour le Développement)
- (en) Page spécifique par les Centres pour le contrôle et la prévention des maladies (CDC), États-Unis.
