Gonorrhée

| Causes | Neisseria gonorrhoeae |
|---|---|
| Transmission | Infection sexuellement transmissible |
| Symptômes | Excrétion, douleur, douleur pelvienne (en), sécrétion vaginale, dysurie et douleur testiculaire |
| Médicament | Ceftriaxone, moxifloxacine, troléandomycine (en), probénécide, ciprofloxacine, céfixime, bacampicilline, céfuroxime, enoxacine, spectinomycine, céfotaxime, ceftizoxime, érythromycine, tétracycline, gatifloxacine, déméclocycline, DL-ofloxacine, norfloxacine, trovafloxacine, ampicilline, cefpodoxime proxétil (d), benzylpénicilline potassique (d), benzylpénicilline, benzylpénicilline sodique (d), enoxacine, cefpodoxime, norfloxacine, amoxicilline, ceftriaxone et céfixime |
|---|---|
| Spécialité | Dermatologie, urologie et gynécologie |
| CIM-10 | A54 |
|---|---|
| CIM-9 | 098 |
| DiseasesDB | 8834 |
| MedlinePlus | 007267 |
| eMedicine | 782913 |
| MeSH | D006069 |
| Patient UK | Gonorrhoea-pro |



La blennorragie[2],[3], gonorrhée[4],[5],[6] ou encore l'urétrite gonococcique[7] (aussi appelée familièrement chaude-pisse[8],[9], chaude-lance[10], castapiane[11],[12] ou chtouille[13]) est une infection sexuellement transmissible.
Cette infection touche principalement les organes génitaux et urinaires. Elle est due au gonocoque (Neisseria gonorrhoeae, découvert par Albert Neisser en 1879 dans un pus d’urétrite aiguë et isolé en 1885 par Bumm). Elle fait partie des gonococcies qui font l'objet d'un suivi par le Programme mondial de surveillance des antimicrobiens gonococciques (GASP) et a été considérée le par l'OMS comme « menace sanitaire émergente »[14] nécessitant une collaboration internationale urgente[15].
Des douleurs dans les organes génitaux, le rectum, l'anus ou la gorge sont possibles. Les complications touchent principalement les femmes (inflammations pelviennes, grossesse extra-utérine et stérilité, voire risque d'infection du cerveau ou du cœur sans traitement[16]) alors que 75 % des cas féminins sont asymptomatiques et passent donc inaperçus. Chez l’homme, la maladie est plus visible et les complications sont généralement la prostatite ou l'épididymite. La période d’incubation est habituellement de 2 à 7 jours. Une gonorrhée génitale peut secondairement faciliter la transmission du VIH.
Un des moyens de prévention primaire est le préservatif. Le traitement curatif est l'antibiothérapie, mais les souches antibiorésistantes sont de plus en plus fréquentes, y compris face aux céphalosporines (médicaments de dernier recours, dits « de troisième génération »). L'OMS a confirmé de 2014 à 2017 en Afrique du Sud, en Australie, en Autriche, au Canada, en France, au Japon, en Norvège, au Royaume-Uni, en Slovénie et en Suède des souches résistantes[17]. En 2003, l'OMS recommandait les quinolones (la ciprofloxacine notamment) comme traitement mais 3 ans plus tard (en 2006) recommandait leur abandon[16] ne laissant que les céphalosporines comme antibiotique (dont la ceftriaxone ; mais en 2016 « quarante-six pays ont déjà signalé des souches de gonorrhée moins sensibles à la ceftriaxone, et 10 pays ont signalé des cas résistants à tous les antibiotiques habituellement efficaces »[16]). Les thérapies associant plusieurs antibiotiques sont possibles mais très délicates à mettre en œuvre en attendant de nouveaux médicaments espérés pour 2020.
Histoire
[modifier | modifier le code]La gonorrhée, déjà évoquée par l'Ancien Testament (Bible)[18] a été en France décrite il y a au moins 700 ans comme présente dans les quartiers des « bordeaux »[19] ou « clapiers »[19] (bordels) de Paris, regroupant des maisons de prostitution[20] mais elle a durant des siècles été confondue avec la syphilis, avant d'en être différenciée par Jean-François Hernandez (1812)[21], Humpston (1822) [22], puis surtout par Ricord (1838).
Elle est devenue moins préoccupante pour la santé publique des années 1920 aux années 1980 (où les médecins disposaient de plusieurs antibiotiques efficaces), mais des résistances (aux sulfamides) sont signalées dès les années 1940[23], faisant à nouveau progresser la maladie notamment dans les populations pauvres (y compris aux États-Unis dans les populations pauvres et rurales par exemple[24]). La maladie redevient au début du XXIe siècle un problème grave de santé publique. En 2017, elle figure en tête de la liste des microorganismes pour lesquels l’OMS et l’initiative de l’ONG « Médicaments pour les maladies négligées » (DNDi ; Drugs for Neglected Diseases initiative) cherchent à inventer et développer de nouveaux médicaments efficaces et de meilleures techniques de prévention (peut-être à un coût moindre que par les moyens classiques de l'industrie pharmaceutique[25])[26].
Prévalence
[modifier | modifier le code]
|
|

Dans la nature, c'est une des rares maladies infectieuses qui ne semble pas zoonotique, c'est-à-dire qu'elle ne touche que l'être humain[27]. La bactérie N. gonorrhoeae utilise les molécules de porine (Por) de sa membrane externe pour se lier à une protéine humaine C4b (C4bp), ce qui lui permet de se soustraire au système immunitaire humain[27]. Des souches de N. gonorrhoeae résistant aux globules blancs du sérum humain sont rapidement attaquées et tuées par des sérums provenant de rongeurs, lagomorphes et de primates (qui eux ne peuvent que difficilement être expérimentalement infectés par cette bactérie, car elle ne peut pas chez eux se lier à la protéine C4bp)[27], ce qui complexifie la recherche quand elle passe par l'expérimentation animale par exemple pour la recherche de vaccin[28].
Le taux de gonorrhée augmente dans le monde. Et il est nettement plus élevé chez les hommes ayant des rapports sexuels avec d'autres hommes (HSH) que chez les hétérosexuels stricts[réf. nécessaire]. On sait depuis peu que la gonorrhée chez les HSH ne se transmet pas comme on le pensait auparavant. Il a été montré dans cette population que les sites d'infection asymptomatiques (pharynx et oropharynx) jouent un rôle majeur dans la persistance de la gonorrhée dans la population générale. Chez de nombreuses personnes symptomatiques, la salive, souvent utilisée comme lubrifiant lors des actes sexuels ou masturbatoires, contient généralement la bactérie responsable de la gonorrhée, alors potentiellement source d'infection ou de réinsertion. In vitro, et in vivo le bain de bouche antibactérien s'est montré capable de réduire la gonorrhée de l'oropharynx (généralement asymptomatique), et un modèle mathématique récemment publié laisse aussi penser que des bains de bouches efficaces permettraient de considérablement diminuer la prévalence de cette maladie chez les homosexuels ou bisexuels, mais « plus de recherche est nécessaire avant que ceci puisse être recommandé, même si cette suggestion s'est avérée efficace dans un essai clinique » (des bains de bouche trop fréquents pourraient aussi conduire à l'apparition de souches résistantes aux antibiotiques qu'ils contiennent, ou affecter la flore intestinale).
Tous les pays sont touchés, et le nombre de nouveaux cas augmente à nouveau dans le monde (source 2018) après une phase de diminution (il était passé de 106 millions environ en 2008 à au moins 78 millions en 2015-2017[16]. Cette maladie est en outre sous-déclarée car souvent asymptomatique (principalement chez les femmes).
Dans quelques pays dont en France, la gonococcie a reculé pour des raisons encore mal comprises ; en partie sans doute grâce aux précautions prises à la suite de l'épidémie de SIDA et grâce à un déclin qui s’était amorcé avant que le SIDA ne fût médiatisé, peut être aussi grâce à l’incitation dans les pays riches (tels que le Royaume-Uni ou le Canada) à une utilisation mieux ciblée des antibiotiques afin de limiter le risque de résistance[16]. Toutefois, le recul de l'utilisation du préservatif et le tourisme sexuel [infection de Français ayant séjourné à l'étranger] seraient encore un obstacle important à l’éradication de cette maladie en France.[réf. nécessaire]
Groupes les plus touchés
[modifier | modifier le code]Comme pour la syphilis, ce sont les jeunes et adolescents (ex : au Québec en 1980 environ 50 % des cas déclarés de syphilis et de gonorrhée chez des jeunes de 15 à 19 ans[29]) et en particulier les femmes de 16 à 24 ans et les hommes de 21 à 30 ans.
- Plus de 50 % des hommes et des femmes peuvent être des porteurs asymptomatiques de ces infections, qui sont le plus souvent localisées dans certaines parties du corps comme le rectum et le pharynx.
- Le plus souvent, les infections sont asymptomatiques (chez la femme surtout) et une infection chronique asymptomatique est possible.
- Facteurs comportementaux
Le risque de contracter cette maladie est plus élevé en cas de :
- relâche des pratiques de prévention (safer sex), constatée depuis le début des années 2000 par une augmentation des cas de gonorrhée rectale et de syphilis précoce, deux infections révélatrices d'un comportement sexuel à risque[30], et pouvant être expliqué par divers facteurs (« effet de génération, « prevention fatigue », ou optimisme lié à la disposition des traitements »)[30] ;
- contacts sexuels (y compris via fellation pour laquelle le préservatif est moins utilisé[31] et parce que la salive est vectrice du microbe (gonocoque)[32]) avec une personne porteuse d’une infection (diagnostiquée ou non) ;
- rapports sexuels non protégés avec un partenaire issu d’une région de forte endémicité, et où le taux de résistance aux médicaments risque d’être plus élevé ;
- voyage dans des zones d'endémisme en y ayant des relations sexuelles non protégées (ou impliquant une lubrification par de la salive[32]) avec des membres de la population locale (risque plus élevé de résistance).
- Travail dans l'industrie pornographique, pratiques de prostitution.[réf. nécessaire]
Le nouveau-né est parfois contaminé par la mère au moment de l'accouchement[33]. Plus tard l'enfant ou l'adolescent peut aussi être infecté en cas d'inceste, de viol ou de certains abus sexuel sur mineur[34] ou à l'occasion de jeux sexuels et de la découverte de la sexualité (en 1980, la moitié des cas de gonorrhée déclarés au Québec l'étaient chez des 15-19 ans).
Prévention et santé publique
[modifier | modifier le code]Elle passe par une meilleure connaissance des risques (éducation sexuelle et médicale) et une mise en pratique plus générale des seules précautions adéquates (port du préservatif, safer sex, utilisation de lubrifiants intimes sûrs et non de la salive[32]).
L'OMS appelle aussi à un effort international visant à améliorer le diagnostic précoce (développement d'examens précis, rapides et idéalement capables de prédire la sensibilité de la souche à tel ou tel antimicrobien). Le diagnostic doit être suivi de soins appropriés et d'une information des partenaires sexuels. L'OMS souhaite aussi une surveillance accrue des évolutions des stratégies de résistance du microbe via un suivi mieux partagé des échecs de traitements.
Dépistage
[modifier | modifier le code]Il se fait par test d'urine, ou par prélèvement de la région infectée à l'aide d'un tampon d'ouate (au niveau du méat de l'urètre chez l'homme et du col de l'utérus chez la femme, et au niveau du rectum et du pharynx pour les deux sexes).
Diagnostic
[modifier | modifier le code]Diagnostic clinique
[modifier | modifier le code]Chez l'homme
[modifier | modifier le code]
Les premiers signes d'alerte sont, chez l'homme :
- douleurs mictionnelles (brûlures importantes en urinant) ;
- écoulement de pus par le méat urinaire à l'extrémité de la verge ;
- douleurs épididymaires ;
- prurit urétral.
Les manifestations d'une infection à Neisseria gonorrhoeae peuvent se révéler sous la forme de :
Séquelles possibles chez l'homme :
- orchi-épididymite ;
- syndrome de Reiter ;
- infertilité (rare).
Chez la femme
[modifier | modifier le code]
Les risques de complication sont plus importants pour la femme. Cette infection, si elle n'est pas traitée, se complique parfois de cystite chronique et surtout de rétrécissement urétral.
- Écoulement vaginal
- Dysurie
- Saignements vaginaux anormaux
- Douleurs abdominales basses
- Dyspareunie profonde
Les manifestations d'une infection à Neisseria gonorrhoeae peuvent se révéler sous la forme de :
Séquelle possibles chez la femme :
- Atteinte inflammatoire pelvienne responsable de douleurs chroniques
- Infertilité
- Grossesse extra utérine
- Syndrome de Reiter
Chez les deux sexes
[modifier | modifier le code]- Pharyngite
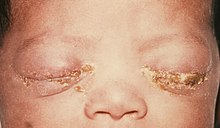
- Conjonctivite
- Rectite, voire écoulements au niveau du rectum
- Infection gonococcique disséminée : arthrite, dermatite, endocardite infectieuse, méningite. Rem : Goldenberg & al ont constaté en 1984 que l'injection intraarticulaire de bactéries vivantes, ou mortes ou même de lipopolysaccharides (LPS) provenant de bactéries mortes provoque chez le lapin une arthrite réactionnelle ; avec d'abord une synovite aiguë et polymorphonucléaire avec formation d'abcès 24-72 h après l'injection. À 5-7 jours, une infiltration mononucléaire avec hyperplasie des cellules de doublage synovial est constatée, qui chez une partie des lapins a persisté un mois[35]. L'injection seule (5 microgrammes ou plus) de lipopolysaccharides (LPS) bactériennes suffit à produire exactement les mêmes effets, alors que la protéine de membrane externe gonococcique (utilisée dans ce cas comme témoin) n'a provoqué qu'une synovite nulle ou minimale, à des concentrations 50 fois supérieures à celles utilisées dans les expériences d'inoculation de LPS. Les LPS semblent donc jouer un rôle majeur dans l'arthrite induite par une infection gonococcique. La PCR peut aider à étudier ce type d'arthrites[36]. L'arthrite septique aiguë peut être très douloureuse et est chez l'enfant « une véritable urgence médicale »[37]. Quel que soit l'âge c'est la forme la plus courante d'arthrite infectieuse[37]. « Un diagnostic précoce et une intervention médicale et chirurgicale appropriée sont indispensables pour éviter la destruction du cartilage articulaire, ce qui évite l'incapacité permanente »[37]. Dans 75 % des cas environ, elle touche les articulations des membres inférieurs avec par ordre de fréquence le genou, la hanche puis la cheville[37].
Chez le nouveau-né
[modifier | modifier le code]- Conjonctivite (prévenue par usage de collyre au nitrate d'argent en systématique)
- Septicémie
Diagnostic bactériologique
[modifier | modifier le code]Évolution et conséquences
[modifier | modifier le code]Sans traitement, les risques d'évolution vers une stérilité irréversible sont très importants, chez les deux sexes.
Parfois (moins de 3 à 4 % des cas d'infections génitales) les gonocoques diffusent. Ils peuvent alors se localiser :
- dans la peau (aspect de poussée subite d'acné généralisée) ;
- dans certaines articulations, les bactéries pouvant alors être retrouvée dans le liquide synovial [38] et dans la membrane synoviale[39]
- ou même (très exceptionnellement) dans l'endocarde (où ils provoquent des lésions mortelles en l'absence de traitement efficace).
Traitement
[modifier | modifier le code]
Le traitement consiste en la prise d'antibiotiques. Malgré divers dépôts de brevets[40] et plusieurs décennies de recherches sur le sujet[41],[42],[43],[44],[45],[46] il n'existe encore en 2018 aucun vaccin contre cette maladie[47].
L'évolution de la résistance aux antibiotiques du germe a modifié sa prise en charge suivant l'époque : de la sulfonamide à la fin des années 1930, on est passé à la pénicilline à doses croissantes, cette dernière n'étant plus utilisée à partir des années 1980. Les fluoroquinolones et les céphalosporines ont pris alors le relais, avec l'apparition de résistances dès les années 1990[48]. Cette évolution pose un réel problème de santé publique d'autant que certaines souches peuvent être résistantes à plusieurs antibiotiques à la fois. La proportion de ces dernières varie de façon importante suivant les pays. La résistance aux quinolones s'est largement répandue[16].
Tous les patients traités pour une gonococcie présentent un risque important d'avoir contracté une chlamydiose, cette infection étant très fréquemment associée[49], et devraient être traités en même temps.
Dans les cas de blennorragie les moins sévères, un « traitement minute » (une seule prise d'antibiotique, orale ou injectable, traitement développé dans les années 1960[50]) suffit en général. Si le stade de l'infection est plus sévère, le traitement peut s'étendre de 5 à 15 jours.
Un traitement sous observation directe de la prise d’une seule dose est souhaitable pour garantir l’observance.
Tous les partenaires qui ont eu des relations sexuelles avec le malade au moins dans les 60 jours précédant l’apparition des symptômes, ainsi que les parents de nouveau-nés infectés doivent subir le même traitement que le cas index. Les personnes traitées pour une infection gonococcique devraient également être traitées pour une chlamydiose.
Traitement de choix
[modifier | modifier le code]- Ceftriaxone 500 mg en dose unique en intramusculaire
- Céfixime 400 mg per os en dose unique
Toujours[51] associer un traitement pour Chlamydia trachomatis :
- Doxycyline per os pendant 7 jours
Traitements alternatifs
[modifier | modifier le code]Pour cause d'allergie au traitement de choix, il y a ces possibilités :
- Ciprofloxacine 500 mg per os en dose unique
- Ofloxacine 400 mg per os en dose unique
Antibiorésistances préoccupantes
[modifier | modifier le code]Depuis la fin des années 1980, la maladie devient plus difficile à soigner. En 2017, un article paru dans Nature[52] rappelle que la gonorrhée devient aussi incurable qu’au début du XXe siècle, avant l’apparition des premiers antibiotiques capables de la traiter.
En 2017, plus de 60 % des pays ont déclaré à l’OMS des souches de gonorrhées fortement antibio-résistantes, y compris aux médicaments de derniers recours (OMS) et surtout aux médicaments les plus anciens et les moins coûteux. 97 % des pays ont déclaré des cas résistant à la ciprofloxacine (le traitement le moins cher et le plus disponible) ; 81 % ont rapporté des cas de gonorrhée résistant à l'azithromycine ; et 66 % aux céphalosporines[15]. L’évolution des pratiques sexuelles (diminution de l’usage du préservatif notamment), la croissance de l’urbanisation et des déplacements associée à un faible taux de détection des infections et à un traitement parfois inadéquat contribuent à cette augmentation.
D’éventuels nouveaux médicaments ne sont pas prêts. Des espoirs reposent les phages, virus tueurs de bactéries[53]. Ou sur de nouvelles molécules, comme la zoliflodacine issue d’une nouvelle classe d'antibiotiques, proposée par Entasis Therapeutics (Waltham, Massachusetts), qui a donné de bons résultats initiaux[52].
Le , l'Organisation mondiale de la santé (OMS) lance à nouveau une mise en garde contre une résistance répandue aux anciens antibiotiques, se basant sur les données de 77 pays[54].
Génétique
[modifier | modifier le code]Le séquençage génétique permet de mieux comprendre la génétique de cette bactérie[55] et de certaines de ses protéines[56].
Dans la culture
[modifier | modifier le code]La maladie est évoquée dans de nombreux textes de littérature et parfois dans le cinéma :
- Dans le recueil La nuit remue écrit par Henri Michaux, se trouve le texte intitulé « Puissance de la volonté » (vingt-cinquième texte de la seconde section « Mes propriétés »), où le narrateur raconte la méthode mentale par laquelle il est parvenu à se débarrasser de la blennorragie et de « son avenir de sinistres complications », en reconstruisant la scène de l'union sexuelle et en frappant virtuellement la femme qui lui a transmis cette maladie.
- Dans le film La Ligne verte, Paul Edgecombe (Tom Hanks), gardien-chef au pénitencier de Cold Mountain en Louisiane, souffre des symptômes de la blennorragie : il urine des « lames de rasoir ». Son infection est soignée par les pouvoirs surnaturels de John Caffey, détenu gentil et doux condamné à tort pour le viol et le meurtre de deux fillettes.
- Dans le film Lame de fond réalisé par Ridley Scott de 1996, plusieurs élèves du bateau-école sont atteints de blennorragie après avoir eu des expériences sexuelles avec des étudiantes hollandaises en visite. Ils sont soignés par piqûre intramusculaire effectuée par l'infirmière du bateau.
- Dans la série Dr House, un homme transmet la blennorragie à sa femme entraînant un accident puis sa mort. L'équipe soigne la dépouille mortelle maintenue en vie végétative pour pouvoir greffer son cœur sur un autre patient.
- Dans l'épisode 3 de la saison 2 de la série The Walking Dead, Daryl donne de la doxycycline à T-Dog pour soigner une septicémie. Elle appartenait à son frère Merle. Pour justifier l'existence de ces médicaments, Daryl explique que Merle était atteint de manière récurrente de blennorragie.
- Dans le disque Joe's Garage, de Frank Zappa, le personnage Joe parle de sa blennorragie dans la chanson « Why does it hurt when I pee. ».
Notes et références
[modifier | modifier le code]- (en) « Prophylaxis for Gonococcal and Chlamydial Ophthalmia Neonatorum in the Canadian Guide to Clinical Preventative Health Care », Public Health Agency of Canada
- « Blennorragie », dans le Dictionnaire de l'Académie française, sur Centre national de ressources textuelles et lexicales (consulté le 30 mars 2016).
- Entrée « blennorragie » [html], sur Dictionnaires de français (en ligne), Larousse (consulté le ).
- « Gonorrhée », dans le Dictionnaire de l'Académie française, sur Centre national de ressources textuelles et lexicales (consulté le 30 mars 2016).
- Informations lexicographiques et étymologiques de « gonorrhée » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales (consulté le 30 mars 2016).
- Entrée « gonorrhée » [html], sur Dictionnaires de français (en ligne), Larousse (consulté le ).
- Entrée « urétrite », sur Encyclopédie Larousse (en ligne), Larousse (consulté le ).
- Informations lexicographiques et étymologiques de « chaude-pisse » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales (consulté le 30 mars 2016).
- Entrée « chaude-pisse » [html], sur Dictionnaires de français (en ligne), Larousse (consulté le ).
- Informations lexicographiques et étymologiques de « chaude-lance » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales (consulté le 30 mars 2016).
- Informations lexicographiques et étymologiques de « castapiane » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales (consulté le 30 mars 2016).
- Dictionnaire vivant de la langue française, « Castapiane »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur dvlf.uchicago.edu (consulté le )
- Informations lexicographiques et étymologiques de « chtouille » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales (consulté le 30 mars 2016).
- OMS (2017) Antibiotic-resistant gonorrhoea on the rise, new drugs needed ; News release Communiqué OMS, 7 juillet 2017
- Wi, T. & al. (2017), Antimicrobial resistance in Neisseria gonorrhoeae: Global surveillance and a call for international collaborative action ; PLOS Med. https://dx.doi.org/10.1371/journal.pmed.1002344
- Kai Kupferschmidt (2016) The world may soon run out of drugs to treat gonorrhea 2016-08-30, consulté 2016-09-11
- OMS (2014), [Communiqué de presse : Premier rapport de l’OMS sur la résistance aux antibiotiques: une menace grave d’ampleur mondiale] et rapport
- Morgan, MK; Decker, CF (August 2016). "Gonorrhea.". Disease-a-month : DM. 62 (8): 260–8. . doi:10.1016/j.disamonth.2016.03.009.
- Alexandre Jean Baptiste Parent-Duchatelet (1857) De la prostitution dans la ville de Paris, Volume 2 (voir p 276/732), impr J.B. Baillière et fils
- (en) Benjamin I. Baarda et Aleksandra E. Sikora, « Proteomics of Neisseria gonorrhoeae : the treasure hunt for countermeasures against an old disease », Frontiers in Microbiology, University of Pittsburgh., vol. 6, (ISSN 1664-302X, DOI 10.3389/fmicb.2015.01190)
- Jean-François Hernandez, Essai analytique sur la non identité des virus gonorrhoïques et syphilitiques, Toulon, 1812
- Humpston, R. (1822). Thèse sur la différence qui existe entre la gonorrhée et la siphilis.(Cand. Randal Humpston) (Doctoral dissertation)
- Wyss-Chodat F (1946), Le traitement sulfamidé local des blennorragies sulfamido-résistantes. Dermatology, 92(1), 17-24.
- Syphilis and gonorrhoea Curless, Eric; Kinghorn, George R. Current Opinion in Infectious Diseases. 10(1):39-43, February 1997
- Amy Maxmen (2016) Busting the billion-dollar myth: how to slash the cost of drug development ; A non-profit organization is proving that new drugs don't have to cost a fortune. Can its model work more broadly?, Nature, 24 August 2016 ; doi:10.1038/nature.2017.22270
- (en) Amy Maxmen, « Untreatable gonorrhoea on the rise worldwide », Nature, (ISSN 1476-4687, DOI 10.1038/nature.2017.22270, lire en ligne, consulté le )
- Ngampasutadol, J., Ram, S., Gulati, S., Agarwal, S., Li, C., Visintin, A., ... & Rice, P. A. (2008). Human factor H interacts selectively with Neisseria gonorrhoeae and results in species-specific complement evasion. The Journal of Immunology, 180(5), 3426-3435
- Buchanan, T. M., & Arko, R. J. (1977). Immunity to gonococcal infection induced by vaccination with isolated outer membranes of Neisseria gonorrhoeae in guinea pigs. Journal of Infectious Diseases, 135(6), 879-887 (résumé).
- Tessier, M. (1984). Adolescence et sexualité: les enjeux de la prévention. Santé mentale au Québec, 9(2), 64-73.
- Pierre-Yves Geoffard Stéphane Méchoulan (20) Comportements sexuels risqués et incitations ; L’impact des nouveaux traitements sur la prévention du VIH ;Revue économique 2004/5 (Vol. 55) Pages : 184 (ISBN 9782724629804) DOI 10.3917/reco.555.0883
- Potoczny, M., Truchetet, F., & de Saint Louis, G. G. (2017). Le préservatif masculin comme moyen de protection contre les infections sexuellement transmissibles. Quels facteurs influencent son utilisation? Enquête observationnelle multicentrique auprès de 303 étudiants messins de sexe masculin–de novembre à décembre 2015. La Revue Sage-Femme, 16(2), 119-123.
- Fairley Christopher; Zhang Lei; Chow Eric (2018) New thinking on gonorrhoea control in MSM: are antiseptic mouthwashes the answer? | Current Opinion in Infectious Diseases: February 2018 - Volume 31 - Issue 1 - p 45–49 doi: 10.1097/QCO.0000000000000421 SEXUALLY TRANSMITTED DISEASES: Edited by Karen Rogstad (résumé)
- Vilén, A. F. (1932). De la gonorrhée génitale acquise par les nouveau-nés au moment de l’accouchement. Acta dermato-vener.(Stockh.), 13, 315-346
- Marcel J.E (1950). Propos sur la gonorrhée infantile. Maroc. méd, 306, 1046.
- Goldenberg, D. L., Reed, J. I., & Rice, P. A. (1984). Arthritis in rabbits induced by killed Neisseria gonorrhoeae and gonococcal lipopolysaccharide. The Journal of rheumatology, 11(1), 3-8.
- Muralidhar, B., Rumore, P. M., & Steinman, C. R. (1994). Use of the polymerase chain reaction to study arthritis due to Neisseria gonorrhoeae. Arthritis & Rheumatology, 37(5), 710-717.
- Shetty A.K & Gedalia A (1998) Septic arthritis in children. Rheumatic Disease Clinics of North America, 24(2), 287-304 (résumé).
- Liebling, M. R., Arkfeld, D. G., Michelini, G. A., Nishio, M. J., Eng, B. J., Jin, T., & Louie, J. S. (1994). Identification of Neisseria gonorrhoeae in synovial fluid using the polymerase chain reaction. Arthritis & Rheumatology, 37(5), 702-709.
- Garcia-Kutzbach, A., Beachey, E. H., Chandler, R. W., Townes, A. S., & Masi, A. T. (1974). Identification of Neisseria gonorrhoeae in synovial membrane by electron microscopy. Journal of Infectious Diseases, 130(2), 183-186 (résumé).
- Buchanan, T. M. (1980). U.S. Patent No. 4,239,749. Washington, DC: U.S. Patent and Trademark Office.
- Ngampasutadol, J., Rice, P. A., Walsh, M. T., & Gulati, S. (2006). Characterization of a peptide vaccine candidate mimicking an oligosaccharide epitope of Neisseria gonorrhoeae and resultant immune responses and function. Vaccine, 24(2), 157-170 (résumé.
- Brinton, C. C., Bryan, J., Dillon, J. A., Guerina, N., Jacobson, L. J., Labik, A., ... & Polen, S. (1978). Uses of pili in gonorrhea control: role of bacterial pili in disease, purification and properties of gonococcal pili, and progress in the development of a gonococcal pilus vaccine for gonorrhea. Immunobiology of Neisseria gonorrhoeae. American Society for Microbiology, Washington, DC, 155-178.
- Barh, D., & Kumar, A. (2009). In silico identification of candidate drug and vaccine targets from various pathways in Neisseria gonorrhoeae. In silico biology, 9(4), 225-231.
- Price, G. A., Russell, M. W., & Cornelissen, C. N. (2005). Intranasal administration of recombinant Neisseria gonorrhoeae transferrin binding proteins A and B conjugated to the cholera toxin B subunit induces systemic and vaginal antibodies in mice. Infection and immunity, 73(7), 3945-3953.
- Boslego, J. W., Tramont, E. C., Chung, R. C., McChesney, D. G., Ciak, J., Sadoff, J. C., ... & Bryan, J. R. (1991). Efficacy trial of a parenteral gonococcal pilus vaccine in men. Vaccine, 9(3), 154-162 (résumé).
- Wetzler, L. M., Blake, M. S., Barry, K., & Gotschlich, E. C. (1992). Gonococcal porin vaccine evaluation: comparison of Por proteosomes, liposomes, and blebs isolated from rmp deletion mutants. Journal of Infectious Diseases, 166(3), 551-555 (résumé).
- Edwards, Jennifer; Jennings Michael; Seib Kate (2018) Neisseria gonorrhoeae vaccine development: hope on the horizon? Current Opinion in Infectious Diseases: Juin 2018 - Volume 31 - Issue 3 - p 246–250 doi: 10.1097/QCO.0000000000000450 Pathogenesis and immune response. Ed : Dennis L. Stevens
- Wang SA, Harvey AB, Conner SM et Als. Antimicrobial resistance for Neisseria gonorrhoeae in the United States, 1988 to 2003: The spread of fluoroquinolone resistance, Ann Int Med, 2007;147:81-84
- Datta SD, Sternberg M, Johnson RE et Als. Gonorrhea and chlamydia in the United States among persons 14 to 39 Years of Age, 1999 to 2002, Ann Int Med, 2007;147:89-96
- Sylvestre, L., & Gallai, Z. (1968). Traitement minute" de la gonorrhée par un nouveau dérivé de l'oxytétracycline: la doxycycline. Rapport préliminaire. Union Med Can, 97(5), 639-640.
- « Pillytrop - Ouvrages - Formation - SPILF - Infectiologie », sur www.infectiologie.com (consulté le )
- (en) Amy Maxmen, « Untreatable gonorrhoea on the rise worldwide », Nature, (ISSN 1476-4687, DOI 10.1038/nature.2017.22270, lire en ligne, consulté le )
- (en) Sara Reardon, « Modified viruses deliver death to antibiotic-resistant bacteria », Nature, vol. 546, no 7660, , p. 587–588 (ISSN 1476-4687, DOI 10.1038/nature.2017.22173, lire en ligne, consulté le )
- La gonorrhée se soigne de plus en plus mal, s'alarme l'OMS / Huffpost, 7/07/2017/ http://quebec.huffingtonpost.ca/2017/07/07/la-gonorrhee-se-soigne-de-plus-en-plus-mal-salarme-loms_a_23020936/
- (en) Hervé Tettelin, Nigel J. Saunders, John Heidelberg et Alex C. Jeffries, « Complete Genome Sequence of Neisseria meningitidis Serogroup B Strain MC58 », Science, vol. 287, no 5459, , p. 1809–1815 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.287.5459.1809, lire en ligne, consulté le )
- (en) N H Carbonetti, V I Simnad, H S Seifert et M So, « Genetics of protein I of Neisseria gonorrhoeae: construction of hybrid porins. », Proceedings of the National Academy of Sciences, vol. 85, no 18, , p. 6841–6845 (ISSN 0027-8424 et 1091-6490, PMID 2457919, PMCID PMC282074, DOI 10.1073/pnas.85.18.6841, lire en ligne, consulté le )
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- Androutsos, G., & Vladimiros, L. (2007). De la gonorrhée à la blennorragie: Les grandes étapes historiques. Andrologie, 17(2), 143-151.
- Barh, D., Misra, A. N., Kumar, A., & Vasco, A. (2010). A novel strategy of epitope design in Neisseria gonorrhoeae. Bioinformation, 5(2), 77.* Cohen, M. S., & Cannon, J. G. (1999). experimentation with Neisseria gonorrhoeae: progress and goals. The Journal of infectious diseases, 179 (Supplement_2), S375-S379.
- Cohen, M. S., & Sparling, P. F. (1992). Mucosal infection with Neisseria gonorrhoeae. Bacterial adaptation and mucosal defenses. Journal of Clinical Investigation, 89(6), 1699.
- Cohen, M. S., Cannon, J. G., Jerse, A. E., Charniga, L. M., Isbey, S. F., & Whicker, L. G. (1994). Human experimentation with Neisseria gonorrhoeae: rationale, methods, and implications for the biology of infection and vaccine development. Journal of Infectious Diseases, 169(3), 532-537 (résumé).
- College of Family Physicians of Canada. (2017). Risque émergent de gonorrhée intraitable et ce qu’il faut faire. Canadian Family Physician, 63(3), 215-215.
- Fox, K. K., Thomas, J. C., Weiner, D. H., Davis, R. H., Sparling, P. F., & Cohen, M. S. (1999). Longitudinal evaluation of serovar-specific immunity to Neisseria gonorrhoeae ; American journal of epidemiology, 149(4), 353-358.
- Hill, S. A., & Davies, J. K. (2009). Pilin gene variation in Neisseria gonorrhoeae: reassessing the old paradigms. FEMS microbiology reviews, 33(3), 521-530.
- Liu, Y., Feinen, B., & Russell, M. W. (2011). New concepts in immunity to Neisseria gonorrhoeae: innate responses and suppression of adaptive immunity favor the pathogen, not the host. Frontiers in microbiology, 2.
- Mehr, I. J., & Seifert, H. S. (1998). Differential roles of homologous recombination pathways in Neisseria gonorrhoeae pilin antigenic variation, DNA transformation and DNA repair. Molecular microbiology, 30(4), 697-710.
- Ngampasutadol, J., Ram, S., Gulati, S., Agarwal, S., Li, C., Visintin, A., ... & Rice, P. A. (2008). Human factor H interacts selectively with Neisseria gonorrhoeae and results in species-specific complement evasion. The Journal of Immunology, 180(5), 3426-3435.
- Parent, R., & Alary, M. (1995). Analyse des cas de gonorrhée, de chlamydiose, d'infection par le virus de l'hépatite B et de syphilis déclarés au Québec par année civile:... ; Centre québécois de coordination sur le sida.
