PAI-1

L'inhibiteur de l'activateur du plasminogène 1 aussi appelé PAI-1 pour plasminogen activator inhibitor-1 est le principal inhibiteur du tPA et de l'urokinase (uPA), les activateurs du plasminogène et par conséquent la fibrinolyse. C'est une protéine inhibitrice des protéases à sérine (serpine).
L'autre PAI, l'inhibiteur de l'activateur du plasminogène 2 (PAI-2) (en) est sécrété par le placenta et est présent en concentration non négligeable uniquement lors de la grossesse. De plus, la protéase nexine agit comme un inhibiteur du tPA et de l'urokinase. PAI-1 reste cependant le principal inhibiteur de l'activateur du plasminogène.
Génétique
[modifier | modifier le code]Le gène du plasminogen activator inhibitor-1 est SERPINE1. Il est localisé sur le chromosome 7 humain (7q21.3-q22). Il existe un polymorphisme connu sous le nom de 4G/5G dans la région promotrice. L'allèle 5G est alors légèrement moins transcrite que la 4G, avec une augmentation du risque thrombo-embolique[5].
Fonction
[modifier | modifier le code]PAI-1 est principalement produit par l'endothélium mais il est aussi sécrété par d'autres tissus tel que le tissu adipeux ou contenu dans les plaquettes sanguines où elle est relarguée en cas d'activation plaquettaire[6].
PAI-1 inhibe les protéases à sérine tPA et l'urokinase/uPA et par conséquent il est un inhibiteur de la fibrinolyse, le mécanisme physiologique de lyse de caillots sanguins. Il se fixe sur la vibronectine, cette dernière stabilisant la forme active du PAI-1[7].
Il favorise la formation d'une fibrose dans différents organes, sauf au niveau du cœur où il semble avoir un effet protecteur contre cette dernière[8], par le biais d'une inhibition de la voie du TGF béta[9].
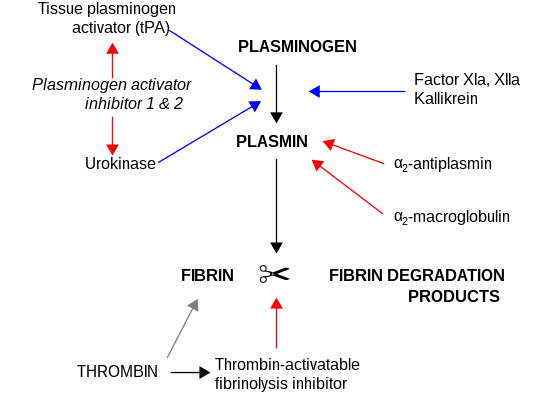
Rôle en pathologie
[modifier | modifier le code]Les défiances congénitales en PAI-1 ont été rapportées ; la fibrinolyse n'étant pas inhibée, cela entraine une diathèse hémorragique.
PAI-1 est présent en quantité plus importante dans diverses pathologies comme dans un certain nombre de cancers ou dans l'obésité. Dans le cancer du sein, des taux élevés de PAI-1 sont associés à risque élevé de récidive. Avec l'urokinase (uPA), PAI-1 est utilisé comme biomarqueur pronostique dans un test uPA/PAI-1 utilisé en clinique. Chez les patients présentant des taux de PAI-1 plus élevés, la fréquence des thromboses augmente[10].
En cas d'inflammation, lorsque de la fibrine est déposée dans le tissu, PAI-1 semble jouer un rôle important dans la progression vers une fibrose (formation pathologique de tissu conjonctif).
L'angiotensine II augmente la synthèse de PAI-1, ainsi elle accélère le développement de l'athérosclérose.
Pharmacologie
[modifier | modifier le code]La tiplaxtinine (PAI-039) est une petite molécule inhibitrice, qui a été étudiée pour une utilisation dans l'atténuation de remodelage des vaisseaux sanguins, causé par une hypertension artérielle et l'activation du système rénine-angiotensine[11].
Références
[modifier | modifier le code]- GRCh38: Ensembl release 89: ENSG00000106366 - Ensembl, May 2017
- GRCm38: Ensembl release 89: ENSMUSG00000037411 - Ensembl, May 2017
- « Publications PubMed pour l'Homme », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- « Publications PubMed pour la Souris », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- Zhang Q, Jin Y, Li X, Peng X, Peng N, Song J, Xu M, Plasminogen activator inhibitor-1 (PAI-1) 4G/5G promoter polymorphisms and risk of venous thromboembolism: a meta-analysis and systematic review, VASA Zeitschrift fur Gefasskrankheiten, 2020;49:141–146
- Singh S, Kumar P, Padwad YS, Jaffer FA, Reed GL, Targeting fibrinolytic inhibition for venous thromboembolism treatment: Overview of an emerging therapeutic approach, Circulation, 2024;150!884-898
- Eitzman DT, Westrick RJ, Nabel EG, Ginsburg D. Plasminogen activator inhibitor-1 and vitronectin promote vascular thrombosis in mice, Blood, 2000;95:577–580
- Flevaris P, Vaughan D, The role of plasminogen activator inhibitor type-1 in fibrosis, Semin Thromb Hemost, 2017;43:169–177.
- Flevaris P, Khan SS, Eren M et al. Plasminogen Activator Inhibitor Type I controls cardiomyocyte Transforming Growth Factor-β and cardiac fibrosis, Circulation, 2017;136:664-679.
- Frischmuth T, Hindberg K, Aukrust P, Ueland T, Braekkan SK, Hansen JB, Morelli VM. Elevated plasma levels of plasminogen activator inhibitor-1 are associated with risk of future incident venous thromboembolism, J Thromb Haemost, 2022;20:1618–1626
- Elokdah H, Abou-Gharbia M, Hennan JK, McFarlane G, Mugford CP, Krishnamurthy G, Crandall DL. Tiplaxtinin, a novel, orally efficacious inhibitor of plasminogen activator inhibitor-1: design, synthesis, and preclinical characterization. J Med Chem 2004;47:3491-4. .
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Plasminogen activator inhibitor-1 » (voir la liste des auteurs).
Bibliographie
[modifier | modifier le code]- (en) Mimuro J, « [Type 1 plasminogen activator inhibitor: its role in biological reactions] », Rinsho Ketsueki, vol. 32, no 5, , p. 487–9 (PMID 1870265)
- (en) Binder BR, Christ G, Gruber F, et al., « Plasminogen activator inhibitor 1: physiological and pathophysiological roles », News Physiol. Sci., vol. 17, , p. 56–61 (PMID 11909993)
- (en) Eddy AA, « Plasminogen activator inhibitor-1 and the kidney », Am. J. Physiol. Renal Physiol., vol. 283, no 2, , F209–20 (PMID 12110504, DOI 10.1152/ajprenal.00032.2002)
- (en) Schroeck F, Arroyo de Prada N, Sperl S, et al., « Interaction of plasminogen activator inhibitor type-1 (PAI-1) with vitronectin (Vn): mapping the binding sites on PAI-1 and Vn », Biol. Chem., vol. 383, nos 7-8, , p. 1143–9 (PMID 12437099)
- (en) Gils A, Declerck PJ, « The structural basis for the pathophysiological relevance of PAI-I in cardiovascular diseases and the development of potential PAI-I inhibitors », Thromb. Haemost., vol. 91, no 3, , p. 425–37 (PMID 14983217, DOI 10.1160/TH03-12-0764)
- (en) Durand MK, Bødker JS, Christensen A, et al., « Plasminogen activator inhibitor-I and tumour growth, invasion, and metastasis », Thromb. Haemost., vol. 91, no 3, , p. 438–49 (PMID 14983218, DOI 10.1160/TH03-12-0784)
- (en) Harbeck N, Kates RE, Gauger K, et al., « Urokinase-type plasminogen activator (uPA) and its inhibitor PAI-I: novel tumor-derived factors with a high prognostic and predictive impact in breast cancer », Thromb. Haemost., vol. 91, no 3, , p. 450–6 (PMID 14983219, DOI 10.1160/TH03-12-0798)
- (en) Hertig A, Rondeau E, « Plasminogen activator inhibitor type 1: the two faces of the same coin », Curr. Opin. Nephrol. Hypertens., vol. 13, no 1, , p. 39–44 (PMID 15090858)
- (en) Hoekstra T, Geleijnse JM, Schouten EG, Kluft C, « Plasminogen activator inhibitor-type 1: its plasma determinants and relation with cardiovascular risk », Thromb. Haemost., vol. 91, no 5, , p. 861–72 (PMID 15116245, DOI 10.1267/THRO04050861)
- (en) Lijnen HR, « Pleiotropic functions of plasminogen activator inhibitor-1 », J. Thromb. Haemost., vol. 3, no 1, , p. 35–45 (PMID 15634264, DOI 10.1111/j.1538-7836.2004.00827.x)
- (en) De Taeye B, Smith LH, Vaughan DE, « Plasminogen activator inhibitor-1: a common denominator in obesity, diabetes and cardiovascular disease », Curr. Opin. Pharmacol., vol. 5, no 2, , p. 149–54 (PMID 15780823, DOI 10.1016/j.coph.2005.01.007)
- (en) Dellas C, Loskutoff DJ, « Historical analysis of PAI-1 from its discovery to its potential role in cell motility and disease », Thromb. Haemost., vol. 93, no 4, , p. 631–40 (PMID 15841306, DOI 10.1267/THRO05040631)
- (en) Könsgen D, Mustea A, Lichtenegger W, Sehouli J, « [Role of PAI-1 in gynaecological malignancies] », Zentralblatt für Gynäkologie, vol. 127, no 3, , p. 125–31 (PMID 15915389, DOI 10.1055/s-2005-836407)
- (en) Vaughan DE, « PAI-1 and atherothrombosis », J. Thromb. Haemost., vol. 3, no 8, , p. 1879–83 (PMID 16102055, DOI 10.1111/j.1538-7836.2005.01420.x)
- (en) Hermans PW, Hazelzet JA, « Plasminogen activator inhibitor type 1 gene polymorphism and sepsis », Clin. Infect. Dis., vol. 41 Suppl 7, , S453–8 (PMID 16237647, DOI 10.1086/431996)
- (en) Alessi MC, Poggi M, Juhan-Vague I, « Plasminogen activator inhibitor-1, adipose tissue and insulin resistance », Curr. Opin. Lipidol., vol. 18, no 3, , p. 240–5 (PMID 17495595, DOI 10.1097/MOL.0b013e32814e6d29)