Phényllithium

| Phényllithium | |||
 Chaîne de molécules de phényllithium | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.008.838 | ||
| No CE | 209-720-1 | ||
| ChEBI | 51470 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C6H5Li | ||
| Masse molaire[1] | 84,045 ± 0,007 g/mol C 85,75 %, H 6 %, Li 8,26 %, | ||
| Précautions | |||
| SGH[2] | |||
| H250, H315, H319, H335, H412, P222, P231, P261, P273, P305+P351+P338 et P422 | |||
| Transport[2] | |||
| |||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier | |||
Le phényllithium est un composé chimique de formule C6H5Li. C'est l'un des agents de métallation les plus couramment employés comme alternative aux réactifs de Grignard pour introduire des groupes phényle en synthèse organique. Le phényllithium cristallin est incolore, mais il est généralement distribué en solutions, qui présentent diverses teintes de rouge ou de brun selon le solvant utilisé et les impuretés qu'ils contiennent[3].
Le phényllithium est un organolithien qui forme des cristaux monocliniques. À l'état solide, il peut être décrit comme constitué de dimères Ph2Li2. Les deux atomes de lithium et les deux atomes de carbone ipso de ces dimères forment un cycle plan auquel les plans des groupes phényle sont perpendiculaires. D'autres dimères adjacents s'empilent grâce à des liaisons intermoléculaires impliquant les électrons π en formant une structure en échelle infinie[4] :
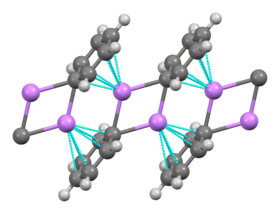
En solution, le phényllithium adopte des configurations variables selon le solvant organique utilisé. Dans le tétrahydrofurane (THF), un équilibre s'établit entre les formes monomériques et dimériques. En solution dans l'éther dibutylique, forme sous laquelle il est couramment distribué, quatre atomes de lithium et quatre atomes de carbone ipso alternent aux sommets d'un cube distordu, tandis que les groupes phényle se trouvent sur les faces d'un tétraèdre et sont liés aux trois atomes de lithium les plus proches :
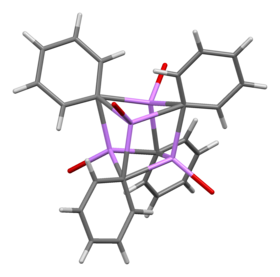
Les liaisons C–Li mesurent en moyenne 233 pm. Une molécule d'éther se lie à chacun des atomes de lithium via un atome d'oxygène.
Le phényllithium a été produit la première fois en faisant réagir du lithium métallique avec du diphénylmercure (C6Η5)2Ηg :
Cette synthèse a été rapidement améliorée en faisant réagir directement du lithium avec des halogénures de phényle C6H5X :
Le phényllithium peut également être synthétisé par une réaction d'échange métal-halogène, par exemple avec le n-butyllithium C4H9Li :
Cette dernière méthode est aujourd'hui le procédé le plus largement employé.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Solution de phényllithium à 1,8 M dans l'éther dibutylique, consultée le 1 mai 2013.
- (en) Henry Gilman, E. A. Zoellner et W. M. Selby, « AN IMPROVED PROCEDURE FOR THE PREPARATION OF ORGANOLITHIUM COMPOUNDS », Journal of the American Chemical Society, vol. 54, no 5, , p. 1957-1962 (lire en ligne) DOI 10.1021/ja01344a033
- (en) Robert E. Dinnebier, Ulrich Behrens et Falk Olbrich, « Lewis Base-Free Phenyllithium: Determination of the Solid-State Structure by Synchrotron Powder Diffraction », Journal of the American Chemical Society, vol. 120, no 7, , p. 1430-1433 (lire en ligne) DOI 10.1021/ja972816e


