Герман (химия)

| Герман | |
|---|---|
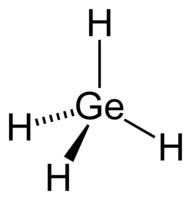 | |
| Общие | |
| Систематическое наименование | Тетрагидрид германия, герман |
| Традиционные названия | Моногерман, германометан |
| Хим. формула | GeH4 |
| Рац. формула | GeH4 |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 76,62 г/моль |
| Плотность | газ 3,420 г/л |
| Энергия ионизации | 11,34 ± 0,01 эВ[1] и 11,33 эВ[2] |
| Термические свойства | |
| Температура | |
| • плавления | −165 °C |
| • кипения | −89,2; -88,5 °C |
| • разложения | 280 °C |
| Давление пара | 1 ± 1 атм[1] |
| Структура | |
| Дипольный момент | 0 Кл·м[2] |
| Классификация | |
| Рег. номер CAS | 7782-65-2 |
| PubChem | 23984 |
| Рег. номер EINECS | 231-961-6 |
| SMILES | |
| InChI | |
| RTECS | LY4900000 |
| ChEBI | 30443 |
| Номер ООН | 2192 |
| ChemSpider | 22420 |
| Безопасность | |
| Предельная концентрация | 5 мг/м³ |
| ЛД50 | 100-148 мг/кг |
| Токсичность | обладает общетоксическим действием. Lc50: 622 ppm ( крыса, 60 мин) |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Герма́н — бинарное неорганическое соединение металла германия и водорода с формулой GeH4, бесцветный газ с характерным неприятным запахом, реагирует с водой. Сильно ядовит. Неагрессивен по отношению к алюминию, нержавеющей стали.
Получение
[править | править код]- Действие алюмогидрида лития на хлорид германия(IV) в диэтиловом эфире:
- Обработка хлорида германия(IV) цинком в кислой среде:
- При действии кислот на германид магния образуется моногерман с примесью высших германов, которые разделяют перегонкой:
Физические свойства
[править | править код]Герман представляет собой бесцветный газ с температурой кипения -88°C.
Химические свойства
[править | править код]- Разлагается при нагревании (при пропускании через нагретую стеклянную трубку образует блестящее зеркало металлического германия)
- При пропускании через раствор нитрата серебра образуется чёрный германид серебра:
- Реагирует с серой при нагревании:
Примечания
[править | править код]- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0300.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
Литература
[править | править код]- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |



![{\displaystyle {\mathsf {Mg_{2}Ge+4HCl\ {\xrightarrow[{-MgCl_{2}}]{}}\ GeH_{4},Ge_{2}H_{6},Ge_{3}H_{8}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b780e0e8ba8928356ca458ea67f57f600558b377)


