Изопропанол

| Изопропанол | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование | Пропан-2-ол | ||
| Традиционные названия | Изопропиловый спирт | ||
| Хим. формула | C3H8O | ||
| Рац. формула | CH3CH(OH)CH3 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 60,09 г/моль | ||
| Плотность | 0,7851 г/см³ | ||
| Динамическая вязкость | 0,00243 Па·с | ||
| Энергия ионизации | 10,1 ± 0,1 эВ[4] и 10,12 эВ[5] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -89,5 °C | ||
| • кипения | 82,4 °C | ||
| • вспышки | 11,7 °C | ||
| • самовоспламенения | 400 °C | ||
| Пределы взрываемости | 2 ± 1 об.%[4] | ||
| Мол. теплоёмк. | 155,2 Дж/(моль·К) | ||
| Давление пара | 4,4 кПа при 20 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 16,5 | ||
| Растворимость | |||
| • в бензоле | хорошо растворим | ||
| • в ацетоне | растворим | ||
| Оптические свойства | |||
| Показатель преломления | 1,3776 (nD, 20°C) | ||
| Структура | |||
| Дипольный момент | 1,66 Д | ||
| Классификация | |||
| Рег. номер CAS | 67-63-0 | ||
| PubChem | 3776 | ||
| Рег. номер EINECS | 200-661-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | NT8050000 | ||
| ChEBI | 17824 | ||
| Номер ООН | 1219 | ||
| ChemSpider | 3644 | ||
| Безопасность | |||
| ЛД50 | 3600 мг/кг (перорально, мыши)[1] | ||
| Токсичность | Зарегистрированные препараты изопропилового спирта относятся к 3 классу опасности (для человека)[2]. Класс опасности 3[3] | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Изопропано́л (изопропи́ловый спирт, пропано́л-2, также — втор-пропанол, диметилкарбино́л, ИПС, (CH3CH(OH)CH3) — органическое соединение, простейший вторичный одноатомный спирт алифатического ряда. Существует изомер изопропанола — пропанол-1 с гидроксильной группой у крайнего атома углерода.
Физические свойства
[править | править код]При нормальных условиях изопропанол — прозрачная, бесцветная жидкость с резким характерным запахом. Хорошо растворяет многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. Растворяет некоторые виды пластмасс и резины.
Показатель преломления nD = 1,3776 при 20 °C. Динамическая вязкость при стандартных условиях 2,43 мПа·с — немного более вязкий, чем вода. Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К). Удельная теплота сгорания — 34,1 МДж/кг.
Смеси паров изопропанола с воздухом образуют взрывчатые смеси. Давление насыщенного пара при 20 °C — 4,4 кПа. Относительная плотность пара по воздуху — 2,1, относительная плотность смеси насыщенный пар/воздух — 1,05 при 20 °C.
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях.
С водой образует азеотропную смесь 87,9%-го изопропилового спирта с температурой кипения 80,2 °C.
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице, при замерзании концентрированных растворов наблюдается переохлаждение[6]:
| Концентрация спирта, об % | Концентрация спирта, вес. % | Температура замерзания, °C |
|---|---|---|
| 0 | 0 | 0 |
| 10 | 8 | −4 |
| 20 | 17 | −7 |
| 30 | 26 | −15 |
| 40 | 34 | −18 |
| 50 | 44 | −21 |
| 60 | 54 | −23 |
| 70 | 65 | −29 |
| 80 | 76 | −37* |
| 90 | 88 | −57* |
| 100 | 100 | −90* |
(*Наблюдается переохлаждение)
Химические свойства
[править | править код]Изопропанол обладает всеми свойствами вторичных спиртов жирного ряда, образует простые и сложные эфиры, с щелочными металлами образует алкоголяты. Гидроксильная группа способна замещаться на атом галогена. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол.
При дегидрировании, например ферментом алкогольдегидрогеназой в организме млекопитающего, превращается в ацетон[7]. Реагирует с сильными окислителями, образуя ацетон.
Получение
[править | править код]Изопропанол получают методами гидрирования ацетона и гидратации пропилена[8][9].
Основным способом получения изопропанола в российской промышленности является сернокислотная гидратация пропилена:
- .
Сырьём может служить, в том числе кроме пропилена, пропан-пропиленовая фракция с содержанием пропилена 30—90 % (фракция получаемая при пиролизе и крекинге нефти). Сейчас начинают чаще использовать чистый пропилен, так как в этом случае процесс можно вести при невысоких давлениях, при этом существенно снижается образование побочных продуктов реакции — полимеров и ацетона.
На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата , серной кислоты и воды. На второй стадии процесса сернокислотный экстракт нагревается с водой и отгоняется образующийся изопропиловый спирт.
Прямую гидратацию пропилена осуществляют в основном в присутствии катализатора: ортофосфорной кислоты на твёрдом неорганическом носителе при 240—260 °С и 2,5—6,5 МПа или на носителе из катионообменной смолы при 130—160 °С и 8,0—10,0 МПа.
Изопропиловый спирт получают также окислением алканов воздухом, а также и другими способами[7].
Современный способ гидрирования ацетона водородом в паровой фазе в присутствии твёрдого медно-никельхромитного катализатора[10][11]:
- .
Применение
[править | править код]Изопропиловый спирт используется в качестве заменителя этилового спирта в медицине (в последнее время очень активно, так как не уступает по антисептической активности этанолу), в косметике, парфюмерии, бытовой химии, жидкостей для автомобилей (стеклоомывающих в основном, а также антифризов), медицинских целях, в средствах для очистки стёкол, оргтехники и как растворитель органических веществ в промышленности.
В развитых странах изопропанол широко используется в товарах личной гигиены и в медицине благодаря своей относительно низкой токсичности[12].
75%-й водный раствор изопропанола используется как дезинфицирующее средство для рук. Вода способствует проникновению сквозь клеточные мембраны бактерий, таким образом обеспечивая более высокую эффективность и лучшее обеззараживание[13].
Изопропиловый спирт также используется в медицине в качестве вспомогательного компонента профилактического средства от наружного отита[14].
Эффективен при лечении дерматита протиранием пораженных участков кожи, с малым вредным влиянием на кожу.
Изопропиловый спирт также используют как исходное сырьё для синтеза:
- ацетона (дегидрированием или неполным окислением)
- пероксида водорода
- метилизобутилкетона
- изопропилацетата
- изопропиламина.
По причине особого государственного регулирования использования этанола изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
- косметики
- парфюмерии
- бытовой химии
- дезинфицирующих средств
- средства для автомобилей (антифриз, растворитель в зимних стеклоомывателях)
- репеллентов
- промывок печатных плат после пайки с флюсом, продается под названием «Очиститель универсальный».
Изопропиловый спирт применяется в промышленности, при резке алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность металлообработки.
Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители).
Часто используется при сварке оптических волокон для очистки волокна перед скалыванием.
Также используется при обслуживании оргтехники, в частности для очистки поверхностей фотобарабанов лазерных принтеров.
Применялся как компонент бинарного химического оружия для получения зарина[15].
Медицина
[править | править код]70%-й изопропиловый спирт применяется вместо этилового спирта в качестве антисептика для пропитки медицинских салфеток.
Научные исследования
[править | править код]Используется при экстракции ДНК. Поскольку ДНК становится нерастворимой в растворах, содержащих 35% изопропанола, то при добавлении к ДНК-содержащему раствору соответствующего количества изопропилового спирта становится возможным получить осадок ДНК.[16]
Влияние на человека
[править | править код]- Ингаляционное
В больших количествах изопропиловый спирт ядовит (считается, что в 6 раз более этанола), требует осторожного обращения.
Предельно допустимая концентрация (ПДК) паров изопропанола в воздухе рабочей зоны составляет 10 мг/м³ (ГОСТ 9805-84), в атмосферном воздухе населённых мест — 0,6 мг/м³ (ГН 2.1.6.1338-03). Не накапливается в организме, то есть кумулятивными свойствами не обладает[17].
Изопропиловый спирт менее летуч, чем, например, этанол, и для достижения больших концентраций его паров необходима значительно большая площадь разлива и испарения. Благодаря этому свойству изопропиловый спирт заменяет этиловый в парфюмерии, дезинфицирующих составах, стеклоомывателях и незамерзающих жидкостях.
Как и все летучие спирты, огнеопасен. При горении даёт яркое пламя, полностью разлагается на воду и углекислый газ. При горении с достаточным избытком воздуха изопропанол не выделяет вредных веществ, копоти и пр.
Испарение изопропанола из ёмкости в помещении более 30 м³ при температуре 30 °C и ниже не вызывает негативных реакций у людей[18].
- Пероральное
Отравления изопропанолом чаще всего случайны и в основном происходят у детей младше 6 лет. Летальный исход от отравления изопропанолом происходит крайне редко. Употребление внутрь запрещено[19].
Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто при дозах примерно 50 мл и более. Изопропанол при приёме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обусловливает его токсическое действие.
При приёме внутрь вызывает опьянение, сходное с алкогольным. Хотя токсичность изопропанола примерно в 3,5 раза выше, чем у этанола, его опьяняющее действие так же выше, но уже в 10 раз[источник не указан 331 день]. По этой причине смертельные отравления изопропанолом по сравнению с отравлениями от этилового спирта случаются реже, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола, если только не выпил единовременно от 500 мл.
Биологический полураспад изопропилового спирта в организме человека составляет от 2,5 до 8 часов[19].
Наркотические свойства
[править | править код]Изопропиловый спирт обладает наркотическим действием[17], наркотический эффект от приёма изопропанола почти в 2 раза превышает аналогичный эффект этанола[20]. Концентрация 12 промилле в организме человека, воздействующая в течение 4 часов, вызывает состояние глубокого наркоза и смерть[18].
При длительном воздействии больших концентраций паров изопропанола в воздухе вызывает головную боль, оказывает раздражающее воздействие на глаза и дыхательные пути. Для достижения данного эффекта человеку потребуется находиться в течение длительного времени в непроветриваемом помещении с большой площадью разлива. Может оказывать угнетающее действие на центральную нервную систему. Длительное вдыхание воздуха с концентрацией, значительно превышающей ПДК, может вызвать потерю сознания. Тяжёлое отравление изопропиловым спиртом происходит редко. Благодаря резкому запаху разливы изопропанола легко обнаруживаются. Поэтому, почувствовав запах, следует обеспечить проветривание помещения и покинуть помещение.
Примечания
[править | править код]- ↑ 1 2 3 Isopropyl alcohol. The National Institute for Occupational Safety and Health (NIOSH). Дата обращения: 24 сентября 2021. Архивировано 24 сентября 2021 года.
- ↑ Изопрапанол.
- ↑ «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе». Дата обращения: 19 ноября 2017. Архивировано 9 мая 2018 года.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0359.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Ссылка один Архивная копия от 2 января 2012 на Wayback Machine (англ.),Ссылка два Архивная копия от 3 марта 2016 на Wayback Machine
- ↑ 1 2 [www.xumuk.ru/encyklopedia/1625.html ХиМиК.Ру — Изопропиловый спирт]
- ↑ "Isopropyl Alcohol, by John E. Logsdon and Richard A. Loke". Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. Article Online Posting Date: December 4, 2000.
{{cite encyclopedia}}: Проверьте значение даты:|date=(справка);|access-date=требует|url=(справка) - ↑ Papa Anthony J. Propanols (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — 2000. — 15 June. — doi:10.1002/14356007.a22_173.
- ↑ СПОСОБ ПОЛУЧЕНИЯ ПРОПАНОЛА-2 — Патент РФ 2047590 (недоступная ссылка)
- ↑ ООО Синтез Ацетон. Дата обращения: 26 ноября 2011. Архивировано из оригинала 21 марта 2012 года.
- ↑ Papa, A. J. "Propanols" // Ullmann's Encyclopedia of Industrial Chemistry : Weinheim: Wiley-VCH. — 2005.
- ↑ "Guide to Local Production: WHO-recommended Handrub Formulations" (англ.) // World Health Organization. — 2009. — Август. Архивировано 4 марта 2016 года.
- ↑ Otitis Externa (Swimmer's Ear) (26 февраля 2010). Дата обращения: 21 февраля 2016. Архивировано 26 февраля 2010 года.
- ↑ Velez-Daubon L. I. CBRNE — Nerve Agents, Binary — GB2, VX2 : Background, Pathophysiology, Epidemiology : [англ.] : [арх. 1 октября 2020] / Larissa I. Velez-Daubon, Fernando L. Benitez, Daniel C. Keyes // Medscape. — 2019. — 9 November. — Updated Dec 18, 2018.
- ↑ Michael R. Green, Joseph Sambrook. Precipitation of DNA with Isopropanol (англ.) // Cold Spring Harbor Protocols. — 2017-08. — Vol. 2017, iss. 8. — P. pdb.prot093385. — ISSN 1940-3402. — doi:10.1101/pdb.prot093385.
- ↑ 1 2 ГОСТ 9805-84. Спирт изопропиловый. Технические условия Архивная копия от 14 ноября 2011 на Wayback Machine[1] Архивная копия от 14 июля 2015 на Wayback Machine
- ↑ 1 2 Review of Inhalants: Euphoria to Dysfunction Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.,National Institute on Drug Abuse. Дата обращения: 10 августа 2011. Архивировано из оригинала 15 октября 2011 года.
- ↑ 1 2 R. J. Slaughter, R. W. Mason, D. M. G. Beasley, J. A. Vale, L. J. Schep. Isopropanol poisoning // Clinical Toxicology (Philadelphia, Pa.). — 2014-06-01. — Т. 52, вып. 5. — С. 470–478. — ISSN 1556-9519. — doi:10.3109/15563650.2014.914527. Архивировано 2 января 2016 года.
- ↑ Волкова С. В., Клементенок Е. В.Достоинства и недостатки современных кожных антисептиков. Дата обращения: 10 августа 2011. Архивировано 16 апреля 2014 года.
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |
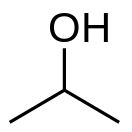



![{\displaystyle {\ce {CH3CH=CH2\ + H2O ->[{\ce {H2SO4}}] (CH3)2CHOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7a3c916d52d4d234b1ef917cb8eddcb7c2c30c5)

![{\displaystyle {\ce {CH3COCH3\ +H2->[{\text{катализатор}}]CH3CH(OH)CH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9a7dec759139ef8517f2284a413e3b3d94145abd)
