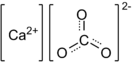
Карбонат кальция

| Карбонат кальция | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование | карбонат кальция | ||
| Традиционные названия | карбонат кальция, углекислый кальций, арагонит, кальцит, известняк, мел, мрамор, фатерит | ||
| Хим. формула | CaCO3 | ||
| Рац. формула | CaCO3 | ||
| Физические свойства | |||
| Состояние | твёрдые белые кристаллы | ||
| Молярная масса | 100.0869 г/моль | ||
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | (кальцит) 825 °C, (арагонит) 1339 °C | ||
| • разложения | 900−1000 °C | ||
| Энтальпия | |||
| • образования | -1206,9 кДж/моль | ||
| Давление пара | 0 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9.0 | ||
| Растворимость | |||
| • в воде | (25 °C) 0,0014 г/100мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,60 | ||
| Структура | |||
| Кристаллическая структура | тригональная, пространств. гр. 2/m | ||
| Классификация | |||
| Рег. номер CAS | 471-34-1 | ||
| PubChem | 10112 и 516889 | ||
| Рег. номер EINECS | 207-439-9 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E170 | ||
| RTECS | FF9335000 | ||
| ChEBI | 3311 | ||
| ChemSpider | 9708 | ||
| Безопасность | |||
| Предельная концентрация | 6 мг/дм3 | ||
| ЛД50 | 6400 мг/кг | ||
| Токсичность | Класс опасности 4 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Карбона́т ка́льция (углеки́слый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула .
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц и пресмыкающихся, а также в состав раковин моллюсков и некоторых других беспозвоночных.
Нерастворим в воде и этаноле. Зарегистрирован как белый пищевой краситель (E170).
Применение
[править | править код]Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
[править | править код]
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слёживанию и для препятствования слипания в комки сухих молочных продуктов.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей[источник не указан 2192 дня].
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и пигмента, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок[источник не указан 2192 дня].
В строительстве
[править | править код]Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе
[править | править код]
Очень распространённое в природе вещество. Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространённой.
Минералы карбоната кальция находятся в следующих горных породах:
- Кальцит
- Арагонит
- Мрамор
- Травертин
Геология
[править | править код]Залежи карбоната кальция в виде известняковых и меловых пластов — распространённое явление в земной коре. Они имеют органическое, реже хемогенное происхождение.
Органическое происхождение связано отложениями останков древних морских организмов: зоопланктона, моллюсков, кораллов и др., в основном, в меловой период.
Такие горные породы как известняк, мел, мрамор, травертин и другие известковые туфы практически полностью состоят из карбоната кальция с различными примесями.
В природе встречаются три кристаллические модификации карбоната кальция (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Кальцит является наиболее устойчивой и распространённой кристаллической модификацией карбоната кальция. Около 10 % всех осадочных пород составляют известняки, сложенные кальцитовыми останками раковин простейших морских организмов.
Арагонит является второй по устойчивости и распространённости кристаллической модификацией CaCO3. В основном формируется в раковинах моллюсков и скелетах кораллов. Также арагонит может образовываться при неорганических процессах (хемогенное происхождение), например, в карстовых пещерах или гидротермальных источниках в результате химического осаждения из водных растворов или при испарении воды.
Фатерит является наименее стабильной разновидностью карбоната кальция и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
[править | править код]Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашёной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция[2]:
Химические свойства
[править | править код]При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
Растворяется в воде при избытке углекислого газа, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
- .
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
- .
Реагирует с сильными кислотами с вытеснением угольной кислоты, которая тут же разлагается на воду и углекислый газ:
Данная реакция используется для лабораторного получения углекислого газа в аппарате Киппа.
Безопасность
[править | править код]Карбонат кальция считается нетоксичным веществом. ПДК 180 мг/дм³ (в воде, с обязательным контролем по ионам кальция). ЛД50 на крысах около 6400 мг/кг.
Одобрен Объединённым экспертным комитетом ФАО/ВОЗ по пищевым добавкам (JECFA) в качестве пищевой добавки в 1965 году[3]. Имеет номер E170[4] и номер INS 170. Используется в качестве регулятора кислотности, антислеживателя, стабилизатора или пищевого красителя и одобрен для использования в Европейском союзе[5], США[6], Австралии и Новой Зеландии[7]. Он «по закону добавляется ко всей муке грубого помола в Великобритании, кроме цельнозерновой»[8][9]. Он используется в некоторых продуктах из соевого молока и миндального молока в качестве источника диетического кальция; по крайней мере, одно исследование предполагает, что карбонат кальция может быть таким же биодоступным, как кальций в коровьем молоке[10]. Карбонат кальция также используется в качестве укрепляющего агента во многих консервированных и бутилированных овощных продуктах.
Примечания
[править | править код]- ↑ http://www.cdc.gov/niosh/npg/npgd0090.html
- ↑ Solvay Precipitated Calcium Carbonate: Production. Solvay S. A. (9 марта 2007). Архивировано 9 февраля 2012 года.
- ↑ World Health Organization. CALCIUM CARBONATE // Joint FAO/WHO Expert Committee on Food Additives. Архивировано 26 июня 2022 года.
- ↑ E-numbers: E170 Calcium carbonate. Food-Info.net. Дата обращения: 14 октября 2022. Архивировано 14 октября 2022 года. 080419 food-info.net
- ↑ Current EU approved additives and their E Numbers. UK Food Standards Agency. Дата обращения: 27 октября 2011. Архивировано 7 октября 2010 года.
- ↑ Listing of Food Additives Status Part I. US Food and Drug Administration. Дата обращения: 27 октября 2011. Архивировано 14 марта 2013 года.
- ↑ Standard 1.2.4 – Labelling of ingredients. Australia New Zealand Food Standards Code. Дата обращения: 27 октября 2011. Архивировано 2 сентября 2013 года.
- ↑ Holdstock, Lee. "Why go organic?". Real Bread Campaign. Soil Association Certification Limited. Архивировано 14 октября 2022. Дата обращения: 3 апреля 2021.
{{cite news}}: Указан более чем один параметр|accessdate=and|access-date=(справка) - ↑ "Bread and Flour Regulations 1998 A summary of responses to the consultation and Government Reply" (PDF). Department for Environment, Food and Rural Affairs. 2013-08. Архивировано (PDF) 19 сентября 2021. Дата обращения: 14 октября 2022.
- ↑ Zhao, Y.; Martin, B. R.; Weaver, C. M. (2005). "Calcium bioavailability of calcium carbonate fortified soymilk is equivalent to cow's milk in young women". The Journal of Nutrition. 135 (10): 2379—2382. doi:10.1093/jn/135.10.2379. PMID 16177199.
Литература
[править | править код]- Calcium Carbonate : [англ.] : [арх. 17 октября 2007] / National Institutes of Health // Medline Plus. — 2005. — 1 October. — Revised: Sep 15, 2015.
Ссылки
[править | править код]- Краситель е170 – Карбонат кальция : [арх. 26 октября 2010] // Факты о здоровой пище. — 2009.