Цитохром-b6f-комплекс

| Цитохром b6f-комплекс | |
|---|---|
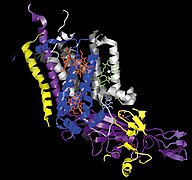
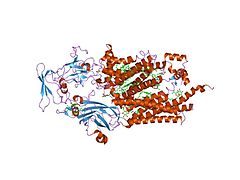
![Кристаллическая структура цитохром b6f-комплекса из Chlamydomonas reinhardtii [1]. Липидный бислой показан голубой и красной линиями.](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ee/1q90_opm.png/250px-1q90_opm.png) Кристаллическая структура цитохром b6f-комплекса из Chlamydomonas reinhardtii [1]. Липидный бислой показан голубой и красной линиями. | |
| Идентификаторы | |
| Шифр КФ | 1.10.99.1 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
Цитохро́м-b6f-ко́мплекс (комплекс цитохромов b6f), или пластохинолпластоцианинредукта́за — мультибелковый комплекс, который осуществляет окисление пластохинолов и восстановление белка пластоцианина, обеспечивая, таким образом, транспорт электронов между реакционными центрами фотосистемы I (ФСI) и фотосистемы II (ФСII). Он восстанавливает маленький водорастворимый белок пластоцианин, который переносит электрон к ФСII[2]. Аналогичную реакцию катализирует цитохром-bc1-комплекс (комплекс III) электрон-транспортной цепи митохондрий. Цитохром-b6f-комплекс присутствует в тилакоидной мембране хлоропластов растений, водорослей и цианобактерий[3]. Он функционально объединяет две фотосистемы в единую цепь переноса электронов от воды к НАДФ+, то есть является участником нециклического потока электронов. Кроме того, цитохромный комплекс вовлечён в циклический транспорт электронов, осуществляемый фотосистемой I[4].
Цитохром-b6f-комплекс занимает особое стратегическое положение в электрон-транспортной цепи (ЭТЦ) хлоропластов — между ФСI и ФСII. В электрон-транспортной цепи комплекса наблюдается наибольшее изменение окислительно-восстановительного потенциала и, следовательно, наибольшее изменение энергии[4]. В ходе редокс-реакций с участием цитохромного комплекса происходит перемещение протонов из стромы в люмен тилакоида и формируется электрохимический потенциал, энергия которого используется для синтеза АТФ при помощи фермента АТФ-синтазы. Таким образом, цитохром-b6f-комплекс — главный протонный насос фотосинтеза[5].
Структурная организация
[править | править код]
Цитохром-b6f-комплекс состоит из следующих субъединиц[6][7][8][9]:
| Субъединица | Масса (кДа) | Описание |
|---|---|---|
| PetA (Цит. f) | 32,273 | Несёт гем c. Связывает и восстанавливает пластоцианин. |
| PetB (Цит. b6) | 24,712 | Несёт гемы bp, bn и сn. Участвует в транспорте электронов. |
| PetC (Белок Риске) | 19,295 | Несёт [2Fe-2S] железосерный кластер. Участвует в транспорте электронов. |
| PetD (Субъединица IV) | 17,528 | Не несёт кофакторов, но необходима для работы комплекса. |
| PetG | 4,058 | Необходима для работы комплекса, участвует в его сборке и обеспечивает стабильность. |
| PetL | 3,530 | Не существенна для работы комплекса, но стабилизирует его. |
| PetM | 3,841 | Необходимая субъединица, участвует в его сборке и обеспечивает стабильность. |
| PetN | 3,304 | Необходимая субъединица, участвует в его сборке и обеспечивает стабильность. |
Белковый состав
[править | править код]Цитохром-b6f-комплекс — трансмембранный белок, который состоит из восьми субъединиц[10] и существует в виде димера с суммарной массой около 220 кДа[8]. Димеризация комплекса происходит за счёт взаимодействия трансмембранных доменов цитохрома b6 и белка Риске[англ.][9].
Ядро комплекса состоит из четырёх больших субъединиц: цитохром f или PetA, несущий гем c-типа, цитохром b6 или PetB , несущий три гема, железосерный белок Риске[англ.] (PetC), содержащий 2Fe-2S-кластер, и PetD или субъединица IV, которая не участвует в транспорте электронов, но вместе с цитохромом b6 образует Qp-сайт связывания пластохинона. Другие четыре субъединицы имеют массу 3—4 кДа и называются малыми субъединицами[10][11]. Все они состоят из одной α-спирали, обеспечивают комплексу стабильность и помогают ему принять правильную конформацию в процессе сборки[7]. У высших растений PetG, PetM и PetN необходимы для полноценной работы комплекса[9].
Димер цитохромного комплекса образует центральную обменную полость, в которой происходят все процессы окисления и восстановления пластохинонов и где находятся сайты их связывания. Стороны димера, обращённые в люмен и строму, не равнозначны: сторона, обращённая в люмен, электрохимически более положительна и потому называется p-стороной (от англ. positive), а сторона, обращённая в строму, электрохимически более отрицательна и называется n-стороной (от англ. negative). Ближе к р-стороне, в центральной обменной полости, между гемом bp и железосерным кластером белка Риске[англ.] расположен Qp-сайт, или центр связывания восстановленного пластохинона QH2, где происходит его окисление, а ближе к n-стороне рядом с парой гемов bn/сn расположен Qn-сайт связывания окисленного пластохинона Q, где происходит его восстановление[12].
Кроме восьми основных субъединиц, как девятую, самую большую, субъединицу можно рассматривать ферредоксин-НАДФ+-редуктазу[англ.] — белок массой 35,3 кДа, который может связываться с цитохромным комплексом. Такого рода комплексы были выделены из шпината и зелёного горошка. Предположительно ФНР, связанная с цитохром-b6f-комплексом, принимает участие в циклическом транспорте электронов[12].
Цитохром-b6f — не только самый маленький, но и самый стабильный из комплексов, участвующих в фотосинтезе. Это объясняется тем, что он практически не содержит фотоактивных веществ, которые могли бы привести к повреждению комплекса на свету. В то время как время полураспада фотосистемы I составляет от 30 до 75 часов, а фотосистемы II от 1 до 11 часов[13], полное время жизни цитохромного комплекса более одной недели. Исследования, проведённые на табаке, показали, что наиболее интенсивный синтез цитохром-b6f-комплекса происходит в молодых листьях, в то время как в зрелых листьях его синтез практически полностью подавлен. Весьма вероятно, что такой процесс может лежать в основе онтогенетической программы старения и отмирания листа[7].
Кофакторы и электрон-транспортные цепи
[править | править код]| Белок Риске | |
|---|---|
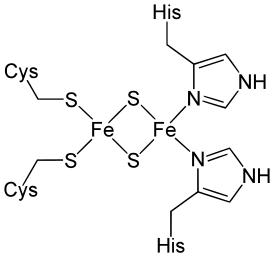 Необычный железосерный кластер белка Риске. | |
| Идентификаторы | |
| Символ | CytB6-F_Fe-S |
| Pfam | PF08802 |
| InterPro | IPR014909 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Цитохром-b6f-комплекс содержит семь простетических групп[8][14]. В первую очередь это ковалентно связанный гем c-типа из цитохрома f, низкопотенциальный гем bn и высокопотенциальный гем bp из цитохрома b6, а также 2Fe-2S-кластер белка Риске[англ.]. Три другие простетические группы уникальны для цитохрома-b6f: это одна молекула хлорофилла a и одна молекула β-каротина, функции которых точно не выяснены, и необычный гем cn, также известный как гем ci или гем x[15].
Комплекс погружён в тилакоидную мембрану таким образом, что функциональная группа белка Риске и цитохрома f выходят на её внутреннюю, люменальную поверхность, тогда как два гема цитохрома b6 находятся в толще мембраны, причём bp приближен к её внутренней стороне, а bn к наружной. Такое асимметричное расположение редокс-центров в мембране обеспечивает существование двух пространственно разделённых цепей транспорта электронов внутри одного комплекса. Первая, низкопотенциальная цепь транспорта электронов формируется за счёт двух гемов цитохрома b6 — низкопотенциального bn (E°‘ = —0,15 В) и высокопотенциального bp (E°‘ = —0,05 В). Вторая, высокопотенциальная цепь включает белок Риске (E°‘ = +0,3 В) и гем цитохрома f (E°‘ = +0,34 В). При окислении пластохинолов в цитохромном комплексе реализуется два сопряжённых потока электронов — по низкопотенциальному и высокопотенциальнму пути[16].
Белок Риске
[править | править код]Высокое значение редокс-потенциала белка Риске объясняется участием в координационных связях с железом, наряду с двумя остатками цистеина, двух остатков гистидина. Такой высокий редокс-потенциал позволяет ему окислять пластохинолы, индуцируя реакции Q-цикла[англ.]. Белок Риске — ключевой элемент всего цитохромного комплекса, именно здесь происходит расхождение двух электронов. Изучение кристаллической структуры комплекса показало, что позиция 2Fe-2S-центра может смещаться относительно других редокс-центров. Оказалось, что белок Риске имеет подвижный домен, на котором, собственно, и расположен 2Fe-2S центр. Принимая электрон и восстанавливаясь, 2Fe-2S центр меняет своё положение и отдаляясь от Qp-сайта и гема bp на 17 Å с поворотом на 60° и тем самым приближаясь к цитохрому f. Отдав электрон цитохрому, 2Fe-2S центр, наоборот, сближается с Qp-центром для установления более тесного контакта. Таким образом функционирует своеобразный челнок (шаттл), гарантирующий уход второго электрона на гемы bp и bn. Пока это единственный известный пример, когда электронный транспорт связан с подвижным доменом в структуре белка[17].
Гем cn
[править | править код]
Отличительная черта цитохром-b6f-комплекса — наличие в его структуре необычного гема, расположенного на внутренней поверхности обменной полости на стромальной или n-стороне цитохрома b6. Изначально этот гем был назван «гемом x», поскольку он обладал неожиданной координацией. Однако позже для ясности он был переименован в гем ci или гем cn. Это гем типа с, который ковалентно связан с остатком цистеина Cys35 цитохрома b6 и не имеет каких-либо ярко выраженных аминокислотных лигандов. Он расположен в непосредственной близости от гема bn и, по всей видимости, способен быстро обмениваться с ним электронами через мостик из молекулы воды, который соединяет пропионатную[англ.]* группу гема bn с атомом железа гема cn. Редокс-потенциал гема cn меняется в зависимости от значения pH и в среднем составляет около +0,1 В, что значительно больше чем у гема bn (E°‘ = —0,05 В), что указывает на направления передачи электрона от bn к cn[15][12].
Поскольку гемы cn и bn расположены на расстоянии всего в 4 Å, полагают, что они действуют как единый двугемовый цитохром. Кроме того, эксперименты с аналогами хинонов показали, что cn является местом связывания пластохинолов в Qn-центре, где происходит их восстановление. Исследования методом ЭПР выявили, что при связывании синтетических аналогов пластохинона с гемом cn происходит сдвиг его редокс-потенциала на —0,2 В. Такой механизм восстановления хинонов существенно отличается от того, который имеет место в цитохром bс1-комплексе, где нет гема cn. Наличие пары bn/cn даёт серьёзные основания предположить существование двухэлектронного восстановления пластохинона. В случае такой модели исключается образование нестабильного радикала семихинона, что делает всю систему стабильнее и существенно снижает вероятность образования активных форм кислорода[5][12][15].
Отсутствие гема cn в цитохром bc1-комплексе указывает на то, что его возможная функция в цитохром-b6f-комплексе связана с циклическим транспортом электронов вокруг фотосистемы I, который, очевидно, отсутствует в bc1-комплексе. Свет на эволюционное происхождение этого гема пролило исследование бактерий типа фирмикуты. Исследование последовательностей генов показало, что у этих бактерий есть цитохром f, белок Риске, а также гем cn. Наличие цитохром bc-комплекса, схожего с цитохром-b6f-комплексом цианобактерий и цитохром-bc1-комплексом митохондрий, было показано как у примитивных фотосинтезирующих (Heliobacillus mobilis[15]), так и не фотосинтезирующих фирмикут (Bacillus subtilis и Bacillus stereothermophilus[6]). Это может означать, что у нефотосинтезирующих фирмикут гем cn должен выполнять другую функцию, нежели циклический транспорт электронов. Здесь этот гем участвует в окислении альтернативного переносчика электронов и протонов — менанхинона (MQ), известного также как витамин К2. Окислительно-восстановительный потенциал пары (MQ/MQH2) приблизительно на —0,15 В более отрицателен, чем для соответствующих пар убихинонов или пластохинонов.
Гены
[править | править код]Как указано выше, цитохромный комплекс состоит из восьми субъединиц и семи простетических групп. У эукариот шесть субъединиц комплекса кодируются геномом хлоропластов, а PetM и PetC (белок Риске) — генами ядра. Гены, кодирующие субъединицы, не образуют единый оперон. Гены цитохрома b6 (petB) и субъединицы IV (petD) находятся под единым промотором и образуют оперон petBD. Вместе с ними в этом полицистронном опероне закодированы две субъединицы фотосистемы II psbB (CP47), psbT и psbH. У высших растений ген цитохрома f (petA) — последний ген оперона, который также содержит небольшую субъединицу фотосистемы I psaI, фактор ycf4, необходимый для сборки фотосистемы I, и открытую рамку считывания ycf10[18][9].
У прокариот ген белка Риске (petC) и ген petA образуют ещё один оперон petCA. Таким образом, транскрипция четырёх больших субъединиц у прокариот генетически скоординирована. Четыре малые субъединицы Pet G, L, M и N не находятся в одном опероне, и их генетическая координация и синтез мало изучены[18].
Механизм реакции
[править | править код]Цитохром-b6f-комплекс участвует в нециклическом (1) и циклическом (2) транспорте электронов между двумя подвижными переносчиками: пластохиноном (QH2) и пластоцианином (Pc):
| H2O | → | Фотосистема II | → | QH2 | → | Цит. b6f | → | Pc | → | Фотосистема I | → | НАДФН | (1) |
| НАДФН/Ферредоксин | → | ФНР | → | Цит. b6f | → | Pc | → | Фотосистема I | → | НАДФН | (2) | ||
Комплекс окисляет пластохинол, восстановленный фотосистемой II, а затем восстанавливает медьсодержащий белок пластоцианин, который осуществляет перенос электрона в водной фазе к следующему комплексу цепи — фотосистеме I. В электрон-транспортной цепи бактерий и митохондрий вместо пластоцианина присутствует цитохром c, который выполняет там аналогичную функцию[2]. Цитохромный комплекс окисляет восстановленный пластохинон и восстанавливает пластоцианин согласно уравнению:
QH2 + 2Pcox +2H+из стромы→ Q + 2Pcred + 4H+в люмен
Q-цикл
[править | править код]
Первая часть Q-цикла
- QH2 связывается с электрохимически положительной 'p' стороной (люменальная сторона) комплекса в Qp-сайте, окисляется до семихинона (Q•) железосерным центром белка Риске и отдаёт два протона в люмен.
- Восстановленный железосерный центр передаёт один электрон на пластоцианин через цитохром f.
- Q связывается с 'n' стороной в Qn-сайте.
- Q• передаёт электроны к гему bp цитохрома b6 по низкопотенциальной ЭТЦ.
- Гем bp передаёт электрон на bn/cn.
- Пара bn/cn восстанавливает Q до состояния Q•.
Вторая часть Q-цикла
- Второй QH2 связывается с Qp-сайтом комплекса.
- Пойдя по высокопотенциальной ЭТЦ, один электрон восстанавливает ещё один пластоцианин. Ещё два протона поступают в люмен.
- По низкопотенциальной ЭТЦ электрон от bn/cn передаётся на Q•, и полностью восстановленный Q2− связывает два протона их стромы, превращаясь в QH2.
- Окисленный Q и восстановленный QH2 диффундируют в мембрану.
Электронный транспорт в комплексе сопряжён с переносом протонов из стромы в люмен и генерацией на мембране протонного градиента. Принцип Q-цикла состоит в том, что перенос H+ через мембрану происходит в результате окисления и восстановления пластохинонов на самом комплексе. При этом пластохиноны соответственно отдают и забирают H+ из водной фазы избирательно с разных сторон мембраны. Движущей силой восстановления одного пластохинона служит бифуркация электронов: один электрон окисляемого пластохинона переносится на восстанавливаемый пластохинон за счёт того, что другой его электрон переходит на более редокс-положительный пластоцианин, что сопровождается значительной потерей энергии[19][20].
С тех пор, как в 1975 году Питер Митчелл предложил схему Q-цикла[21], гипотеза множество раз оспаривалась и подвергалась сомнению, но по мере того, как накапливались кинетические, биохимические, термодинамические и структурные данные, эта модель стала общепринятой. Тем не менее открытия последних лет заставляют учёных вносить в эту модель поправки и даже предлагать альтернативные схемы протекания реакции. Наличие у цитохром-b6f-комплекса электронно спаренных гемов bn/cn привело к предположению о возможном двухэлектронном восстановлении пластохинона, который таким образом минует опасную стадию нестабильного семихинон-радикала и снижает образование активных форм кислорода. В пользу этой теории говорит и то, что методом ЭПР не обнаруживается значительное присутствие в комплексе семихинон-радикалов, хотя имеются косвенные данные в пользу их наличия[8]. Остаётся неразрешённым вопрос, каким образом комплекс разделяет прямой и циклический транспорт электронов и каким образом они не мешают друг другу. Для объяснения этого феномена была предложена модель незамкнутого Q-цикла, в котором один электрон для восстановления пластохинона в Qn-сайте поступает из окисляемой молекулы пластохинона, а второй приходит от молекулы ферредоксина через ферредоксин-НАДФ+-редуктазу[англ.]. Поскольку второй электрон в такой схеме приходит от ферредоксина, то нет нужды окислять второй пластохинон и восстанавливать второй пластоцианин. В результате реакции второй части Q-цикла просто не происходят и комплекс возвращается в исходное состояние. Поскольку окисление пластохинола — лимитирующий шаг всего процесса, то весьма вероятно, что этот путь позволяет увеличить скорость транспорта электронов по ЭТЦ хлоропластов, а значит, и скорость фотосинтеза в целом[8][21].
Циклический транспорт электронов
[править | править код]В отличие от митохондриального комплекса III, цитохром-b6f-комплекс осуществляет ещё один вид электронного транспорта, необходимый для циклического фотофосфорилирования. Электрон от ферредоксина передаётся на пластохинон, а затем на цитохром-b6f-комплекс, где используется для восстановления пластоцианина, который затем вновь окисляется П700 в фотоситеме I[22]. Точный механизм того, как пластохинон восстанавливается ферредоксином, ещё не известен и является дискуссионным. Одно из предположений состоит в том, что существует специальный фермент ферредоксинпластохинонредуктаза или НАДФН-дигидрогеназа[22]. В качестве наиболее вероятного кандидата на эту роль последнее время рассматривают ферредоксин-НАДФ+-редуктазу, которая может образовывать комплекс с цитохром-b6f-комплексом. Полагают также, что в качестве акцептора электронов в циклическом транспорте может участвовать гем cn[20][21]. Большое количество данных также говорит в пользу образования суперкомплекса из цитохром-b6f-комплекса, ФСI, ферредоксин-НАДФ+-редуктазы и трансмембранного белка PGRL1. Образование и распад такого комплекса, как полагают, переключает режим потока электрона с нециклического на циклический и обратно[23][24].
Сравнение цитохром-bc1 и цитохром-b6f-комплексов
[править | править код]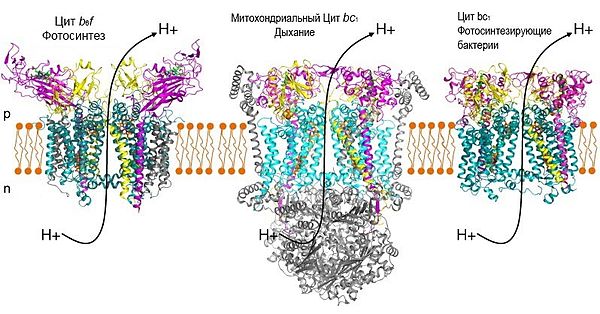
Цитохром-bc1-комплекс и цитохром-b6f-комплекс — это близкие по своей структуре белковые комплексы, из которых первый присутствует во внутренней мембране митохондрий, а второй в мембране тилакоидов хлоропластов. Оба эти фермента осуществляют сходную реакцию по механизму Q-цикла, окисляя мембранные хиноны, что сопровождается транслокацией протонов. Открытие того факта, что оба эти комплекса работают по одному принципу, привело к осознанию единства принципов биоэнергетики во всех доменах живого.
Топология хлоропласта может быть получена из топологии митохондрий простым способом: для этого можно представить, что впячивания внутренней митохондриальной мембраны полностью отпочкуются и образуют компартмент, топологически эквивалентный тилакоидам хлоропластов. В митохондрии цитохром bc1-комплекс перекачивает протоны из матрикса в мембранное пространство, а в хлоропластах цитохром-b6f-комплекс закачивает протоны из стромы в замкнутое внутренне пространство тилакоида и таким образом находится в перевёрнутом положении к цитохром-bc1-комплексу относительно плоскости мембраны.
Ядро комплекса структурно схоже с ядром цитохрома bc1. Железосерные белки Риске обоих комплексов гомологичны друг другу[25]. Однако цитохром f и цитохром c1 не гомологичны[26] и имеют разную третичную структуру: цитохром f состоит преимущественно из β-листов, в то время как цитохром c1 — из α-спиралей. Тем не менее, оба полипептида несут ковалентно связанный гем типа c, который принимает электрон от железосерного центра Риске. В данном случае можно говорить о конвергентной эволюции этих двух белков[18].
Цитохром b6 и субъединица IV гомологичны цитохрому b[27]. У субъединицы IV (PetD) на одну трансмембранную альфа-спираль меньше, чем у С-конца цитохрома b, которому она соответствует. Третичная структура этого участка отличается ещё и из-за молекулы хлорофилла а, вставленной между α-спиралями субъединицы IV. Структура же цитохрома b6 в целом соответствует четырёхспиральному N-концевому домену цитохрома b[18].
У цитохром-bc1-комплекса нет субъединиц, гомологичных малым субъединицам цитохром-b6f-комплекса (Pet G, L, M и N), а их место в комплексе занимают липиды. В структуре цитохром-bc1-комплекса также есть несколько внешних полипептидов, как водорастворимых, так и трансмембранных, которые можно обнаружить только в эукариотических комплексах. Таких субъединиц нет в прокариотических bc1 и участвующих в фотосинтезе b6f-комплексах[18].
Цитохром-b6f-комплекс содержит три дополнительных простетических группы, которых нет в bc1-комплексе: необычный гем cn, хлорофилл а и β-каротин. Наличие этих групп существенно сказывается на структуре и работе комплекса, его кинетических и равновесных характеристиках. Фитольный хвост хлорофилла а заходит в портал, который ведёт к Qp-сайту комплекса, что может влиять на время связывания и прибывания в нём хинонов. Гем cn служит местом связывания хинонов в Qn-сайте b6f-комплекса, а в bc1-комплексе этот сайт состоит из аминокислот, окружающих гем bn, и более доступен для хинонов. Такие структурные различия существенно уменьшают селективность и эффективность связывания ингибиторов в Qn-сайте[18]. β-каротин предположительно выполняет структурную функцию, соединяя малые субъединицы при помощи гидрофобных взаимодействий подобно тому, как зубочистка соединяет канапе[21].
Регуляция
[править | править код]Поскольку цитохром-b6f-комплекс находится на пересечении всех основных метаболических процессов клетки, на его экспрессию и сборку оказывают влияние практически все основные внешние и внутренние факторы: качество и интенсивность света, концентрация активных форм кислорода, уровень фитогормонов, уровень восстановленности пула пластохинонов и уровень сахаров в клетке. Многие из сигнальных путей, влияющих на экспрессию компонентов комплекса, могут перекрываться и взаимодействовать между собой. Ещё больше усложняет картину передача сигналов между ядром и хлоропластами с целью координации синтеза субъединиц, закодированных в пластидах и в ядре[9].
Регуляция осуществляется на уровне транскрипции, а также сборки комплекса в мембране тилакоида. Весь процесс регуляции ещё плохо изучен, а у высших растений практически не исследован. Эксперименты на одноклеточной водоросли C. reinhardtii показали, что ядерный фактор транскрипции MCA1 стабилизирует мРНК цитохрома f. Незрелый цитохром f, взаимодействуя с MCA1, приводит к его протеолизу, снижая таким образом уровень собственной экспрессии. У высших растений белок PRFB3 стабилизирует 3’-конец транскрипта petB в условиях яркого освещения, но его вклад в изменение уровня цитохром-b6f-комплекса очень небольшой. Вероятно также, что определённый вклад в регуляцию комплекса вносят вспомогательные белки, осуществляющие вставку гемов в цитохромы b6 и f. Наличие гемов стабилизирует эти белки и необходимо для их правильной укладки. Неправильно же уложенные белки нестабильны и быстро подвергаются протеолизу[9].
Синтез цитохромного комплекса стехиометрически скоординирован с синтезом АТФ-синтазы хлоропластов и зависит от скорости и линейного потока электронов, а также скорости ассимиляции листом CO2[9].
Биологические функции
[править | править код]В процессе фотосинтеза цитохром-b6f-комплекс обеспечивает транспорт электронов между двумя реакционными центрами — от фотосистемы II к фотосистеме I, а также транспорт протонов из стромы хлоропластов в просвет тилакоида[5]. Электронный транспорт отвечает за создание протонного градиента, который обеспечивает синтез АТФ в хлоропластах[11].
Цитохром-b6f-комплекс является важным регуляторным участником ЭТЦ хлоропластов. Здесь он выполняет много важных регуляторных функций. Во-первых, он осуществляет координацию скорости нециклического потока электронов и восстановления НАДФ+ с синтезом АТФ. Взаимосвязь всех этих процессов осуществляется через pH внутритилакоидного пространства. Во-вторых, цитохром-b6f-комплекс является редокс-сенсорм ЭТЦ хлоропластов и чутко реагирует на восстановленность пула пластохинонов. При повышения уровня восстановленности пула пластохинонов он индуцирует переход хлоропластов из состояния 1 в состояние 2, активируя специфическую протеинкиназу, фосфорилирующую белки ССКII. В результате фосфорилирования меняется расположение ССКII в мембране и снижается поток энергии света в фотосистему II[28]. В качестве вероятных моделей такой индукции рассматривают активацию через хлорофилл а, фитольный хвост которого заходит в обменную полость в районе сайта Qp, смещение белка Риске или непосредственное восстановление цитохромным комплексом дисульфидной связи соответствующей трансмембранной протеинкиназы с использованием железосерного центра белка Риске[29].
Число оборотов этого комплекса самое низкое по сравнению с остальными компонентами ЭТЦ хлоропластов, поэтому он контролирует скорость фотосинтеза и может снижать скорость протекающих внутри себя реакций в зависимости от интенсивности света или pH. Механизм этого процесса неизвестен[30]. Также показана роль комплекса в усилении или ослаблении циклического потока электронов независимо от состояния хлоропластов, но в прямой зависимости от их редокс-потенциала[24].
Положение в мембране
[править | править код]Цитохромный комплекс примерно в равных количествах присутствует в мембранах тилакоидов стромы и гран. В мембранах гран он участвует в нециклическом транспорте электронов, а в мембранах стромы, где присутствует в основном только фотосистема I, — в циклическом[16]. В среднем на один комплекс фотосистемы I приходится 1,5—1,8 комплексов фотосистемы II, 8 ССКII, 1,5 цитохром-b6f-комплекса, 10—14 молекул пластохинона, 6—8 молекул пластоцианина и около 10 молекул ферредоксина[31].
Галерея
[править | править код]- Мономер Цит. b6f.
- Цит. b6f в мембране.
- Цит. b6f с кофакторами и липидами.
- Цит. b6f, вид снизу.
- Цит. b6f из M. laminosus (1vf5).
- Цит. b6f из M. laminosus (2d2c).
- Цит. b6f, вид сбоку.
- Цит. b6f из C. reinhardtii.
- Цит. f из Brassica rapa.
- Два Цит. f из C. reinhardtii.
- Белок Риске из M. laminosus.
- Белки Риске в Цит. b6f, вид сверху.
- Положение двух белков Риске в Цит. b6f.
См. также
[править | править код]- Фотосистема I
- Фотосистема II
- Терминальная оксидаза
- Альтернативная оксидаза
- Окислительное фосфорилирование
- Цитохром-bc1-комплекс
Примечания
[править | править код]- ↑ PDB id:1q90
- ↑ 1 2 Хелдт, 2011, с. 95.
- ↑ Berg, Jeremy M. (Jeremy M.); Tymoczko, John L.; Stryer, Lubert.; Stryer, Lubert. Biochemistry. Biochemistr (неопр.). — New York: W.H. Freeman[англ.], 2007. — ISBN 978-0-7167-8724-2.
- ↑ 1 2 Ермаков, 2005, с. 176.
- ↑ 1 2 3 Hasan SS.; Yamashita E.; Baniulis D.; Cramer WA.;. Quinone-dependent proton transfer pathways in the photosynthetic cytochrome b6f complex (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2013. — February (vol. 110, no. 11). — P. 4297—4302. — doi:10.1073/pnas.1222248110. — PMID 23440205. — PMC 3600468. Архивировано 9 июня 2022 года.
- ↑ 1 2 Cramer Lab. Project Page: Cytochrome b6f complex. Дата обращения: 5 августа 2015. Архивировано 23 июля 2012 года.
- ↑ 1 2 3 Marta Hojka, Wolfram Thiele, Szilvia Z. Tóth, Wolfgang Lein, Ralph Bock and Mark Aurel Schöttler. Inducible Repression of Nuclear-Encoded Subunits of the Cytochrome b6f Complex in Tobacco Reveals an Extraordinarily Long Lifetime of the Complex1 (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2014. — August (vol. 165, no. 4). — P. 632—1646. — doi:10.1104/pp.114.243741. — PMID 24963068. Архивировано 24 сентября 2015 года.
- ↑ 1 2 3 4 5 D. Baniulis‡, E. Yamashita§, H. Zhang–, S. S. Hasan and W. A. Cramer. Structure–Function of the Cytochrome b6f Complex (англ.) // Photochemistry and Photobiology[англ.] : journal. — 2008. — 30 July (vol. 84). — P. 1349—1358. — doi:10.1111/j.1751-1097.2008.00444.x. — PMID 19067956.
- ↑ 1 2 3 4 5 6 7 Mark Aurel Schöttler, Szilvia Z. Tóth, Alix Boulouis and Sabine Kahlau. Photosynthetic complex stoichiometry dynamics in higher plants: biogenesis, function, and turnover of ATP synthase and the cytochrome b6f complex (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2014. — 24 November. — doi:10.1093/jxb/eru495.
- ↑ 1 2 Whitelegge JP.; Zhang H.; Aguilera R.; Taylor RM.; Cramer WA. Full subunit coverage liquid chromatography electrospray ionization mass spectrometry (LCMS+) of an oligomeric membrane protein: cytochrome b(6)f complex from spinach and the cyanobacterium Mastigocladus laminosus (англ.) // Molecular & Cellular Proteomics : journal. — 2002. — October (vol. 1, no. 10). — P. 816—827. — doi:10.1074/mcp.m200045-mcp200. — PMID 12438564.
- ↑ 1 2 Voet Donald J. Biochemistry / Donald J. Voet ; Judith G. Voet (неопр.). — New York, NY: Wiley, J, 2011. — ISBN 978-0-470-57095-1.
- ↑ 1 2 3 4 William A. Cramer, Huamin Zhang. Consequences of the structure of the cytochrome b6f complex for its charge transfer pathways (англ.) : journal. — 2006. — 24 April (vol. 1757, no. 5—6). — P. 339—345. — doi:10.1016/j.bbabio.2006.04.020. Архивировано 24 сентября 2015 года.
- ↑ Danny C.I. Yao, Daniel C. Brune, Wim F.J. Vermaas. Lifetimes of photosystem I and II proteins in the cyanobacterium Synechocystis sp. PCC 6803 (англ.) : journal. — 2012. — 20 January (vol. 586, no. 2). — P. 169—173. — doi:10.1016/j.febslet.2011.12.010.
- ↑ Cramer WA. Zhang H. Yan J. Kurisu G. Smith JL. Evolution of photosynthesis: time-independent structure of the cytochrome b6f complex (англ.) // Biochemistry : journal. — 2004. — May (vol. 43, no. 20). — P. 5921—5929. — doi:10.1021/bi049444o. — PMID 15147175.
- ↑ 1 2 3 4 Stroebel D., Choquet Y., Popot J.L., Picot D. An atypical haem in the cytochrome b(6)f complex (англ.) // Nature. — 2003. — November (vol. 426, no. 6965). — P. 413—418. — doi:10.1038/nature02155. — PMID 14647374.
- ↑ 1 2 Ермаков, 2005, с. 177.
- ↑ Ермаков, 2005, с. 243.
- ↑ 1 2 3 4 5 6 S. Saif Hasana, Eiki Yamashitab, William A. Cramera. Transmembrane signaling and assembly of the cytochrome b6f-lipidic charge transfer complex (англ.) // Biochimica et Biophysica Acta[англ.] : journal. — Vol. 1827, no. 11—12. — P. 1295—1308. — PMID 23507619.
- ↑ Ермаков, 2005, с. 240.
- ↑ 1 2 Cramer WA.; Zhang H.; Yan j.; Kurisu G.; Smith JL. Transmembrane traffic in the cytochrome b6f complex (англ.) // Annual Review of Biochemistry[англ.] : journal. — 2006. — Vol. 75. — P. 769—790. — doi:10.1146/annurev.biochem.75.103004.142756. — PMID 16756511.
- ↑ 1 2 3 4 Cramer WA.; Yan J.; Zhang H.; Kurisu G.; Smith JL. Structure of the cytochrome b6f complex: new prosthetic groups, Q-space, and the 'hors d'oeuvres hypothesis' for assembly of the complex (англ.) // Photosynth Res : journal. — 2005. — Vol. 85, no. 1. — P. 133—143. — doi:10.1007/s11120-004-2149-5. — PMID 15977064.
- ↑ 1 2 Pierre Joliot and Anne Joliot. Cyclic electron transfer in plant leaf (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2011. — 17 May (vol. 99, no. 15). — P. 10209—10214. — doi:10.1073/pnas.102306999.
- ↑ Masakazu Iwai, Kenji Takizawa, Ryutaro Tokutsu, Akira Okamuro, Yuichiro Takahashi & Jun Minagawa. Isolation of the elusive supercomplex that drives cyclic electron flow in photosynthesis (англ.) // Nature : journal. — 2010. — 22 April (vol. 464). — P. 1210—1213. — doi:10.1038/nature08885.
- ↑ 1 2 Hiroko Takahashi, Sophie Clowez, Francis-André Wollman, Olivier Vallon & Fabrice Rappaport. Cyclic electron flow is redox-controlled but independent of state transition (англ.) // Nature Communications : journal. — Nature Publishing Group, 2013. — 13 June (vol. 4). — doi:10.1038/ncomms2954.
- ↑ Carrell CJ.; Zhang H.; Cramer WA.; Smith JL. Biological identity and diversity in photosynthesis and respiration: structure of the lumen-side domain of the chloroplast Rieske protein (англ.) // Structure : journal. — 1997. — December (vol. 5, no. 12). — P. 1613—1625. — doi:10.1016/s0969-2126(97)00309-2. — PMID 9438861.
- ↑ Martinez SE.; Huang D.; Szczepaniak A.; Cramer WA.; Smith JL. Crystal structure of chloroplast cytochrome f reveals a novel cytochrome fold and unexpected heme ligation (англ.) // Structure : journal. — 1994. — February (vol. 2, no. 2). — P. 95—105. — doi:10.1016/s0969-2126(00)00012-5. — PMID 8081747.
- ↑ Widger WR.; Cramer WA.; Herrmann RG.; Trebst A. Sequence homology and structural similarity between cytochrome b of mitochondrial complex III and the chloroplast b6-f complex: position of the cytochrome b hemes in the membrane (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1984. — February (vol. 81, no. 3). — P. 674—678. — doi:10.1073/pnas.81.3.674. — PMID 6322162. — PMC 344897.
- ↑ Ермаков, 2005, с. 179.
- ↑ Sujith Puthiyaveetil. A mechanism for regulation of chloroplast LHC II kinase by plastoquinol and thioredoxin (англ.) // FEBS Letters[англ.] : journal. — 2011. — 6 May (vol. 585, no. 12). — P. 1717—1721. — doi:10.1016/j.febslet.2011.04.076. Архивировано 9 марта 2016 года.
- ↑ Alexander N. Tikhonov. The cytochrome b6f complex at the crossroad of photosynthetic electron transport pathways (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2014. — August (vol. 81). — P. 163—183. — doi:10.1016/j.plaphy.2013.12.011.
- ↑ Ермаков, 2005, с. 180.
Литература
[править | править код]- Зитте П. и др. Ботаника / Под ред. В. В. Чуба. — 35-е изд. — М.: Академия, 2008. — Т. 2. Физиология растений. — 495 с.
- Медведев С. С. Физиология растений. — СПб.: БХВ-Петербург, 2013. — 335 с.
- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.
- Хелдт Г. В. Биохимия растений. — М.: БИНОМ. Лаборатория знаний, 2011. — 471 с.
Ссылки
[править | править код]- Информационная система «Фотосинтетическая мембрана»
- Q цикл на сайте «Фотосинтетическая мембрана»
- «Циклический и нециклический поток электронов.» в онлайн энциклопедии Физиология растений
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |