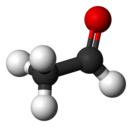
Ацетальдегид

| Ацетальдегид | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование | Этаналь | ||
| Традиционные названия | Ацетальдегид, метилформальдегид, уксусный альдегид, "альдоцит" | ||
| Хим. формула | С2H4O | ||
| Рац. формула | СH3СHO | ||
| Физические свойства | |||
| Состояние | Жидкость | ||
| Молярная масса | 44,0526 ± 0,0022 г/моль | ||
| Плотность | 0,784 г/см³ | ||
| Динамическая вязкость | ~0,215 при 20 °C | ||
| Энергия ионизации | 10,22 ± 0,01 эВ[1] и 10,23 эВ[3] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −123,37 °C | ||
| • кипения | 20,2 °C | ||
| • вспышки | −36 ± 1 ℉[1] | ||
| • воспламенения | 234,15 K (−39 °C) °C | ||
| • самовоспламенения | 458,15 K (185 °C) °C | ||
| Пределы взрываемости | 4-60 % | ||
| Критическая точка | 192,85 | ||
| Энтальпия | |||
| • образования | -166 кДж/моль | ||
| Давление пара | 279,450 °C; 492,670 °C; 1014100 °C кПа[2] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 13,57 (25 °C) | ||
| Растворимость | |||
| • в воде | С водой и этанолом смешивается во всех соотношениях. | ||
| Оптические свойства | |||
| Показатель преломления | 1,3316 | ||
| Структура | |||
| Дипольный момент | 2,750 ± 0,006 Д | ||
| Классификация | |||
| Рег. номер CAS | 75-07-0 | ||
| PubChem | 177 | ||
| Рег. номер EINECS | 200-836-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | AB1925000 | ||
| ChEBI | 15343 | ||
| Номер ООН | 1089 | ||
| ChemSpider | 172 | ||
| Безопасность | |||
| Предельная концентрация | 5 мг/м3 | ||
| ЛД50 | 1232 мг/кг (мыши, внутрижелудочно), 900 мг/кг (мыши, перорально), 661 мг/кг (крысы, перорально) | ||
| Токсичность | умеренно токсичен, ирритант, опасен для окружающей среды | ||
| Пиктограммы ECB | | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Ацетальдеги́д (у́ксусный альдегид, этана́ль, в просторечии — альдоцит, химическая формула — С2H4O или СH3СHO) — органическое соединение, относящееся к классу альдегидов. Является альдегидом этанола и уксусной кислоты.
При стандартных условиях это бесцветная жидкость с резким запахом. Умеренно токсичен, является ирритантом и опасен для окружающей среды.
В больших концентрациях обнаруживается в байцзю[4], креплёных винах, алкогольных напитках из мезги, яблок, агавы и сахарного тростника[5].
Нахождение в природе
[править | править код]Ацетальдегид широко встречается в природе, например, он встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями в процессе их метаболизма.[источник?]
Физические свойства
[править | править код]Вещество представляет собой бесцветную ядовитую жидкость при стандартных условиях (0 °C), бесцветный газ с резким запахом, похожим на запах прелых яблок при комнатной температуре (25 °C), хорошо растворяется в воде, спирте, эфире. Из-за очень низкой температуры кипения (20,2 °C) хранят и перевозят ацетальдегид в виде тримера — паральдегида, из которого он может быть получен нагреванием с минеральными кислотами (обычно серной).
Химические свойства
[править | править код]По своим химическим свойствам уксусный альдегид является типичным алифатическим альдегидом, и для него характерны реакции этого класса соединений. Его реакционная способность определяется двумя факторами: активностью карбонила альдегидной группы и подвижностью атомов водорода метильной группы, вследствие индуктивного эффекта карбонила.
Подобно другим карбонильным соединениям с атомами водорода у α-углеродного атома, ацетальдегид таутомеризируется, образуя енол — виниловый спирт, равновесие почти полностью смещено в сторону альдегидной формы (константа равновесия — только 6⋅10−5 при комнатной температуре[6]):
Реакция конденсации
[править | править код]Из-за небольших размеров молекулы и доступности в виде безводного мономера (в отличие от формальдегида) ацетальдегид является широко распространённым электрофильным агентом в органическом синтезе[7]. Что касается реакций конденсации, альдегид прохирален. Он используется, в основном, как источник синтона «CH3C+H(OH)» в альдольной и соответствующих реакциях конденсации. Реактив Гриньяра и литий-органические соединения реагируют с MeCHO, образуя производные гидроксиэтила. В одной из реакций конденсации, три эквивалента формальдегида присоединяются, а один восстанавливает образующийся альдегид, образуя из MeCHO пентаэритрит (C(CH2OH)4.)
В реакции Штрекера[8] ацетальдегид конденсируется с цианидом и аммиаком, образуя после гидролиза аминокислоту — аланин[9]. Ацетальдегид способен конденсироваться с аминами образуя имины, так как конденсация циклогексиламина даёт N-этилиден циклогексиламин. Эти имины могут быть использованы для прямой последующей реакции, таких, как альдольная конденсация[10].
Ацетальдегид также — важный строительный блок для синтезов гетероциклических соединений. Выдающийся пример — конверсия под действием аммиака до 5-этил-2-метилпиридина («альдегид-коллидин»)[11]
Реакция альдольной конденсации обусловлена подвижностью водорода в альфа-положении в радикале и осуществляется в присутствии разбавленных щелочей. Её можно рассматривать как реакцию нуклеофильного присоединения одной молекулы альдегида к другой:
Производные ацеталя
[править | править код]Три молекулы ацетальдегида конденсируются, образуя «паральдегид» — циклический тример, содержащий одиночные С-О связи. Конденсация четырёх молекул даёт циклическое соединение, называемое метальдегид.
Ацетальдегид образует стабильные ацетали при реакции с этанолом в условиях дегидратации. Продукт CH3CH(OCH2CH3)2 называется «ацеталь»[12], хотя термин используется для описания более широкой группы соединений с общей формулой RCH(OR')2.
Получение
[править | править код]В 2003 году глобальное производство ацетальдегида составляло около миллиона тонн в год.
Ацетальдегид получают следующими способами:
1) Окисление этилена (Вакер-процесс):
В качестве окислителя в Вакер-процессе используется хлорид палладия, регенерирующийся окислением хлоридом меди в присутствии кислорода воздуха:
2) Гидратация ацетилена в присутствии солей ртути (реакция Кучерова), с образованием енола, изомеризующегося в альдегид:
3) Окисление или дегидрирование этилового спирта, на медном или серебряном катализаторе (данный способ получения доминировал до открытия Вакер-процесса):
Применение
[править | править код]Ацетальдегид применяют для получения уксусной кислоты, бутадиена, некоторых органических веществ и альдегидных полимеров.
Ранее ацетальдегид в основном использовался в качестве прекурсора к уксусной кислоте. Такое применение было отвергнуто ввиду того, что уксусная кислота более эффективно производилась из метанола при помощи процессов Монсанто[13] и Катива[14]. В терминах реакции конденсации, ацетальдегид — важный прекурсор к пиридиновым производным, пентаэритролу и кротональдегиду. Мочевина и ацетальдегид конденсируются, образуя смолы. Уксусный ангидрид реагирует с ацетальдегидом, давая этилидендиацетат, из которого получают винилацетат — мономер поливинилацетата.
Биохимия
[править | править код]В печени ацетальдегид образуется в результате окисления этанола посредством фермента алкогольдегидрогеназы, а затем окисляется в безопасную уксусную кислоту под воздействием альдегиддегидрогеназы. Эти две реакции окисления связаны с восстановлением NAD+ в NADH[15]. Образование уксусной кислоты проходит быстро, и после употребления умеренных доз алкоголя ацетальдегид обнаруживается в крови в крайне малых количествах. Ингибирование альдегиддегидрогеназы приводит к повышению уровня ацетальдегида в крови и вызывает ряд негативных эффектов. В то же время было показано отсутствие негативных эффектов при употреблении малых доз алкоголя у испытуемых, находившихся под воздействием дисульфирама. Ацетальдегид плохо проникает в мозг из кровеносной системы из-за присутствия альдегиддегидрогеназы в гематоэнцефалическом барьере[16].
В головном мозге главную роль в метаболизме этанола играет каталаза, а также цитохром P450. Полученный таким образом ацетальдегид может взаимодействовать с моноаминами и индоламинами[англ.] с образованием алкалоидов тетрагидроизохинолинового[англ.] ряда и тетрагидро-β-карболинов[англ.] соответственно[17].
Конечные шаги алкогольной ферментации в бактериях, растениях и дрожжах включают конверсию пирувата в ацетальдегид под действием пируватдекарбоксилазы, после чего — конверсию ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, но уже в обратном направлении.
Употребление алкоголя
[править | править код]Ацетальдегид, полученный из поглощённого этанола, связывает ферменты, образуя аддукты, связанные с заболеваниями органов.[18]
Одним из механизмов врождённой непереносимости алкоголя является накопление ацетальдегида.
Табачная зависимость
[править | править код]Ацетальдегид — значительная часть дыма табака. Была продемонстрирована синергическая связь с никотином, увеличивающая появление зависимости, особенно у молодёжи.[19][20]
Болезнь Альцгеймера
[править | править код]Люди, у которых отсутствует генетический фактор конверсии ацетальдегида в уксусную кислоту, могут иметь большой риск предрасположенности к болезни Альцгеймера. «Эти результаты указывают, что отсутствие ALDH2 — это фактор риска для поздно возникающей болезни Альцгеймера.»[21]
Канцероген
[править | править код]Ацетальдегид является канцерогеном первой группы.[22][23] «Существует достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) в экспериментах на животных», кроме того, ацетальдегид повреждает ДНК[24] и вызывает несоразмерное с общей массой тела развитие мускулов, связанное с нарушением белкового равновесия организма.[25] В результате исследования 818 алкоголиков ученые пришли к выводу, что у тех пациентов, которые подвергались действию ацетальдегида в большей степени, присутствует дефект в гене фермента алкогольдегидрогеназы. Поэтому такие пациенты подвержены большему риску развития рака верхней части ЖКТ и печени.[26]
Безопасность
[править | править код]Пары ацетальдегида обладают раздражающим действием на органы дыхания, в высокой концентрации могут вызвать бронхит и пневмонию. Жидкий ацетальдегид при попадании на кожу вызывает гиперемию и инфильтраты[27]. Однако токсичность ацетальдегида намного ниже, чем у формальдегида, например, потому что ацетальдегид в организме быстро окисляется до безвредной уксусной кислоты. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Кроме того, этаналь образуется при термической обработке полимеров и пластиков[28].
При длительном контакте с воздухом могут образоваться перекиси, и произойти взрыв, который может разрушить ёмкость[29].
Санитарно-гигиенические рекомендации[29]
[править | править код]- Кожа: Использование адекватной защитной одежды для предотвращения контакта с кожей.
- Глаза: Использование адекватных средств индивидуальной защиты (СИЗ) глаз
- Переодевание: При намокании (из-за пожароопасности)
- Рекомендации: Установить фонтанчики для промывки глаз, оборудовать места для быстрого переодевания
По российским гигиеническим нормативам, ПДК ацетальдегида в воздухе рабочей зоны 5 мг/м3[30], в атмосферном воздухе 0,01 мг/м3[31]. В то же время, порог восприятия запаха этого вещества может достигать 1800 мг/м3[32].
Примечания
[править | править код]- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0001.html
- ↑ Москович Ю. Л. Ацетальдегид // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 423. — 623 с.
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Ian Newman, Ling Qian, Niran Tamrakar, Yonghua Feng, Ganrong Xu. Composition of Unrecorded Distilled Alcohol ( bai jiu ) Produced in Small Rural Factories in Central China (англ.) // Alcoholism: Clinical and Experimental Research. — 2017. — Vol. 41, iss. 1. — P. 207–215. — ISSN 0145-6008. — doi:10.1111/acer.13280.
- ↑ Anna Brancato, Gianluca Lavanco, Angela Cavallaro, Fulvio Plescia, Carla Cannizzaro. Acetaldehyde, Motivation and Stress: Behavioral Evidence of an Addictive ménage à trois (англ.) // Frontiers in Behavioral Neuroscience. — 2017-02-09. — Vol. 11. — ISSN 1662-5153. — doi:10.3389/fnbeh.2017.00023.
- ↑ March, J. «Organic Chemistry: Reactions, Mechanisms, and Structures» J. Wiley, New York: 1992. ISBN 0-471-58148-8.
- ↑ Sowin, T. J.; Melcher, L. M. «Acetaldehyde» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289
- ↑ en:Strecker amino acid synthesis
- ↑ Kendall, E. C. McKenzie, B. F. (1941), «dl-Alanine», Org. Synth.; Coll. Vol. 1: 21
- ↑ Wittig, G.; Hesse, A. (1988), «Directed Aldol Condensations: β-Phenylcinnamaldehyde», Org. Synth.; Coll. Vol. 6: 901
- ↑ Frank, R. L.; Pilgrim, F. J.; Riener, E. F. (1963), «5-Ethyl-2-Methylpyridine», Org. Synth.; Coll. Vol. 4: 451
- ↑ Adkins, H.; Nissen, B. H. (1941), «Acetal», Org. Synth.; Coll. Vol. 1: 1
- ↑ en:Monsanto process
- ↑ en:Cativa process
- ↑ NAD+ to NADH Hipolito, L.; Sanchez, M. J.; Polache, A.; Granero, L. Brain metabolism of ethanol and alcoholism: An update. Curr. Drug Metab. 2007, 8, 716—727
- ↑ Giulia Muggironi, Giulia R. Fois, Marco Diana. Ethanol-derived acetaldehyde: pleasure and pain of alcohol mechanism of action (англ.) // Frontiers in Behavioral Neuroscience. — 2013. — Vol. 7. — ISSN 1662-5153. — doi:10.3389/fnbeh.2013.00087.
- ↑ Gerald A. Deehan, Sheketha R. Hauser, Jessica A. Wilden, William A. Truitt, Zachary A. Rodd. Elucidating the biological basis for the reinforcing actions of alcohol in the mesolimbic dopamine system: the role of active metabolites of alcohol (англ.) // Frontiers in Behavioral Neuroscience. — 2013. — Vol. 7. — ISSN 1662-5153. — doi:10.3389/fnbeh.2013.00104.
- ↑ Nakamura, K.; Iwahashi, K.; Furukawa, A.; Ameno, K.; Kinoshita, H.; Ijiri, I.; Sekine, Y.; Suzuki, K.; Iwata, Y.; Minabe, Y.; Mori, N. Acetaldehyde adducts in the brain of alcoholics. Arch. Toxicol. 2003, 77, 591.
- ↑ Study Points to Acetaldehyde-Nicotine Combination in Adolescent Addiction. Дата обращения: 10 апреля 2010. Архивировано из оригинала 25 августа 2009 года.
- ↑ Nicotine’s addictive hold increases when combined with other tobacco smoke chemicals, UCI study finds Архивировано 9 февраля 2011 года.
- ↑ «Mitochondrial ALDH2 Deficiency as an Oxidative Stress». Annals of the New York Academy of Sciences 1011: 36-44. April 2004. doi:10.1196/annals.1293.004. PMID 15126281. Retrieved 2009-08-13.
- ↑ IARC: IARC STRENGTHENS ITS FINDINGS ON SEVERAL CARCINOGENIC PERSONAL HABITS AND HOUSEHOLD EXPOSURES (Press release). International Agency for Research on Cancer (IARC). — «November 2, 2009 ‐‐ IARC has updated the cancer assessments of several personal habits and household exposures that cause cancer, including tobacco, areca nut, alcohol, and household coal smoke. The update was conducted with the advice of 30 scientists from 10 countries who met at IARC in October 2009. [...] The Working Group concluded that acetaldehyde associated with alcohol consumption is carcinogenic to humans (Group 1) and confirmed the classification in Group 1 of alcohol consumption and of ethanol in alcoholic beverages.» Дата обращения: 1 августа 2014. Архивировано 16 мая 2018 года.
- ↑ Chemical Summary For Acetaldehyde, US Environmental Protection Agency
- ↑ DNA and chromosome damage induced by acetaldehyde in human lymphocytes in vitro. Дата обращения: 10 апреля 2010. Архивировано 23 июля 2011 года.
- ↑ ^ Nicholas S. Aberle, II, Larry Burd, Bonnie H. Zhao and Jun Ren (2004). «Acetaldehyde-induced cardiac contractile dysfunction may be alleviated by vitamin В1 but not by vitamins B6 or B12». Alcohol & Alcoholism 39 (5): 450—454. doi:10.1093/alcalc/agh085.
- ↑ Nils Homann, Felix Stickel, Inke R. König, Arne Jacobs, Klaus Junghanns, Monika Benesova, Detlef Schuppan, Susanne Himsel, Ina Zuber-Jerger, Claus Hellerbrand, Dieter Ludwig, Wolfgang H. Caselmann, Helmut K. Seitz Alcohol dehydrogenase 1C*1 allele is a genetic marker for alcohol-associated cancer in heavy drinkers International Journal of Cancer Volume 118, Issue 8, Pages 1998—2002
- ↑ Климов А. Н., Иоффе Д. В.; Будковская Н. Г. (гиг.). Уксусный альдегид // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1985. — Т. 26 : Углекислые воды. — С. 40—41. — 560 с. : ил.
- ↑ Smoking. (2006). Encyclopædia Britannica. Accessed 27 Oct 2006.
- ↑ 1 2 NIOSH Pocket guide to chemical hazards / Michael E. Barsan (technical Editor). — NIOSH. — Cincinnati, Ohio, 2007. — С. 2. — 454 с. — (DHHS (NIOSH) Publication No. 2005-149). Архивировано 22 сентября 2017 года.
- ↑ (Роспотребнадзор). № 206. Ацетальдегид // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 18. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ↑ СанПиН 1.2.3685-21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания»
- ↑ Pliska V. and G. Janicek. Die Veranderungen der Wahrnehmungsschwellen - Konzentration der Riechstoffe in Einiger Homologischen Serien (нем.) // Heymans Institute of Pharmacology Archives internationales de pharmacodynamie et de thérapie. — Gent (Belgium), 1960. — Vol. 156. — S. 211—216. — ISSN 0003-9780.









![{\displaystyle {\mathsf {C_{2}H_{2}+H_{2}O{\xrightarrow[{}]{Hg^{2+},H^{+}}}CH_{3}CHO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a182f66624c2c00dce96a4b175c3d2deb68bb8f8)
![{\displaystyle {\mathsf {C_{2}H_{5}OH{\xrightarrow[{}]{Ag,^{o}C}}CH_{3}CHO+H_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e7aa9638121dda4cf1eb3f0f44d887d3fa91dbb)
![{\displaystyle {\mathsf {2C_{2}H_{5}OH+O_{2}{\xrightarrow[{}]{Ag,^{o}C}}2CH_{3}CHO+2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/33a80be048d2a2f469b931d82ebcfc2fe9539c5c)