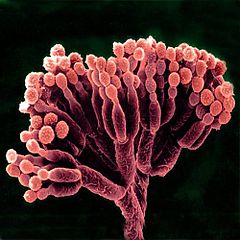
Пеницилл

| Пеницилл | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Научная классификация | ||||||||||
| Домен: Царство: Подцарство: Отдел: Подотдел: Класс: Подкласс: Порядок: Семейство: Род: Пеницилл | ||||||||||
| Международное научное название | ||||||||||
| Типовой вид | ||||||||||
| ||||||||||
Пеници́лл[1][2], также пеници́ллий[3], пеници́ллиум[1] (лат. Penicillium), — род грибов-аскомицетов, относящийся к семейству Aspergillaceae порядка Эуроциевые (Eurotiales).
Один из наиболее широко распространённых в мире родов грибов, представители которого обнаруживаются в самых различных местах — в почве, на растениях, в воздухе, в помещениях, на пищевых продуктах, в морях. С эколого-трофической точки зрения, виды рода — сапротрофы и слабые паразиты растений.
Отдельные виды используются в сыроварении — Penicillium roqueforti и P. camemberti.
К роду относят продуцентов антибиотика пенициллина — среди них P. chrysogenum, являющийся одним из самых распространённых грибов в мире. Другой крайне широко распространённый вид рода — P. citrinum.
У большинства видов преобладает анаморфная гифомицетовая стадия, образующая конидиогенные клетки с цепочками конидий. Телеоморфы, как правило (и если известны), образуют жёсткие клейстотеции с восьмиспоровыми асками. Ранее к Penicillium относились исключительно анаморфные стадии грибов, в то время как телеоморфы относились к родам Eupenicillium и Talaromyces. После отмены правила раздельной номенклатуры для различных стадий жизненного цикла грибов первое из этих названий перешло в синонимику Penicillium, а ко второму роду стали относить также ряд родственных видов, известных только по анаморфной стадии и ранее включаемых в Penicillium. К 2018 году в роде описано свыше 350 признанных видов.
Основы систематики рода заложили в 1930—1940-х годах американские микологи-микробиологи Чарлз Том и Кеннет Рэйпер. В разработанной ими системе разделение рода на секции базируется на сложности строения конидиеносцев — так называемой ярусности кисточек с конидиями. Этот подход использовался и в более поздних системах классификации, поскольку оказывается удобным для определения видов по морфологическим признакам. Молекулярно-филогенетические исследования рубежа XX—XXI веков, однако, показали, что этот признак в сравнительно редких случаях коррелирует с эволюционным родством видов.
Характеристика колоний и микроморфология
[править | править код]Вегетативный мицелий обильный, полностью погружённый в агар или хотя бы частично возвышающийся над ним, формирует густые плотные колонии. Гифы неправильно ветвящиеся, септированные, обычно неокрашенные[4].

Условно выделяются четыре типа колоний пенициллов по макроморфологии. По Рэйперу и Тому, у бархатистых (англ. velvety, velutinous) колоний все или почти все вегетативные гифы погружены в субстрат; конидиеносцы густой однородной массой отходят от поверхности субстрата, придавая колониям бархатисто-зернистый облик. Войлочные (англ. lanose), или шерстистые (floccose), колонии характеризуются наличием развитого воздушного вегетативного мицелия, во время роста колоний образующего стерильный, как правило, белый край; конидиеносцы представляют собой ответвления от стерильных воздушных гиф. Колонии с мицелиальными тяжами (англ. funiculose) имеют воздушный мицелий, состоящий из сплетений гиф, как правило, восходящих над субстратом; конидиеносцы отходят от этих сплетений, также от отдельных стерильных гиф. Пучковатые (англ. fasciculate) колонии характеризуются аггрегированием простых конидиеносцев в пучки, создающим видимость крупной зернистости колонии; колонии с коремиями (coremiform) — крайний случай пучковатости, для которого характерны крупные пучки конидиеносцев с общей споровой массой, приподнятой на стерильной ножке[3][5].

Конидиеносцы образуются на недифференцированных гифах субстратного, поверхностного или воздушного мицелия, 2—5 мкм толщиной, тонкостенные, у некоторых видов с верхушечным вздутием, обычно гиалиновые, редко коричневые. Конидиеносцы септированные, на конце несут так называемую кисточку (лат. penicillus) — мутовку фиалид (одноярусная кисточка) или мутовку метул, несущих по мутовке конидиогенных клеток каждая (двухъярусная кисточка). Сам конидиеносец может дополнительно ветвиться, в результате образуются трёх- и четырёхъярусные (иногда и с большим числом ярусов) кисточки. У некоторых видов конидиеносцы заканчиваются одиночными конидиогенными клетками. Конидиогенные клетки — фиалиды (иногда называемые стеригмами) — фляговидные, обычно не превышают 15 мкм в длину. Конидии (фиалоконидии) одноклеточные, у большинства видов 2—5 мкм в наибольшем измерении, образуются базипетально на суженных в шейку верхушках фиалид. Цепочки конидий могут быстро распадаться либо длительное время сохраняться, также могут переплетаться между собой либо оставаться параллельными, образуя колонки. Конидии в массе различных оттенков зелёного, реже белые, коричневые, оливковые[4].
Некоторые виды образуют склероции в виде жёстких сплетений толстостенных гиф, представляющие собой недоразвитые клейстотеции[6].
Плодовые тела известны у сравнительно небольшого числа (около 40) видов, представляют собой видимые невооружённым глазом (100—500 мкм в диаметре) клейстотеции, шаровидные или почти шаровидные до удлинённых или неправильных, очень жёсткие, сохраняющиеся таковыми в течение недель и даже месяцев. Созревают от центра к периферии. Окраска плодовых тел белая, жёлтая, оранжевая, коричневая, редко чёрная или красная. Аски унитуникатные, обычно с 8 спорами, почти шаровидные до эллипсоидальных или грушевидных, 5—15 мкм длиной. Аскоспоры одноклеточные, широкоэллипсоидальные, линзовидные или (почти) шаровидные, 2—5 мкм в диаметре, гладкие или шероховатые, с неглубокой экваториальной бороздой или с двумя в той или иной степени выраженными параллельными экваториальными гребнями[3][4][6][7]. Отличное от других видов строение телеоморфы характерно для Penicillium eremophilum (анаморфа у этого вида неизвестна): аски у этого вида двуспоровые, клейстотеции тонкостенные[8][9].
Известны гомоталличные и гетероталличные виды, в геноме их гаплоидных клеток содержится один или два соответственно аллеля локуса MAT — MAT1-1 и (или) MAT1-2, — определяющих типы спаривания[10][11].
Расчётный размер генома у разных видов рода варьирует в довольно широких пределах — от 25 до 36 Мб. Отмечается, что Penicillium digitatum, способный поражать только плоды цитрусовых, обладает самым маленьким геномом из слабо фитопатогенных видов — 25,7 Мб. Геном патогена плодов косточковых и семечковых культур P. expansum — наибольший среди потенциальных фитопатогенов, около 31 Мб. Наиболее крупные геномы в целом — у P. camemberti и P. commune[10].
Культивирование на питательных средах
[править | править код]В качестве стандартных сред для изучения морфологии пенициллов на чашках Петри приняты агар Чапека с дрожжевым экстрактом (Czapek Yeast Extract Agar, CYA) и агар с солодовым экстрактом[нем.] (Malt Extract Agar, MEA). В отдельных исследованиях также используются среда Чапека[англ.] (Czapek Agar, CZA), овсяный агар (Oatmeal Agar, OA), креатиново-сахарозный агар (Creatine Sucrose Agar, CREA), агар с дрожжевым экстрактом и сахарозой (Yeast Extract Sucrose Agar, YES), дихлоран-глицериновый агар[нем.] (Dichloran 18 % Glycerol agar, DG18), агар с солодовым экстрактом в модификации Блексли, CYA с 5 % поваренной соли (CYAS) и другие[12].
Агаризованная среда Чапека использовалась в качестве основной для описания пенициллов в работах Рэйпера и Тома (1949), Пидопличко (1972), Рамиреса (1982). YES используется для определения характеристик, связанных со вторичными метаболитами грибов. Овсяный агар наиболее эффективен для стимулирования полового размножения у пенициллов. Изменение цвета среды под колониями на CREA, связанное с выделением кислот и оснований (и вообще способность или неспособность расти на этой среде, где в качестве источника азота используется креатин), помогает различить некоторые близкородственные виды. DG18 и CYAS позволяют характеризовать рост грибов при пониженной доступности воды[12].
Для развития нормальной окраски спороношения в питательных средах необходимо наличие следовых количеств сульфата цинка и сульфата меди[12].
Морфологически сходные группы грибов
[править | править код]Кисточковидно разветвлённые конидиеносцы с фиалидами, образующими конидии в базипетальных цепочках, характерны для целого ряда анаморф. Эти роды фенотипически отличимы от Penicillium по характеру ветвления конидиеносцев, форме фиалид, строению плодовых тел телеоморфы, окраске колоний.
Так, анаморфы грибов, относимых к роду Hamigera, образуют фляговидные или цилиндрические фиалиды, часто расположенные на конидиеносцах неправильно, и конидии, в массе окрашенные в коричневые тона; телеоморфы представлены мягкими аскомами из рыхлопереплетённых гиф[13].
Анаморфы Talaromyces отличаются от анаморф Penicillium обычно симметричными двухъярусными кисточками с ланцетными фиалидами; окраска спороношения часто более тёмных зелёных тонов, чем у Penicillium. Телеоморфы этого рода образуют мягкие плодовые тела из переплетённых гиф[13].
У Rasamsonia кисточки двухъярусные и трёхъярусные, с цилиндрическими фиалидами, суженными к обоим концам; конидии в массе коричневые. Плодовые тела мягкие, с тонкими стенками. Виды этого рода часто являются термофильными[13].
Sagenomella с белым, серым, зеленоватым, коричневым конидиальным спороношением, неправильно расположенными, лишь иногда собранными в мутовки, ланцетными фиалидами. Плодовые тела также мягкие, тонкостенные[13].
Trichocoma paradoxa образует двухъярусные и трехъярусные кисточки с цилиндрическими, суженными к обоим концам фиалидами, конидиальное спороношение в коричневых тонах. Плодовые тела мягкие, крупные, до 2 см в диаметре[13].
В роде Paecilomyces конидиальное спороношение в коричневых тонах, конидиеносцы неправильно мутовчато разветвлённые, фиалиды с широким основанием и длинной узкой шейкой. Плодовые тела практически не оформленные[13].
К Thermomyces относят грибы, у которых анаморфа образует одноярусные и двухъярусные кисточки либо одиночными хламидоспороподобными конидиями. Окраска спороношения зелёная. Термофилы, образующие жёсткие клейстотеции[13].
Экологические особенности
[править | править код]
Большинство видов — исконно почвенные сапротрофы, меньшая доля — оппортунистические паразиты растений, поражающие ослабленные всходы и длительно хранящиеся плоды растений. Встречаются и на прочих органических субстратах, пищевых продуктах[3][6].
В качестве наиболее распространённых видов рода указываются Penicillium chrysogenum, P. citrinum, P. digitatum, P. griseofulvum и P. hirsutum[14].
Отмечается, что пенициллы, как правило, составляют до 67 % преобладающих видов грибов во всех биогеоценозах с естественной растительностью (при этом общее разнообразие достигает 50—75 и более видов в 1 г почвы). Разнообразие пенициллов максимальное в почвах пустошей и пойменных лесов и минимально в почвах пустынь и тундр. Многие виды рода распространены повсеместно, однако часто выделяются только из определённых групп биогеоценозов. Так, Penicillium restrictum — стабильный индикатор почв травянистых сообществ по всему миру, P. montanense и P. lagena обычны в хвойных и хвойно-широколиственных лесах[15]
Некоторые виды способны развиваться при pH = 1,5—3, многие виды — при pH = 9—10 и выше. Penicillium roqueforti может медленно расти при концентрации кислорода 0,5 %. P. expansum нормально растёт при 2 % O2. Большинство видов, однако, требует более высоких концентраций кислорода. Ряд видов рода — умеренные ксерофилы, большинство видов растут при aw = 0,82, некоторые виды — и при aw = 0,78, P. eremophilum — облигатный ксерофил, не развивающийся при aw больше 0,90[8]. Большинство видов способны развиваться при температуре ниже 5 °C, некоторые — при 0 °C[16]. Описано несколько видов, относящихся к категории психротолерантов: в частности, Penicillium jamesonlandense и P. ribium. P. jamesonlandense плохо растёт при 25 °C, его температурный оптимум — 17—18 °C[14].
Значение
[править | править код]Порча пищевых продуктов
[править | править код]
Пенициллы — весьма обыкновенные плесневые грибы, встречающиеся на разнообразных пищевых продуктах. Как правило, виды этого рода вызывают менее существенные поражения пищевых продуктов, чем виды аспергилла. Многие виды рода — почвенные обитатели, попадающие на пищевые продукты только в качестве загрязнителей. Для других видов пищевые продукты являются наиболее обычным субстратом для развития. Пенициллы, встречающиеся на пищевых продуктах, разделяются на три группы: встречающиеся на свежей пище, наиболее часто — на плодах растений; поражающие зерно после уборки и во время высушивания; и встречающиеся на переработанных продуктах питания[17].
Представители рода — наиболее часто встречающиеся плесени, поражающие плоды яблони, груши, цитрусовых. На яблоках и грушах нередко поселяется Penicillium expansum, вызывающий широко распространяющуюся гниль коричневого цвета. Этот вид обнаруживается также на плодах земляники, томата, винограда, авокадо, манго. Выделяет токсин патулин. P. solitum встречается на яблоках и грушах, однако более редок. P. digitatum часто поражает плоды апельсина, реже — других цитрусовых, образуя гниль коричневого цвета. На лимонах наиболее часто встречается P. italicum, образующий голубое или голубовато-зелёное спороношение на плодах. Близкий вид P. ulaiense также встречается на плодах апельсина и лимона[17].
Penicillium brevicompactum — неспецифичный слабый патоген, иногда вызывающий гниение яблок, винограда, грибов, маниока, картофеля. Выделяет токсин микофеноловую кислоту. P. aurantiogriseum и близкие виды выделяются с разнообразных свежих растительных продуктов, синтезируют слабые токсины пеницилловую кислоту, рокфортин C, веррукозидин. Поражения чеснока вызывает вид P. allii. P. oxalicum, выделяющий секалоновую кислоту D, известен как патоген ямса и маниока[17].
Penicillium verrucosum, выделяющий охратоксин А, — наиболее экономически значимый грибок среди представителей рода в Европе, поражает зерновые культуры. В Японии на зёрнах риса изредка встречается P. citreonigrum, выделяющий цитреовиридин[17].
Порчу сыра наиболее часто вызывает Penicillium commune, представляющий собой естественную форму используемого в сыроделии вида P. camemberti. Также на сырах, производимых без использования этого вида, в качестве агента порчи может появляться P. roqueforti. Реже на сыре встречаются P. brevicompactum, P. chrysogenum, P. glabrum, P. expansum, P. solitum, P. verrucosum, P. viridicatum[17].
На маргарине и различных вареньях иногда встречается вид Penicillium corylophilum[17].
Порча древесины
[править | править код]Ксилофильные представители рода являются пионерными видами заселяющими заготовленную для строительства древесину. Наиболее частыми жалобами заказчиков при приемке деревянного дома являются жалобы на синеву, т.е. на тёмные вытянутые пятна на внутренних бревенчатых стенах дома, не поддающиеся смыванию и соскабливанию[18].
Токсичные метаболиты
[править | править код]Впервые токсичность гриба, достоверно относящегося к пенициллам, была задокументирована в 1913 году, когда Карл Олсберг и Отис Блэк наблюдали токсическое действие экстракта Penicillium puberulum (штамм NRRL 1889, использованный ими, относится к P. cyclopium[19]), выделенного с заплесневелых початков кукурузы, на животных при введении в количествах 200—300 мг на кг массы[20].
В обзоре 1981 года 85 видов рода (включая Talaromyces) указывались как продуценты токсичных веществ. Несомненно, многие из сообщений, на которых основан этот обзор, связаны с ошибочным определением видов. В 1991 году были обобщены сведения о 27 токсичных метаболитах, продуцируемых пенициллами. Из них 17 были названы потенциально опасными токсинами грибов, встречающихся на пищевых продуктах (2006)[20].
В 2007 году Джон Питт перечислил 9 микотоксинов, продуцируемых пенициллами, наиболее потенциально опасных для человека[20]:
Наиболее известным и опасным токсином, продуцируемом видом рода, Питт назвал охратоксин А. Относится к категории 2B веществ, вероятно канцерогенных для человека, согласно классификации Международного агентства по изучению рака. Токсин действует на почки, возможно, связан с возникновением очагов балканской нефропатии[англ.]. Первоначально вещество было выделено из культуры Aspergillus ochraceus, затем было показано, что его часто продуцируют штаммы A. carbonarius и редко — A. niger. Впоследствии обнаружено, что это вещество синтезируют Penicillium verrucosum и близкий вид P. nordicum. P. verrucosum встречается на растениях ячменя и пшеницы в умеренных регионах мира — в Скандинавии, Центральной Европе, Западной Канаде. В 1986 году опубликовано исследование образцов ячменя из Дании с ферм, на которых свиньи страдали заболеванием почек. Из 70 образцов в 67 было обнаружено множество грибов P. verrucosum, из 66 образцов был выделен охратоксин А[20].
По-видимому, с зерном риса, поражённым Penicillium citreonigrum, связано широкое распространение острой формы бери-бери в Японии во второй половине XIX века. С 1910 года это заболевание стало встречаться во много раз реже, что совпало с введением жёсткой государственной инспекции рисового зерна, значительно снизившей продажу заплесневелого риса. Впоследствии поражённый P. citreonigrum рис в Юго-Восточной Азии обнаруживался редко[20].
PR-токсин и рокфортин C синтезируются штаммами Penicillium roqueforti, используемого в сыроделии. Показана связь рокфортина C с гибелью собак в Канаде. Сильно ядовитый PR-токсин быстро разлагается при хранении сыра, а токсин с достаточно большой летальной дозой 50 % рокфортин C обнаруживается и в готовых сырах. Об отравлениях человека PR-токсином или рокфортином C, связанных с употреблением в пищу сыра, не известно[20].
Использование в пищевой промышленности
[править | править код]
Два вида рода часто используются в сыроделии. Для приготовления голубых сыров (рокфора, стилтона, горгондзолы, блё д'Овернь, кабралеса, данаблю и других) используется культура Penicillium roqueforti. Этот вид наиболее устойчив к продуктам молочнокислого брожения, однако способен развиваться только при небольшой концентрации поваренной соли. Грибок заселяется в отверстия в сыре, создаваемые с помощью металлических штырей, через 2—3 недели начинает интенсивно спороносить, придавая сыру сине-зелёную окраску (иногда сине-зелёный пигмент выделяется и мицелием гриба)[21].
При производстве белых сыров с плесенью (камамбер, бри, гамалуст) после первичной ферментации молочнокислыми бактериями внутри сыра начинается развитие дрожжевых грибов, а на поверхность сыра заселяется грибок P. camemberti[21].
Салями и другие сухие колбасы в ряде стран Европы (Италии, Румынии, Венгрии, Швейцарии, Испании, Франции) обычно подвергаются ферментации грибом Penicillium nalgiovense, реже — P. chrysogenum и описанным в 2015 году P. salamii[22]. Эти виды — одни из наиболее солеустойчивых плесневых грибов, их рост обычно препятствует появлению нежелательных плесневых грибков на ферментированных колбасах. P. nalgiovense выделяет протеолитические и липолитические ферменты, способствующие улучшению консистенции колбас, а образующийся при разложении белка аммиак дополняет аромат и снижает кислотность продукта[21].
Использование для производства ферментов
[править | править код]Целый ряд штаммов пенициллов используется в промышленности для синтеза ферментов. Так целлюлазы некоторых штаммов-мутантов оказываются сравнимыми по эффективности со штаммами наиболее активно используемого в промышленности вида Trichoderma reesei. Увеличенным производством целлюлаз характеризуются отдельные штаммы Penicillium brasilianum, P. brevicompactum, P. citrinum, P. chrysogenum, P. crustosum, P. echinulatum, P. expansum, P. glabrum, P. janthinellum, P. oxalicum, P. persicinum[23]. Ряд штаммов, выделяющих внекеточные хитиназы, (например, штамм вида P. ochrochloron) может использоваться для биологического контроля и производства грибных протопластов[24].
Использование в медицине
[править | править код]
Среди видов рода известно множество продуцентов природных лекарственных препаратов, в том числе антибиотиков. Свойство зелёных плесеней подавлять бактериальный рост было впервые отмечено в 1868—1872 годах В. А. Манассеиным и А. Г. Полотебновым[2]. Первый известный науке бактерицидный антибиотик, активность которого была продемонстрирована Александром Флемингом в 1928 году, — пенициллин, продуцируется пенициллами, относящимися к секции Chrysogena. Технология очистки и промышленного производства пенициллина была разработана группой под руководством Х. Флори и Э. Чейна в 1941 году. В СССР пенициллин был выделен в 1942 году З. В. Ермольевой[2]. Вещества группы пенициллинов обладают активностью по отношению к грамотрицательным и многим грамположительным бактериям, ингибируя синтез клеточной стенки[25]. В 2011 году штамм, с которым работал Флеминг, в связи с пересмотром систематики этой группы пенициллов на основании полифазного подхода, был отнесён к виду Penicillium rubens, хотя ранее причислялся P. chrysogenum (P. notatum)[26].
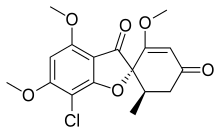
Гризеофульвин[англ.] был впервые выделен из мицелия штамма Penicillium griseofulvum А. Оксфордом, Х. Райстриком и П. Симонартом в 1938 году. Исследователи охарактеризовали этот метаболит пеницилла с химической точки зрения, описали несколько его производных. В 1946 году П. Брайен, П. Кёртис и Х. Хемминг описали нарушения роста гиф фитопатогена Botrytis allii под действием некоего «фактора искривления», вырабатываемого культурами Penicillium janczewskii. Годом позднее Дж. Гроув и Дж. Макгоуэн показали, что «фактор искривления» идентичен описанному ранее гризеофульвину. В 1958 году Дж. Джентлз в экспериментах с морскими свинками продемонстрировал эффективность гризеофульвина против грибов-дерматофитов. Гризеофульвин обладает неспецифичным фунгистатическим действием[21][27].

В 1893—1896 годах итальянский врач Бартоломео Госио выделил с заплесневелых зёрен кукурузы грибок Penicillium brevicompactum (назвав его P. glaucum) и продемонстрировал подавление развития Bacillus anthracis неизвестным метаболитом этого грибка. В 1913 году Олсберг и Блэк повторно получили это вещество из культуры штамма, определённого как P. stoloniferum, и назвали его микофеноловой кислотой[англ.]. Микофеноловая кислота — первое антибиотическое вещество грибкового происхождения, полученное в кристаллическом виде. Обладает антибактериальным, противогрибковым, противовирусным, противоопухолевым, противопсориазным, иммунодепрессантным действием, однако распространения в качестве антибиотика не получила, поскольку токсична. 2-Морфолиноэтиловый эфир микофеноловой кислоты (более легко усвояемое пролекарство, в организме гидролизующееся до микофеноловой кислоты) используется в качестве иммунодепрессанта при пересадке почек, сердца, печени. Это вещество также выделяется видом P. echinulatum[21][28].
Мевастатин[англ.] — первый известный науке статин. Получен в 1973 году в качестве метаболита Penicillium citrinum японским фармакологом Акиро Эндо. В 1976 году А. Браун выделил это же вещество из культуры P. brevicompactum, назвав его компактином. Эндо показал эффективность мевастатина в экспериментах с курицами, собаками и обезянами. Акира Ямамото из Осакского университета успешно применял небольшие дозы мевастатина для лечения пациентов с семейной гиперхолестеринемией, однако дальнейшего распространения препарат не нашёл: в 1980-х годах было показано, что при долговременном применении вещества у собак развивалась опухоль кишечника[29].
Исторические сведения, таксономия и систематика
[править | править код]Название и авторское понимание рода
[править | править код]Научное название рода Penicillium образовано от penicillus (в переводе с лат. — «кисть»), связано с кистевидными конидиеносцами, несущими фиалиды с конидиями. В русскоязычной литературе изредка встречаются переводные названия — кистеви́к[2], кистеви́дная пле́сень[30].
Род был выделен немецким естествоиспытателем Генрихом Фридрихом Линком (1767—1851) в 3-м томе «Журнала Общества друзей-естествоиспытателей[нем.]», вышедшем в Берлине 7 апреля 1809 года. Линк отнёс к роду три вида: Penicillium expansum, P. glaucum и P. candidum.
Линк описывал род следующим образом:
10. Penicillium
Вегетативное тело представлено скученными хлопьями, септированными, простыми или ветвящимися, образующими конечные прямостоячие кисточки. Споридии собраны на концах кисточек.
Оригинальный текст (лат.)Thallus e floccis cæspitosis, septatis, simplicibus aut ramosis, fertilibus erectis apicis penicillatis. Sporidia en apicibus penicillatis collecta.
— Link H. F. Observationes in Ordines plantarum naturales // Magazin der Gesellschaft Naturforschender Freunde. — Berlin, 1809. — Vol. 3. — P. 16—17.
Впоследствии, в 1816 году, Линк описал ещё один вид с кисточковидными конидиеносцами — Penicillium roseum. Также он предположил, что отличия в окраске спороношения P. expansum и P. glaucum обусловлены только характеристиками среды произрастания и объединил их под первым названием[31]. Ещё позднее, в 1824 году, Линк относил к роду 4 вида: P. glaucum, P. candidum, P. roseum, а также P. sparsum Link, ранее, согласно автору, описанный под названием Aspergillus penicillatus Grev.[32]
Род в понимании Фриса и других микологов XIX века
[править | править код]
Первая иллюстрация, определённо изображающая представителя Penicillium, была создана Пьером Бюльяром и опубликована в 1809 году под названием Mucor penicillatus[33].
В первой трети XIX века были опубликованы важнейшие работы по микологии Э. Фриса, Х. Персона и Р. Гревилла. Эти авторы приняли новый род Линка, однако имели слабое представление о том, какие виды понимались под каждым названием их первооткрывателями[33].
Элиас Магнус Фрис в 1832 году в книге Systema mycologicum объединил с родом Penicillium другой род Линка, Coremium, в который Линк в 1824 году включал виды C. glaucum Link, C. candidum (Pers.) Nees и C. citrinum Pers. Фрис отнёс к Penicillium следующие виды: Penicillium fasciculatum Sommerf., P. sparsum Link, P. crustaceum (L.) Fr. (с синонимами P. glaucum Link и P. expansum Link), P. bicolor (Fr.) Fr. (с синонимом Coremium glaucum Link), P. candidum Link, P. roseum Link.
Фрис указал в качестве типа Penicillium Link название таксона Mucor crustaceus L., который автор рода Линк в его состав не включал. Это название основано на иллюстрации Пьера Антонио Микели, изображающей некий гриб, близкий к Botrytis, однако Фрис понимал под названием Penicillium crustaceum (L.) Fr. гриб, действительно относящийся к пенициллам[34]. Вероятно, Фрис под «типом» подразумевал не номенклатурный тип в его современном понимании, а обозначал так наиболее типичного представителя рода[35][36].
В 1840—1850-х годах в составе Penicillium множество видов описали М. Беркли, К. Монтань, Г. Бонорден, Г. Фрезениус и Г. Пройс, однако большинство описанных ими видов должно относится не к этому роду, а к другим родам — например, к Cladosporium. Уже сам Монтань в 1856 году писал, что достоверно определить, какой организм использовался каждым исследователем при описании вида, невозможно — плесневые грибы хранились в гербарии в засушенном состоянии, чистые культуры исследователями не использовались. Эта же проблема присуща описаниям С. Ривольты (1873), К. Спегаццини (1895—1896), М. Кука (1871—1891)[33].
Переход к изучению чистых культур грибов был предпринят в 1850—1860-х годах в лаборатории А. де Бари. В 1874 году Оскар Брефельд опубликовал заметки о «чистой культуре» «Penicillium crustosum Fries, Penicillium glaucum Link», привёл качественные иллюстрации кисточек с конидиями. Также он описал и проиллюстрировал половую стадию с перитециями[2]. Определить, работал Брефельд с каким-то одним видом или с несколькими, не представляется возможным[33], разнообразие морфологии кисточек на его иллюстрациях свидетельствует о вероятной смешанной культуре. Наиболее близок к описанию Брефельда вид, описанный позднее как Penicillium kewense G.Sm.[37]
Работы рубежа XIX—XX веков
[править | править код]В 1890 году Улав Юхан Сопп, ученик Брефельда, пришёл к выводу, что под названием Penicillium glaucum описывается группа видов, однако не предложил вариантов их различения. Другой ученик Брефельда Карл Вемер в 1895 году опубликовал работу с описанием видов пенициллов, вызывающих плодовые гнили. Также Вемер впервые обратил внимание на физиолого-биохимические характеристики плесневых грибов и предложил выделить в отдельный род Citromyces виды, продуцирующие лимонную кислоту. Сопп в 1912 году опубликовал монографию пенициллов с описаниями около 60 видов (некоторые сопровождались цветными или чёрно-белыми иллюстрациями), однако впоследствии лишь немногие его названия были однозначно привязаны к конкретным штаммам[33].
С 1898 года над монографией пенициллов в Брюсселе работал Франсуа Диркс, в 1900 году он защитил диссертацию по пенициллам. Годом позднее он опубликовал «Сочинение о ревизии рода Penicillium Link» с 23 названиями новых видов (всего — с 25 видовыми названиями) пенициллов — лишь укороченный вариант диссертации, поскольку издать всю диссертацию с подробными описаниями и цветными иллюстрациями культур он позволить себе не смог. Описания видов в этом варианте были настолько скудными, что определить, что за грибы описывались исследователем, по одним описаниям было невозможно. Диркс предложил классифицировать виды Penicillium в два подрода — Aspergilloides с неразветвлёнными или слабо разветвлёнными конидиеносцами, заканчивающимися мутовкой фиалид, и Eupenicillium с разнообразно ветвящимися конидиеносцами. В 1902 году все штаммы, использованные Дирксом в диссертации, были утеряны. Спустя некоторое время исследователь смог восстановить культуры некоторых видов, а также выделил культуры множества новых видов, вёл подробные записи своих наблюдений. Вскоре Диркс оставил изучение пенициллов и передал свою диссертацию, все рисунки и записи своему учителю Филиберу Бьюржу. В 1923 году Бьюрж опубликовал новую монографию рода с подробным описанием 133 видов, включая ряд видов, впервые выделенных и описанных Дирксом[38].
В 1905—1914 годах Жорж Бенье опубликовал серию подробных описаний пенициллов, сопровождаемых иллюстрациями. Также он в 1907 году выделил два новых рода — Paecilomyces и Scopulariopsis, — отличающихся строением конидиогенных клеток и характером разветвления конидиеносцев[33].
В 1926 году польский фитопатолог Кароль Залеский защитил диссертацию (опубликована годом позднее), в которой описал 35 новых видов пенициллов, обнаруженных им в почвах на территории Польши. По ряду вопросов Залеский консультировался с Бьюржем, отсылал ему культуры грибов и свои заметки[33].
Работы Тома и сотрудников
[править | править код]Наиболее значимыми работами по систематике пенициллов являются публикации американского миколога Чарлза Тома (1872—1956) в первой половине XX века. Том и Кеннет Рэйпер (1908—1987) считаются «отцами-основателями систематики пенициллов»[12].

В 1906 году Том опубликовал названия Penicillium camemberti и P. roqueforti для видов рода, используемых при приготовлении сыра и ранее ошибочно именовавшихся P. album и P. glaucum соответственно[39]. В 1910 году он выбрал в качестве лектотипа рода Penicillium expansum Link — подробно описанный Линком вид, авторское понимание которого наиболее чётко соответствует пониманию вида в более поздней литературе[40].
Том в 1930 году в книге «Пенициллы» опубликовал ревизию всех названий, обнародованных в роде Penicillium к этому времени. Он принял в составе рода 300 видов, подготовил их описания. Для видов, однозначно идентифицировать которые по литературным данным автор не смог, он сделал соответствующие пометки, по возможности указав для них близкие виды. Тому присылал штаммы пенициллов Бьюрж, благодаря чему американский исследователь имел хорошее представление о видах, описанных ранее Дирксом и самим Бьюржем.
В 1949 году Рэйпер и Том издали «Справочник пенициллов», где признавали самостоятельность 137 видов рода. В системе Рэйпера и Тома виды объединены в небольшие группы, именуемые рядами (series). Все ряды распределены по четырём секциям в зависимости от характера ветвления конидиеносцев — Monoverticillata с конидиеносцами, заканчивающимися одиночными пучками фиалид, Asymmetrica с иногда разветвлёнными конидиеносцами, заканчивающимися пучками обычно асимметрично расположенных неравных метул, Biverticillata-Symmetrica с конидиеносцами, заканчивающимися пучками равных метул с ланцетовидными фиалидами, Polyverticillata с многократно разветвлёнными конидиеносцами (впоследствии перенесены в Scopulariopsis). Авторы отмечали, что определение культур в ту или иную группу по ярусности кисточек часто является произвольным, поскольку весьма обыкновенны промежуточные формы, ярусность которых с уверенностью определить нельзя. Подсекции и ряды в пределах секций выделяются авторами главным образом на основании макроморфологического строения колоний. В этой же работе авторы обосновали различия пенициллов от родов Gliocladium (который они считали идентичным Clonostachys), Paecilomyces, Scopulariopsis (в который авторы включали также вид Penicillium sacculum)[41].
Публикации по систематике рода других авторов второй половины XX века
[править | править код]В 1950 году в «Ботанических материалах Отдела споровых растений Ботанического института АН СССР» вышла статья Татьяны Владимировны Халабуды «Новые виды из рода Penicillium Link», в которой были описаны 7 новых видов (впоследствии 4 из них сведены в синонимы более ранних названий). В 1968 году Вафа Хусни Багдади опубликовал в «Новостях систематики низших растений» описания 12 новых видов рода, обнаруженных в почвах Сирии[42], 10 из этих названий были впоследствии включены в синонимику других видов.
В 1955 году Честер Бенджамин определил половые стадии пенициллов, у которых стенки клейстотециев мягкие, сложены переплетёнными гифами (так называемые гимнотеции), в род Talaromyces. Бесполые стадии этих грибов относились к секции Biverticillata-Symmetrica по Рэйперу и Тому[43]. В 1967 году Амелия Сток и Ди Скотт предложили использовать половых стадий пенициллов, не выделенных в Talaromyces, забытое название Eupenicillium F.Ludw. (до этого в литературе половые стадии пенициллов не выделялись в отдельный род, реже — выделялись в Carpenteles Langeron)[6][37].
Японский исследователь С. Абэ в 1956 году предложил для разделения видов использовать, помимо культуральных и микроморфологических характеристик, также хемотаксономические признаки: продуцирование антибиотических веществ, растворимость пигментов, изменение pH при культивировании в жидкой среде, цветовую реакцию культуральной жидкости с хлоридом железа, образование флуоресцирующих веществ, пектиназную[англ.] активность. Однако в дальнейшем было показано, что эти характеристики могут значительно варьировать у разных штаммов одного вида[44].
В 1971 году Сток и Роберт Самсон выделили два вида Talaromyces с одиночными, не связанными в цепочки асками в род Hamigera[45]. В 1972—1973 годах Сток и Самсон опубликовали определители Talaromyces и Eupenicillium. Джон Питт в 1979 году выделил род Merimbla для бесполой стадии Hamigera, отличающейся от пенициллов формой конидиеносцев и фиалид, а также цветом спороношения[46]. Впоследствии было показано, что описанный Питтом вид Merimbla ingelheimensis действительно является близким родственником Hamigera avellanea, но не идентичен ему, вследствие чего был переведён в род Hamigera в качестве самостоятельного — Hamigera ingelheimensis[47].
Николай Макарович Пидопличко в 1972 году издал определитель «Пенициллии», в котором несколько изменил систему Рэйпера и Тома. Так, он выделил дополнительную секцию Biverticillata-Cyathophora для видов с симметрично расположенными на верхушках конидиеносцев метулами с тупыми фиалидами (в отличие от Biverticillata-Symmetrica, у которых фиалиды ланцетные) — Penicillium olsonii, P. herquei, P. paxilli, а также P. verruculosum, P. aculeatum и других. Н. М. Пидопличко признавал наличие у пенициллов двух типов телеоморф — Eupenicillium и Talaromyces[3].
Работы Питта и других авторов конца XX века
[править | править код]Джон Питт в 1979 году издал новую монографию «Род Penicillium и его телеоморфные стадии Eupenicillium и Talaromyces». В этой книге автор принял самостоятельность 150 видов Penicillium, а также 37 видов Eupenicillium и 16 видов Talaromyces. Автор использовал в описаниях видов характеристики колоний пенициллов на небольшом числе питательных сред, принятых им в качестве диагностических, характеристики роста колоний при температурах +5, +25 и +37 °C, а также микроскопическое строение кисточек[48]. Множество видов из монографии Рэйпера и Тома были признаны синонимами более ранних названий, однако за период после её выхода было описано ещё большее число новых видовых таксонов. Питт разделил виды на четыре подрода — Aspergilloides с одноярусными кисточками, Furcatum с двухъярусными кисточками с фляговидными фиалидами, Penicillium с трёхъярусными кисточками и Biverticillium с двухъярусными симметричными кисточками с игловидными фиалидами[49].
В 1982 году был выпущен «Определитель и атлас пенициллов», подготовленный испанским микологом Карлосом Рамиресом. В книге принята система рода, близкая к системе Рэйпера и Тома, в ключи добавлены виды, описанные после выхода работы 1949 года (всего автором признано 252 вида). Для всех видов приведены фотографии колоний двухнедельного возраста на трёх питательных средах — агаре Чапека[англ.], агаре Чапека с дрожжевым экстрактом и агаре с солодовым экстрактом, а также рисунки и микрофотографии конидиеносцев и конидий. В качестве минимальной надвидовой категории в этой монографии, как и у Рэйпера и Тома, принят ряд[50]. Из 186 видов рода, описанных между 1949 и 1979 годами, Рамирес признавал 126 видов, в то время как Питт считал заслуживающими выделения всего 17 из них[15].
В 1985 году Питт напечатал на основе своей монографии «Лабораторное руководство по распространённым видам Penicillium», в котором опубликовал определительные ключи и подробные описания наиболее часто встречающихся видов рода. Некоторые виды помещены в ключах в нескольких местах, что отражает вариабельность их характеристик[48].
Также в 1985 году Амелия Сток и Роберт Самсон опубликовали новую систему классификации анаморф Penicillium. Согласно авторам, род разделяется на 10 секций — Torulomyces, Aspergilloides, Eladia, Divaricatum, Inordinate, Ramosum, Penicillium, Coremigenum, Biverticillium, Geosmithia. Разделение на секции основано как на признаках ветвления кисточек, в некоторых случаях играющего незначительную роль, так и на других признаках — форме фиалид (в том числе степени резкости выраженности шейки), степени прижатости метул и веточек, способности образовывать коремии. Например, в секцию Eladia попали виды Penicillium sacculum, P. melinii, P. janczewskii, P. citrinum, у Питта относящиеся к разным подродам. Аналогично, в Coremigena были объединены, помимо прочих, виды P. vulpinum и P. duclauxii[51].
Род после появления данных молекулярной филогенетики
[править | править код]В исследовании Мэри Берби и соавторов 1995 года на основании данных последовательностей 18S рРНК было показано, что род Penicillium в традиционном объёме является полифилетичным, включающим две неблизкородственные клады — кладу видов Biverticillium (Biverticillata-Symmetrica) и кладу, содержащую все остальные виды. Однородность Biverticillata-Symmetrica отмечалась ещё Рэйпером и Томом, указавшими на присущую видам этой группы отличную от остальных видов форму фиалид. Целесообразность выделения Biverticillium в отдельный род была показана и в других исследованиях последовательностей РНК в 1990—2010-х годах. Поскольку все известные телеоморфы видов этой группы относятся к роду Talaromyces, в этот род в 2011 году Роберт Самсон и соавторы перенесли все виды с анаморфами Biverticillium[52]. Среди прочих, из Penicillium были вынесен медицински значимый вид Penicillium marneffei, распространённый в Юго-Восточной Азии. Этот гриб обладает температурным диморфизмом и при температурах, близких к 37 °C, образует дрожжеподобный мицелий, способен вызывать у людей пенициллиоз (таларомикоз)[53].
| Aspergillaceae |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermoascaceae | | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В 2011 году была опубликована статья Йоса Хаубракена и Самсона, в которой была предложена кладограмма Penicillium и других родов семейства Trichocomaceae на основании анализа генов CCT8[англ.], TSR1, RBP1[англ.] и RBP2[англ.]. Хаубракен и соавторы предложили разделить семейство на три — Aspergillaceae (с наиболее крупными родами Aspergillus и Penicillium), Thermoascaceae и собственно Trichocomaceae (включающем Talaromyces). В составе Penicillium были выделены 25 клад, принятые в ранге секций, объединённых в два подрода — Aspergilloides и Penicillium[4]. В 2016 году в связи с открытием новых видов эта система была несколько модифицирована, было описано две новые секции, а Penicillium digitatum, ранее выделявшийся в самостоятельную секцию, был отнесён к секции Penicillium[56].
Основным маркером для определения грибов на основании молекулярно-филогенетических данных служит последовательность внутреннего транскрибируемого спейсера[англ.] (ITS) ДНК. Для пеницилла и целого ряда других родов аскомицетов, однако, этот участок зачастую довольно консервативен, что делает возможным однозначное определение по его последовательности только до уровня секции рода или группы видов. Для точной видовой идентификации нередко требуется секвенирование дополнительного участка ДНК. В качестве таких дополнительных участков предложены гены BenA, кодирующий β-тубулин, CaM, кодирующий кальмодулин, и RBP2, кодирующий вторую по величине субъединицу РНК-полимеразы II. Наиболее часто используется BenA[12].
Неотличимые по молекулярно-генетическим характеристикам виды Penicillium commune, P. camemberti и P. caseifulvum, ввиду их морфологических отличий, экономической значимости и различного биотехнологического применения считаются самостоятельными видами[19].
Помимо молекулярно-филогенетических методов, основанных на анализе генных последовательностей, большое значение при разделении и определении видов пеницилла имеет анализ внеклеточных метаболитов. Чаще всего используется экстракция смесью дихлорметана, этилацетата и метанола с последующим анализом профилей метаболитов методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Определение конкретных полученных веществ возможно с помощью масс-спектрометрических методов. В некоторых случаях фенотипическое определение культур невозможно без привлечения анализа метаболитов: Penicillium rubens и P. chrysogenum морфологически неотличимы, но выделяют разные наборы метаболитов. Для определения некоторых видов, выделяющих специфические, часто окрашенные, метаболиты, эффективна тонкослойная хроматография. Например, P. brevicompactum образует микофеноловую кислоту, при контакте с трихлоридом железа окрашивающуюся в зелёный цвет[12].
Современная система классификации рода
[править | править код]Объём рода, принятый в работах начала XXI века, в общих чертах соответствует объёму у Рэйпера и Тома (1949). Одно из наиболее существенных изменений — исключение из его состава секции Biverticillata-Symmetrica в род Talaromyces. Анаморфы этих видов имеют в основном игловидные (ланцетные) фиалиды, а также метулы, равные фиалидам по длине; телеоморфы (если известны) образуют мягкие плодовые тела, лишённые крепких оформленных стенок (так называемые гифотеции)[4].
В состав рода включены виды с пигментированными конидиеносцами, ранее выделявшиеся в род Thysanophora. Также в Penicillium были переклассифицированы виды Torulomyces с одиночными фиалидами на концах конидиеносцев, и виды Eladia со случайно расположенными по мицелию конидиеносцами с пучками фиалид на верхушке[4][12].
К Penicillium также отнесён вид Hemicarpenteles paradoxum (как Penicillium paradoxum, секция Paradoxa), образующий анаморфу типа Aspergillus, в то время как его телеоморфа представлена жёсткими плодовыми телами, идентичными таковым у пенициллов[4]. Напротив, Penicillium inflatum, известный только по анаморфе, морфологически близкой одноярусным пенициллам, перенесён в Aspergillus как Aspergillus inflatus[57]. В состав Penicillium был включён и вид Monascus eremophilus (как Penicillium eremophilum, предположительно, близок секции Charlesia) — единственный вид рода, для которого известна только телеоморфная стадия. Помимо этого, P. eremophilum является облигатным ксерофилом и не способен расти на обычном агаре с солодовым экстрактом, но хорошо развивается при культивировании на агаре с солодовым и дрожжевым экстрактами и 50 % глюкозы (MY50G)[8].
Показано, что степень разветвлённости конидиеносцев не является подходящим признаком для обоснования родства видов. В молекулярно-филогенетической системе классификации только две секции представлены видами исключительно с одноярусными кисточками (Aspergilloides и Eladia), при этом эти секции отнесены к разным подродам. Виды с симметричными двухъярусными, иногда дополнительно разветвлёнными, кисточками характерны для секции Citrina. Многие виды с расходящимися конидиеносцами, метулы которых образуются не только на их верхушках, но и интеркалярно, относятся к секции Lanata-divaricata. Асимметричные трёхъярусные кисточки характерны для секции Chrysogena[4].
Состав рода
[править | править код]По состоянию на 2015 год, в род включены 363 вида[54]. Постоянно обновляемый список видов рода опубликован на сайте Международной комиссии по пенициллам и аспергиллам (ICPA) — образованной в 1985 году комиссии Международного союза микробиологических обществ[англ.], в которую входят 10 крупнейших специалистов по систематике этой группы грибов[58]. Для рода Penicillium принята система внутриродового деления, опубликованная в работе Й. Хаубракена и Р. Самсона (2011)[4], с дополнениями по Й. Хаубракену и Й. Фрисваду (2016)[56].
| Подрод | Секция | Характеристика секции | Типовой вид |
|---|---|---|---|
| Aspergilloides Dierckx | Aspergilloides | Колонии быстрорастущие на большинстве сред, бархатистые. Конидиеносцы обычно одноярусные. | Penicillium aurantiobrunneum Dierckx = P. glabrum (Wehmer) Westling |
| Sclerotiora Houbraken & Samson | Конидиеносцы, как правило, одноярусные, реже — двухъярусные, с симметрично расположенными метулами. Мицелий колоний окрашенный в жёлто-оранжевые тона, обратная сторона жёлтая, оранжевая, красная. | Penicillium sclerotiorum J.F.H.Beyma | |
| Charlesia Houbraken & Samson | Конидиеносцы, как правило, вздутые на верхушке, одноярусные, реже двухъярусные, с неравными метулами. Колонии на среде Чапека с дрожжевым экстрактом обычно ограниченно растущие. | Penicillium charlesii G.Sm. | |
| Thysanophora Houbraken & Samson | Колонии тёмно-окрашенные. Конидиеносцы пигментированные, массивные. | Penicillium glaucoalbidum (Desm.) Houbraken & Samson | |
| Ochrosalmonea Houbraken & Samson | Колонии с жёлтым мицелием, бархатистые или же образующие синнемы. Фиалиды ампуловидные или игловидные, конидии с заострением на верхушке. | Penicillium ochrosalmoneum Udagawa | |
| Cinnamopurpurea Houbraken & Samson | Конидиеносцы бугорчатые, одноярусные, реже двухъярусные. Колонии медленнорастущие на агаре Чапека с дрожжевым экстрактом и агаре с солодовым экстрактом. | Penicillium cinnamopurpureum Udagawa | |
| Ramigena Thom | Конидиеносцы гладкостенные, одноярусные. Конидии эллипсоидальные до грушевидных. Колонии медленно растущие на агаризованных средах. | Penicillium cyaneum (Bainier & Sartory) Biourge | |
| Torulomyces (Delitsch) Stolk & Samson | Конидиеносцы короткие, 1—2-ярусные, реже — с одиночной фиалидой. Колонии медленнорастущие на агаре Чапека с дрожжевым экстрактом и агаре с солодовым экстрактом. | Penicillium lagena (Delitsch) Stolk & Samson | |
| Fracta Houbraken & Samson | Фиалиды ампуловидные до ланцетных, конидии эллипсоидальне. Телеоморфы с плодовыми телами, споры которых шаровидные, без рубцов и бороздок, покрытые шипиками. | Penicillium fractum Udagawa | |
| Exilicaulis Pitt | Конидиеносцы, как правило, одноярусные, без вздутия на верхушке, реже — с неправильными метулами. | Penicillium restrictum J.C.Gilman & E.V.Abbott | |
| Lanata-divaricata Thom | Колонии, как правило, широко- и быстрорастущие. Конидиеносцы у большинства видов с метулами, образующимися как на конце конидиеносца, так и интеркалярно. | Penicillium janthinellum Biourge | |
| Stolkia Houbraken & Samson | Конидиеносцы коричневые до неокрашенных. | Penicillium stolkiae D.B.Scott | |
| Gracilenta Houbraken & Samson | Конидии, как правило, широкоэллипсоидальные или эллипсоидальные. Колонии с обратной стороны оливково-коричневые или коричневые, при +37 °C, как правило, не растут. | Penicillium gracilentum Udagawa & Horie | |
| Citrina Houbraken & Samson | Кисточки, как правило, двухъярусные, с симметрично расположенными метулами. | Penicillium citrinum Thom | |
| Penicillium | Fasciculata Thom | Колонии, как правило, с зернистой или пучковатой поверхностью, быстрорастущие. Конидиеносцы шероховатые, конидии обычно шаровидные. | Penicillium hirsutum Dierckx |
| Penicillium | Колонии, как правило, пучковатые или с коремиями. Конидиеносцы обычно гладкие, с веточками, оканчивающимися неравными метулами. Конидии гладкие, эллипсоидальные, иногда почти шаровидные. Слабые фитопатогены. | Penicillium expansum Link | |
| Roquefortorum Frisvad & Samson | Колонии бархатистые, широкорастущие. Конидиеносцы грубошероховатые, двухъярусные, конидии гладкие, шаровидные. | Penicillium roqueforti Thom | |
| Chrysogena Frisvad & Samson | Колонии бархатистые до слабо хлопьевидных. Конидиеносцы 2—4-ярусные, с расходящимися элементами. Фиалиды не более 9 мкм длиной. Конидии гладкие или едва шероховатые. Большинство видов — продуценты пенициллина. Обитатели сухих мест, в том числе жилых помещений. | Penicillium chrysogenum Thom | |
| Osmophila Houbraken & Frisvad | Колонии хорошо растут при +15 °C и практически не растут при +30 °C. Конидиеносцы гладкостенные. Почвенные обитатели. | Penicillium osmophilum Stolk & Veenb.-Rijks | |
| Robsamsonia Houbraken & Frisvad | Колонии растут со средней скоростью при +25 °C, практически не растут при +30 °C. Конидии обычно эллипсоидальные, гладкостенные. Преимущественно копротрофные виды. | Penicillium robsamsonii Frisvad & Houbraken | |
| Turbata Houbraken & Samson | Конидиеносцы тонкие, двухъярусные, с симметрично расположенными метулами. | Penicillium turbatum Westling | |
| Paradoxa Houbraken & Samson | Конидиеносцы, как правило, близки к Aspergillus. Колонии с резким неприятным запахом. | Penicillium paradoxum (Fennel & Raper) Houbraken & Samson | |
| Brevicompacta Thom | Колонии бархатистые. Конидиеносцы длинные, широкие, разветвлённые, трёхъярусные, с короткими прижатыми метулами с короткими фиалидами. Конидии в длинных переплетающихся цепях. | Penicillium brevicompactum Dierckx | |
| Ramosa Stolk & Samson | Конидиеносцы 2—3-ярусные. Филогенетически плохо отделима от Brevicompacta. | Penicillium lanosum Westling | |
| Canescentia Houbraken & Samson | Конидиеносцы двухъярусные, с симметрично расположенными метулами, реже с дополнительной веточкой. Фиалиды короткие, в основании вздутые или цилиндрические, ближе к верхушке более узкие. | Penicillium canescens Sopp | |
| Eladia (G.Sm.) Stolk & Samson | Колонии на агаре Чапека плохо растущие, на агаре с солодовым экстрактом — бархатистые, тёмно-зелёные, коричнево-зелёные или оливково-коричневые. Фиалиды короткие, вздутые в основании, неправильно расположенные на верхушке конидиеносцев и на некотором отдалении от неё. | Penicillium sacculum E.Dale |
В 2000—2010-х годах опубликована серия ревизий отдельных групп в составе рода на основании совокупности молекулярных, хемотаксономических и морфологических признаков. Одна из наиболее крупных работ — «Полифазная таксономия подрода Penicillium рода Penicillium: руководство по определению трёхъярусных пенициллов с пищевых продуктов и из воздуха и их микотоксинам» Й. Фрисвада и Р. Самсона (2004), в которую включены подробные описания известных на тот момент видов секций Penicillium, Brevicompacta, Fasciculata, Roquefortorum, Chrysogena и Robsamsonia (выделенной позднее), а также Penicillium atramentosum из Paradoxa (также описанной позднее)[19]. Опубликованы таксономические ревизии секций Citrina (2010, 2011)[59][60], Chrysogena (2012)[61], Aspergilloides (2014)[62], Cinnamopurpurea (2015)[63], Lanata-divaricata (2015)[64], Exilicaulis (2016)[65], несколько работ по секции Sclerotiora (2011, 2013, 2017)[66][67][68].
Синонимы
[править | править код]Синонимика рода по Й. Хаубракену и Р. Самсону[4]:
- Carpenteles Langeron, 1922 (тип C. glaucum (Link) Langeron = Penicillium expansum Link)
- Chromocleista Yaguchi & Udagawa, 1993 (тип Ch. malachitea Yaguchi & Udagawa = P. malachiteum (Yaguchi & Udagawa) Houbraken & Samson)
- Citromyces Wehmer, 1893 (тип C. pfefferianus Wehmer = P. glabrum (Wehmer) Westling)
- Coremium Link, 1809 (тип C. glaucum Link = P. expansum Link)
- Eladia G.Sm., 1961 (тип E. saccula (E.Dale) G.Sm. = P. sacculum E.Dale)
- Eupenicillium F.Ludw., 1892 (тип E. expansum F.Ludw. = P. expansum Link)
- Floccaria Grev., 1828 (тип F. glauca Grev. = P. expansum Link)
- Hemicarpenteles A.K.Sarbhoy & Elphick, 1968 (тип H. paradoxum A.K.Sarbnoy & Elphick = P. paradoxum (Fennell & Raper) Samson et al.)
- Pritzeliella Henn., 1903 (тип Pr. caerulea Henn. = P. coprophilum (Berk. & M.A.Curtis) Seifert & Samson)
- Thysanophora W.B.Kendr., 1961 (тип Th. penicillioides (Roum.) W.B.Kendr. = P. glaucoalbidum (Desm.) Houbraken & Samson)
- Torulomyces Delitsch, 1943 (тип T. lagena Delitsch = P. lagena (Delitsch) Stolk & Samson)
Примечания
[править | править код]- ↑ 1 2 Биологический энциклопедический словарь / гл. ред. М. С. Гиляров. — М.: Советская экциклопедия, 1986. — С. 457.
- ↑ 1 2 3 4 5 Сизова Т. П. Род Пеницилл (Penicillium) // Жизнь растений / гл. ред. Ал. А. Фёдоров, ред. тома М. В. Горленко. — М.: «Просвещение», 1976. — Т. 2. — С. 383—387.
- ↑ 1 2 3 4 5 Пидопличко, 1972.
- ↑ 1 2 3 4 5 6 7 8 9 10 Houbraken & Samson, 2011.
- ↑ Raper & Thom, 1949, p. 30—34.
- ↑ 1 2 3 4 Pitt & Hocking, 2009.
- ↑ Guarro J., Gené J., Stchigel A. M. et al. Atlas of Soil Ascomycetes. — Utrecht, 2012. — P. 192—207.
- ↑ 1 2 3 Barbosa R. N., Leong S. L., Vinnere-Pettersson O. et al. Phylogenetic analysis of Monascus and new species from honey, pollen and nests of stingless bees // Studies in Mycology. — 2017. — Vol. 86. — P. 29—51. — doi:10.1016/j.simyco.2017.04.001.
- ↑ Hocking A. D., Pitt J. I. Two new species of xerophilic fungi and a further record of Eurotium halophilicum // Mycologia. — 1988. — Vol. 80. — P. 82—88.
- ↑ 1 2 Ropars J., Rodríguez de la Vega R. C., López-Villaciencio M. et al. Taxonomy of Aspergillus, Penicillium and Talaromyces and its Significance for Biotechnology // Aspergillus and Penicillium in the Post-genomic Era / R. P. de Vries, I. B. Gebler, M. R. Andersen (eds.). — 2016. — P. 27—41. — ISBN 1-910190-39-X.
- ↑ Pöggeler S., O'Gorman C. M., Hoff B., Kück U. Molecular organization of the mating-type loci in the homothallic Ascomycete Eupenicillium crustaceum // Fungal Biology. — 2011. — Vol. 115 (7). — P. 615—624. — doi:10.1016/j.funbio.2011.03.003.
- ↑ 1 2 3 4 5 6 7 Visagie et al., 2014.
- ↑ 1 2 3 4 5 6 7 Houbraken J., de Vries R. P., Samson R. A. Modern Taxonomy of Biotechnologicalle Important Aspergillus and Penicillium Species // Advances in Applied Microbiology / S. Sariaslani, G. M. Gadd (eds.). — Elsevier, 2014. — Vol. 86. — P. 209—215. — ISBN 978-0-12-800262-9.
- ↑ 1 2 Yadav et al., 2018.
- ↑ 1 2 Christensen M., Frisvad J. C., Tuthill D. E. Penicillium species diversity in soil and some taxonomic and ecological notes // Integration of Modern Taxonomic Methods for Penicillium and Aspergillus Classification / R. A. Samson, J. I. Pitt (eds.). — 2000. — P. 309—320. — ISBN 90-5823-159-3.
- ↑ Pitt J. I. Penicillium and Talaromyces: Introduction // Encyclopedia of Food Microbiology. — 2014. — Vol. 3. — P. 6—13. — doi:10.1016/B978-0-12-384730-0.00248-2.
- ↑ 1 2 3 4 5 6 Pitt, 2006.
- ↑ Горшина Е. С., Максименко С. А. Типичные грибные поражения новых деревянных сооружений : [арх. 27 октября 2020] // Современная микология в России. Материалы 3-го съезда микологов России.. — 2012. — Т. 3.
- ↑ 1 2 3 Frisvad J. C., Samson R. A. Polyphasic taxonomy of Penicillium subgenus Penicillium: A guide to identification of food and air-borne terverticillate Penicillia and their mycotoxins // Studies in Mycology. — 2004. — Vol. 49. — P. 1—174.
- ↑ 1 2 3 4 5 6 Pitt, 2007.
- ↑ 1 2 3 4 5 Frisvad J. C. Penicillia in Food Production // Encyclopedia of Food Microbiology. — 2014. — Vol. 3. — P. 14—18. — doi:10.1016/B978-0-12-384730-0.00249-4.
- ↑ Perrone G., Samson R. A., Frisvad J. C. et al. Penicillium salamii, a new species occurring during seasoning of dry-cured meat // International Journal of Food Microbiology. — 2015. — Vol. 193. — P. 91—98. — doi:10.1016/j.ijfoodmicro.2014.10.023.
- ↑ Gusakov A. V., Sinitsyn A. P. Cellulases from Penicillium species for producing fuels from biomass // Biofuels. — 2012. — Vol. 3, № 4. — P. 463—477. — doi:10.4155/bfs.12.41.
- ↑ Patil N. S., Jadhav J. P. Penicillium ochrochloron MTCC 517 chitinase: An effective tool in commercial enzyme cocktail for production and regeneration of protoplasts from various fungi // Saudi Journal of Biological Sciences. — 2015. — Vol. 22. — P. 232—236. — doi:10.1016/j.sjbs.2014.09.022.
- ↑ Nath R. L. A Textbook of Medicinal Biochemistry. — 1996. — P. 508.
- ↑ Houbraken J., Frisvad J. C., Samson R. A. Fleming’s penicillin producing strain is not Penicillium chrysogenum but P. rubens // IMA Fungus. — 2011. — Vol. 2(1). — P. 87—95. — doi:10.5598/imafungus.2011.02.01.12.
- ↑ Huber F. M. Griseofulvin // Antibiotics / D. Gottlieb, P. D. Shaw (eds.). — Springer-Verlag Berlin Heidelberg, 1967. — Vol. I. Mechanism of Action. — P. 181—189. — doi:10.1007/978-3-662-38439-8.
- ↑ Immunosuppressant Drugs // Food Bioactives / M. Puri (ed.). — Springer, 2017. — P. 67. — ISBN 978-3-319-51637-0. — doi:10.1007/978-3-319-51639-4.
- ↑ Endo, Mevastatin, and Pravachol // Drug Discovery: Practices, Processes, and Perspectives / J. J. Li, E. J. Corey (eds.). — John Wiley & Sons, 2013. — P. 18—19. — ISBN 978-0-470-94235-2.
- ↑ Ботанический атлас / под общ. ред. Б. К. Шишкина. — М.—Л.: Сельхозиздат, 1963. — С. 30.
- ↑ Link H. F. Observationes in Ordines plantarum naturales (лат.) // Magazin der Gesellschaft Naturforschender Freunde. — Berlin, 1816. — Vol. 3. — P. 37.
- ↑ Link H. F. Caroli a Linné Species plantarum exhibentes plantas rite cognitas, ad genera relatas (лат.). — Berolini, 1824. — Vol. 6 (1). — P. 69—71.
- ↑ 1 2 3 4 5 6 7 Raper & Thom, 1949, p. 3—13.
- ↑ Hawksworth D. L., Pitt J. I., Sutton B. C. Typification of the Genus Penicillium (англ.) // Taxon. — 1976. — Vol. 25 (5/6). — P. 665—670.
- ↑ Jørgensen P. M., Gunnerbeck E. The Nomenclature of Penicillium (англ.) // Taxon. — 1977. — Vol. 26 (5/6). — P. 581—582.
- ↑ Hawksworth D. L. The typification and citation of the generic name Penicillium (англ.) // Advances in Penicillium and Aspergillus Systematics / R. A. Samson, J. I. Pitt (eds.). — Boston, MA: Springer, 1986. — P. 3—7. — ISBN 1-4419-3204-6. — doi:10.1007/978-1-4757-1856-0_1.
- ↑ 1 2 Stolk A. C., Scott D. B. Studies on the genus Eupenicillium Ludwig: I. Taxonomy and nomenclature of Penicillia in relation to their sclerotioid ascocarpic states // Persoonia. — 1967. — Vol. 4. — P. 391—405.
- ↑ Hennebert G. L. Dierckx' Contribution to the Genus Penicillium // Advances in Penicillium and Aspergillus Systematics / R. A. Samson, J. I. Pitt (eds.). — Boston, MA: Springer, 1986. — P. 9—20. — ISBN 1-4419-3204-6. — doi:10.1007/978-1-4757-1856-0_2.
- ↑ Thom C. Fungi in Cheese Ripening: Camembert and Roquefort. — Washington, 1906. — 39 p.
- ↑ Thom, 1910, p. 25—27.
- ↑ Raper & Thom, 1949.
- ↑ Багдади В. Х. Новые виды грибов родов Penicillium Fr. и Aspergillus Fr., выделенные из почв Сирии // Новости систематики низших растений. — 1968. — С. 96—114.
- ↑ Benjamin C. R. Ascocarps of Aspergillus and Penicillium // Mycologia. — Vol. 47. — P. 669—687.
- ↑ Ramírez, 1982, p. 6.
- ↑ Stolk A. C., Samson R. A. Studies on Talaromyces and related genera I. Hamigera gen. nov. and Byssochlamys // Persoonia. — 1971. — Vol. 6. — P. 341—357.
- ↑ Pitt J. I., Hocking A. D. Merimbla gen. nov. for the anamorphic state of Talaromyces avellaneus // Canadian Journal of Botany. — 1979. — Vol. 57. — P. 2394—2398. — doi:10.1139/b79-282.
- ↑ Igarashi Y., Hanafusa T., Gohda F. et al. Species-level assessment of secondary metabolite diversity among Hamigera species and a taxonomic note on the genus // Mycology. — 2014. — Vol. 5 (3). — P. 102—109. — doi:10.1080/21501203.2014.917736.
- ↑ 1 2 Moss M. O. A Laboratory Guide to Common Penicillium Species. By John I. Pitt // Transactions of the British Mycological Society. — 1987. — Vol. 89(2). — P. 282. — doi:10.1016/S0007-1536(87)80174-2.
- ↑ Hübsch P. J. I. Pitt. The Genus Penicillium and its Teleomorphic States Eupenicillium and Talaromyces // Zeitschrift für allgemeine Mikrobiologie. — 1981. — Vol. 21(8). — P. 629. — doi:10.1002/jobm.19810210822.
- ↑ Koch H. A. C. Ramirez and A. T. Martinez. Manual and Atlas of the Penicillia // Zeitschrift für allgemeine Mikrobiologie. — 1984. — Vol. 24. — P. 663—664.
- ↑ Stolk A. C., Samson R. A. A new taxonomic scheme for Penicillium anamorphs // Advances in Penicillium and Aspergillus Systematics / R. A. Samson, J. I. Pitt (eds.). — Boston, MA: Springer, 1986. — P. 163—190. — ISBN 1-4419-3204-6. — doi:10.1007/978-1-4757-1856-0_17.
- ↑ Samson et al., 2011.
- ↑ Talaromycosis (formerly Penicilliosis) (англ.). Fungal Diseases. Centers for Disease Control and Prevention. U.S. Department of Health & Human Services (26 сентября 2017). Дата обращения: 4 ноября 2018. Архивировано 12 июля 2021 года.
- ↑ 1 2 Houbraken J., Samson R. A., Yilmaz N. Taxonomy of Aspergillus, Penicillium and Talaromyces and its Significance for Biotechnology // Aspergillus and Penicillium in the Post-genomic Era / R. P. de Vries, I. B. Gebler, M. R. Andersen (eds.). — 2016. — P. 1—15. — ISBN 1-910190-39-X.
- ↑ Tsang et al., 2018.
- ↑ 1 2 Houbraken et al., 2016.
- ↑ Samson R. A., Visagie C. M., Houbraken J. et al. Phylogeny, identification and nomenclature of the genus Aspergillus // Studies in Mycology. — 2014. — Vol. 78. — P. 141—173. — doi:10.1016/j.simyco.2014.07.004.
- ↑ Aspergillus, Penicillium & Talaromyces: Home (англ.). International Commission of Penicillium and Aspergillus. Дата обращения: 5 ноября 2018. Архивировано 28 августа 2018 года.
- ↑ Houbraken J., Frisvad J. C., Samson R. A. Taxonomy of Penicillium citrinum and related species // Fungal Diversity. — 2010. — Vol. 44 (1). — P. 117—133. — doi:10.1007/s13225-010-0047-z.
- ↑ Houbraken J., Frisvad J. C., Samson R. A. Taxonomy of Penicillium section Citrina // Studies in Mycology. — 2011. — Vol. 70. — P. 53—138. — doi:10.3114/sim.2011.70.02.
- ↑ Houbraken J., Frisvad J. C., Seifert K. A. et al. New penicillin-producing Penicillium species and an overview of section Chrysogena // Persoonia. — 2012. — Vol. 29. — P. 78—100. — doi:10.3767/003158512X660571.
- ↑ Houbraken J., Visagie C. M., Meijer M. et al. A taxonomic and phylogenetic revision of Penicillium section Aspergilloides // Studies in Mycology. — 2014. — Vol. 78. — P. 373—451. — doi:10.1016/j.simyco.2014.09.002.
- ↑ Peterson S. W., Jurjević Ž., Frisvad J. C. Expanding the Species and Chemical Diversity of Penicillium Section Cinnamopurpurea // PLoS ONE. — 2015. — Vol. 10 (4). — Art. e0121987. — doi:10.1371/journal.pone.0121987.
- ↑ Visagie C. M., Houbraken J., Seifert K. A. et al. Four new Penicillium species isolated from the fynbos biome in South Africa, including a multigene phylogeny of section Lanata-Divaricata // Mycological Progress. — 2015. — Vol. 14 (10). — Art. 96. — P. 1—23. — doi:10.1007/s11557-015-1118-z.
- ↑ Visagie C. M., Seifert K. A., Houbraken J. et al. A phylogenetic revision of Penicillium sect. Exilicaulis, including nine new species from fynbos in South Africa // IMA Fungus. — 2016. — Vol. 7 (1). — P. 75—117. — doi:10.5598/imafungus.2016.07.01.06.
- ↑ Rivera K. G., Seifert K. A. A taxonomic and phylogenetic revision of the Penicillium sclerotiorum complex // Studies in Mycology. — 2011. — Vol. 70. — P. 139—158. — doi:10.3114/sim.2011.70.03.
- ↑ Visagie C. M., Houbraken J., Rodriques C. et al. Five new Penicillium species in section Sclerotiora: a tribute to the Dutch Royal family // Persoonia. — 2013. — Vol. 31. — P. 42—62. — doi:10.3767/003158513X667410.
- ↑ Wang X.-C., Chen K., Zeng Z.-Q., Zhuang W.-Y. Phylogeny and morphological analyses of Penicillium section Sclerotiora (Fungi) lead to the discovery of five new species // Scientific Reportsvolume. — Vol. 7. — Art. 8233. — doi:10.1038/s41598-017-08697-1.
Литература
[править | править код]- Пидопличко Н. М. Пенициллии. — Киев: Наукова думка, 1972. — 150 с.
- Houbraken J., Samson R. A. Phylogeny of Penicillium and the segregation of Trichocomaceae into three families // Studies in Mycology. — 2011. — Vol. 70 (1). — P. 1—51. — doi:10.3114/sim.2011.70.01.
- Houbraken J., Wang L., Lee H. B., Frisvad J. C. New sections in Penicillium containing novel species producing patulin, pyripyropens or other bioactive compounds // Persoonia. — 2016. — Vol. 36 (1). — P. 299—314. — doi:10.3767/003158516X692040.
- Pitt J. I. Penicillium and related genera // Food Spoilage Microorganisms / C. de W. Blackburn (ed.). — Cambridge, 2006. — P. 437—450. — ISBN 978-1-85573-966-6. — doi:10.1533/9781845691417.4.437.
- Pitt J. I. Toxigenic Penicillium species // Food Microbiology: Fundamentals and Frontiers / M. P. Doyle, L. R. Beuchat (eds.). — Third edition. — Washington, 2007. — P. 551—562. — ISBN 978-1-55581-407-6. — doi:10.1128/9781555815912.ch25.
- Pitt J. I., Hocking A. D. Penicillium and related genera // Fungi and Food Spoilage. — Third edition. — Springer, 2009. — P. 169—273. — ISBN 978-0-387-92206-5. — doi:10.1007/978-0-387-92207-2_7.
- Ramírez C. Manual and Atlas of the Penicillia. — Amsterdam, 1982. — 874 p. — ISBN 0-444-80369-6.
- Raper K. B., Thom C. A Manual of the Penicillia. — Baltimore, 1949. — 875 p.
- Samson R. A., Yilmaz N., Houbraken J. et al. Phylogeny and nomenclature of the genus Talaromyces and taxa accommodated in Penicillium subgenus Biverticillium // Studies in Mycology. — 2011. — Vol. 70 (1). — P. 159—183. — doi:10.3114/sim.2011.70.04.
- Thom C. Cultural Studies of Species of Penicillium. — Washington, 1910. — 107 p.
- Tsang C.-C., Tang J. Y. M., Lau S. K. P., Woo P. C. Y. Taxonomy and evolution of Aspergillus, Penicillium and Talaromyces in the omics era – Past, present and future // Computational and Structural Biotechnology Journal. — 2018. — Vol. 16. — P. 197—210. — doi:10.1016/j.csbj.2018.05.003.
- Visagie C. M., Houbraken J., Frisvad J. C. et al. Identification and nomenclature of the genus Penicillium // Studies in Mycology. — 2014. — Vol. 78. — P. 343—371. — doi:10.1016/j.simyco.2014.09.001.
- Yadav A. N., Verma P., Kumar V. et al. Biodiversity of the Genus Penicillium in Different Habitats // New and Future Developments in Microbial Biotechnology and Bioengineering: Penicillium System Properties and Applications / V. K. Gupta, S. Rodriguez-Couto (eds.). — 2018. — P. 1—18. — ISBN 978-0-444-63501-3.
Ссылки
[править | править код]- Aspergillus, Penicillium & Talaromyces: Taxonomy (англ.). International Commission of Penicillium and Aspergillus. Дата обращения: 5 ноября 2018. Архивировано 23 января 2019 года.