نتروبنزين

| نتروبنزين Nitrobenzene | |
|---|---|
 |  |
| أسماء أخرى | |
Nitrobenzol | |
| المعرفات | |
| رقم CAS | 98-95-3 |
| بوب كيم (PubChem) | 7416 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C6H5NO2 |
| الكتلة المولية | 123.06 غ/مول |
| المظهر | سائل زيتي أصفر اللون |
| الكثافة | 1.2 غ/سم3 |
| نقطة الانصهار | 5.7 °س |
| نقطة الغليان | 211 °س |
| الذوبانية في الماء | 0.19 غ/100 مل ماء |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| نقطة الوميض | 88 °س |
| درجة حرارة الاشتعال الذاتي | 480 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
نتروبنزين هو مركب عضوي له الصيغة C6H5NO2، وهو أبسط مركبات النترو العضوية. يكون نتروبنزين على شكل سائل زيتي سام لونه أصفر، وله رائحة اللوز، ويستعمل مذيبًا، ولعمل الصابون والعطور وإنتاج الأنيلين،[3] وضروب الطلاء.
التسمية
[عدل]يسمّى المركب باسم نتروبنزين[4] كما يسمى حسب بعض المراجع العربية باسم نترات البنزين[5][6][7] يعتبر مركب النترو حسب تعريف الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) هو المركب الذي يحوي على مجموعة نترو (NO2-)، والتي يمكن أن تكون متصلة بذرة كربون (كما هو الحال في نتروبنزين)، أو بذرة نتروجين (كما هو الحال في مركبات نترامين، أو بذرة أكسجين (كما هو الحال في مركبات النترات العضوية).[8] بالتالي فإن مركبات النترات العضوية هي التي لها الصيغة RONO2،[9][10][11] والتي تعد إسترات عضوية لحمض النتريك، وهي غير متحققة في هذه الحالة.
التحضير
[عدل]حضّر مركب نتروبنزين لأول مرة سنة 1834 من الكيميائي أيلهارد ميتشرليخ Eilhard Mitscherlich.
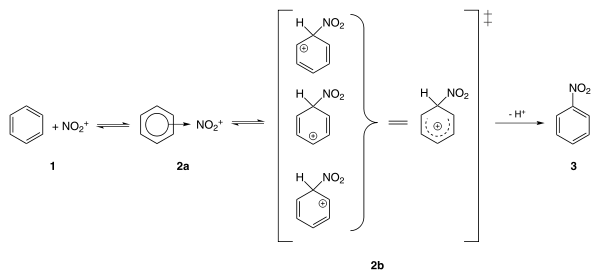
يحضّر نتروبنزين من إجراء عملية نترتة لمركّب البنزين باستخدام مزيج مركّز من حمض الكبريتيك وحمض النتريك، واللذان يتفاعلا ليشكّلا أيون النترونيوم +NO2 (أو أيون النتريل):
يتفاعل أيون النترونيوم النشيط كيميائياً مع البنزين وفق آلية استبدال عطري شغوف بالإلكترونات ليشكل نتروبنزين:
يعد تفاعل تحضير نتروبنزين أحد أخطر تفاعلات التحضير في الصناعات الكيميائية، إذ أن التفاعل ناشر للحرارة بشكل كبير (ΔH = −117 كيلوجول/مول).[12]
بلغ الإنتاج العالمي من نتروبنزين سنة 1985 حوالي 1.7 مليون طن.[12]
الخصائص
[عدل]- يكون نتروبنزين في الشروط العادية على شكل سائل زيتي أصفر اللون، له رائحة تشبه رائحة زيت اللوز المر. وهو مركب سام وقابل للاشتعال.
- ينحل نتروبنزين بصعوبة في الماء، لكنه بالمقابل ينحل بسهولة في الكحولات وغيرها من المذيبات العضوية.
- عند درجات حرارة مرتفعة يتفاعل نتروبنزين مع الماء بوجود آثار من النيكل إلى الأنيلين.
الاستخدامات
[عدل]يستخدم نتروبنزين بشكل أساسي (حوالي 95%) كمركب طليعي من أجل تحضير الأنيلين،[12] والذي يستخدم بدوره في العديد من الصناعات الكيميائية المهمة مثل صناعة المطاط والأصبغة والمبيدات الحشرية، بالإضافة إلى تحضير المستحضرات الصيدلانية مثل باراسيتامول.[13]
المراجع
[عدل]- ^ ا ب ج NITROBENZENE (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ دكتور حسين سعيد، الموسوعة الثقافية، مؤسسة فراكلين للطباعة و النشر، القاهرة- نيويورك، 1972م ص 984.
- ^ المعجم الطبي الموحد.
- ^ قاموس المورد، البعلبكي، بيروت، لبنان،
- ^ موسوعة شبكة المعرفة الريفية
- ^ قاموس المعاني نسخة محفوظة 14 مارس 2020 على موقع واي باك مشين.
- ^ الكتاب الذهبي IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook. نسخة محفوظة 11 فبراير 2017 على موقع واي باك مشين.
- ^ موسوعة الأرض نسخة محفوظة 03 مارس 2016 على موقع واي باك مشين.
- ^ Koppmann، Ralf (2008)، Volatile Organic Compounds in the Atmosphere، John Wiley & Sons، ص. 269، ISBN:0470994150، مؤرشف من الأصل في 2020-01-27
- ^ L. Lee, P. J. Wooldridge, J. B. Gilman, C. Warneke, J. de Gouw R. C. Cohen (2014). "Low temperatures enhance organic nitrate formation: evidence from observations in the 2012 Uintah Basin Winter Ozone Study". Atmospheric Chemistry and Physics. ج. 14: 12441–12454. DOI:10.5194/acp-14-12441-2014.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب ج Gerald Booth (2007). "Nitro Compounds, Aromatic". In: Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons: New York. دُوِي:10.1002/14356007.a17_411
- ^ Bhattacharya A.; Purohit V. C.; Suarez, V.; Tichkule, R; Parmer, G.; Rinaldi, F. (2006). "One-step reductive amidation of nitro arenes: application in the synthesis of Acetaminophen". Tetrahedron Letters. ج. 47 ع. 11: 1861–1864. DOI:10.1016/j.tetlet.2005.09.196. مؤرشف من الأصل في 18 مارس 2020. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)
روابط خارجية
[عدل]- International Chemical Safety Card 0065
- NIOSH Pocket Guide to Chemical Hazards
- IARC Monograph: "Nitrobenzene"
- US EPA factsheet