Dimethylammoniumchlorid
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
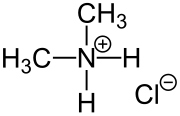 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethylammoniumchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H8ClN | ||||||||||||||||||
| Kurzbeschreibung | geruchloser kristalliner weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 81,55 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 0,5 g·cm−3 (Schüttdichte)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | 3000 g/l, sehr leicht löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Dimethylammoniumchlorid ist eine chemische Verbindung, die – systematisch gesehen – zwei Stoffgruppen angehört. Als Ammoniumverbindung gehört es zur Stoffgruppe der zweifach alkylierten Ammoniumverbindungen. Als Chlorid ist es ein Salz der Untergruppe Hydrochloride, das Hydrochlorid von Dimethylamin.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Dimethylammoniumchlorid kann durch Reaktion von Dimethylamin mit Chlorwasserstoff gewonnen werden.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Dimethylammoniumchlorid ist ein brennbarer und schwer entzündlicher sowie geruchloser kristalliner weißer Feststoff, der sehr leicht löslich in Wasser ist.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Dimethylammoniumchlorid wird zur Herstellung von Dimethylamin im Labormaßstab verwendet. Dazu wird es mit einer starken Base wie Natriumhydroxid umgesetzt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Eintrag zu CAS-Nr. 506-59-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Dezember 2019. (JavaScript erforderlich)
- ↑ Datenblatt Dimethylammoniumchlorid bei Merck, abgerufen am 16. Dezember 2019.
- ↑ American Chemical Society: Journal of the American Chemical Society, Band 79, Seite 1091. 1957 (englisch).

