Butene
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
Butene (auch Butylene) sind eine Gruppe von vier isomeren Kohlenwasserstoffen mit der allgemeinen Summenformel C4H8, die über eine C=C-Doppelbindung verfügen. Sie zählen damit zu den Alkenen. Zwei der Isomere unterscheiden sich durch cis-trans-Isomerie.
Butene sind unter Standardbedingungen farblose, brennbare Gase mit einer größeren Dichte als Luft. Unter Druck lassen sich die Isomere verflüssigen. Sie wirken in höheren Konzentrationen narkotisierend und erstickend. Mit Luft bilden sie explosive Gemische.
Struktur und Eigenschaften
[Bearbeiten | Quelltext bearbeiten]| Eigenschaften der Butene | ||||||||||||
| Name | But-1-en | (Z)-But-2-en | (E)-But-2-en | 2-Methylprop-1-en | ||||||||
| Andere Namen | 1-Buten n-Buten 1-Butylen α-Butylen BUTENE (INCI)[1] | cis-2-Buten (Z)-2-Buten cis-But-2-en | trans-2-Buten (E)-2-Buten trans-But-2-en | 2-Methyl-1-propen Isobuten i-Butylen | ||||||||
| Struktur | 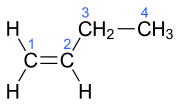 | 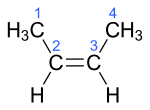 |  | 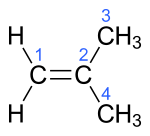 | ||||||||
| CAS-Nummer | 106-98-9 | 590-18-1 | 624-64-6 | 115-11-7 | ||||||||
| 107-01-7 (EZ)-2-Buten | ||||||||||||
| 25167-67-3 (Isomerengemisch) | ||||||||||||
| Summenformel | C4H8 | |||||||||||
| Molare Masse | 56,11 g·mol−1 | |||||||||||
| Kurzbeschreibung | farblose Gase[2] | |||||||||||
| Schmelzpunkt | −185,4 °C[3] | −138,9 °C[4] | −105,5 °C[5] | −140,4 °C[6] | ||||||||
| Siedepunkt | −6,2 °C[3] | 3,7 °C[4] | 0,9 °C[5] | −7,1 °C[6] | ||||||||
| molare Verdampfungsenthalpie am Siedepunkt | 22,07 kJ·mol−1[7] | 23,34 kJ·mol−1[7] | 22,72 kJ·mol−1[7] | 24,03 kJ·mol−1[8] | ||||||||
| Dampfdruck | 2,545 bar (20 °C) | 1,813 bar (20 °C) | 1,991 bar (20 °C) | 2,59 bar (20 °C) | ||||||||
| Untere Explosionsgrenze (20 °C / 1,013 bar)[9] | 1,2 Vol.‑% / 28 g·m3 | 1,6 Vol.‑% / 37 g·m3 | 1,6 Vol.‑% / 37 g·m3 | 1,6 Vol.‑% / 37 g·m3 | ||||||||
| Obere Explosionsgrenze (20 °C / 1,013 bar)[9] | 10,6 Vol.‑% / 252 g·m3 | 10,0 Vol.‑% / 235 g·m3 | 10,0 Vol.‑% / 235 g·m3 | 10,0 Vol.‑% / 235 g·m3 | ||||||||
| Zündtemperatur / Temperaturklasse[9] | 360 °C / T2 | 324 °C / T2 (E/Z-Isomerengemisch)[10] | 324 °C / T2 (E/Z-Isomerengemisch)[10] | 465 °C / T1 | ||||||||
| Löslichkeit | praktisch unlöslich in Wasser,[3][4][5][6] leichtlöslich in Ethanol und Ether | |||||||||||
| GHS- Kennzeichnung | aus Verordnung (EG) Nr. 1272/2008 (CLP),[11] ggf. erweitert
| aus Verordnung (EG) Nr. 1272/2008 (CLP),[12] ggf. erweitert
| aus Verordnung (EG) Nr. 1272/2008 (CLP),[13] ggf. erweitert
| aus Verordnung (EG) Nr. 1272/2008 (CLP),[14] ggf. erweitert
| ||||||||
| H-Sätze | 220‐280[3] | 220[4] | 220[5] | 220‐280[6] | ||||||||
| EUH-Sätze | keine EUH-Sätze | |||||||||||
| P-Sätze | 210‐377‐381‐403[3] | 210[4] | 210[5] | 210‐377‐381‐403[6] | ||||||||
Thermodynamische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Butene sind leicht zu verflüssigende Gase, deren Anwendung und Umsetzung oft unter erhöhtem Druck als Flüssigkeit oder im überkritischen Zustand erfolgt.
| Dampf-Flüssig-Gleichgewichte | ||||
|---|---|---|---|---|
| Name | But-1-en | (Z)-But-2-en | (E)-But-2-en | 2-Methylprop-1-en |
| Dampfdruckfunktion nach Antoine | Parameter nach log10(P) = A−(B/(T+C)) (P in bar, T in K) | |||
| A | 4,24696 | 3,98744 | 4,04360 | 3,64709 |
| B | 1099,207 | 957,060 | 982,166 | 799,055 |
| C | −8,265 | −36,504 | −30,775 | −46,615 |
| Temperaturbereich | 195,6 K – 269,4 K | 203,06 K – 295,91 K | 201,70 K – 274,13 K | 216,40 K – 273 K |
| Quelle | [15] | [16] | [17] | [18] |
| Kritische Größen[19] | ||||
|---|---|---|---|---|
| Name | But-1-en | (Z)-But-2-en | (E)-But-2-en | 2-Methylprop-1-en |
| Kritische Temperatur Tc | 146,35 °C / 419,5 K | 162,35 °C / 435,5 K | 155,45 °C / 428,6 K | 144,75 °C / 417,9 K |
| Kritischer Druck pc | 40,2 bar | 42,1 bar | 41,0 bar | 40,0 bar |
| Kritisches Molvolumen Vm,c | 0,2408 l·mol−1 | 0,2338 l·mol−1 | 0,2377 l·mol−1 | 0,2388 l·mol−1 |
| Kritische Dichte ρc | 4,15 mol·l−1 | 4,28 mol·l−1 | 4,21 mol·l−1 | 4,19 mol·l−1 |
Synthese
[Bearbeiten | Quelltext bearbeiten]Michael Faraday fand Butene 1825 als gasförmigen Bestandteil bei der Destillation von Erdöl (siehe auch: Flüssiggas). Butene können durch Cracken von Erdöl als Isomerengemisch gewonnen werden. Sie werden auch durch katalytische Dehydrierung von Butan bzw. Isobutan gewonnen. Die Trennung der Isomeren kann mit Hilfe von Zeolithen erfolgen.[10]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Durch die C–C-Doppelbindung sind sie interessante und wichtige Ausgangsstoffe für chemische Synthesen. Sie werden zur Herstellung von Verbindungen wie 2-Butanol, 2-Butanon (Ethylmethylketon) und 1,3-Butadien verwendet und sind Ausgangsstoff zur Herstellung von Kunststoffen (z. B. Butylkautschuk und Polyisobuten).[10] Als Alkylierungsmittel dienen sie z. B. zur Synthese von Zusätzen für klopffeste Treibstoffe (2,2,4-Trimethylpentan (Isooctan)). Isobuten wird zur Synthese von Methyl-tert-butylether (MTBE) bzw. Ethyl-tert-butylether (ETBE) benötigt. Auch tert-Butylester lassen sich über die Reaktion von Isobuten und (Carbon)säuren herstellen. Diese Syntheseroute bietet sich speziell dann an, wenn bei der Veresterung mit tert-Butanol als Konkurrenzreaktion dessen Dehydratisierung dominiert.
Literatur
[Bearbeiten | Quelltext bearbeiten]- F.M.A. Geilen; G. Stochniol; S. Peitz; E. Schulte-Koerne: Butene, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; doi:10.1002/14356007.a04_483.pub3.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu BUTENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. März 2022.
- ↑ Eintrag zu Buten, Isomerengemisch in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Oktober 2013. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu 1-Buten in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. August 2016. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu cis-2-Buten in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. August 2016. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu trans-2-Buten in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. August 2016. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu 2-Methylpropen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. August 2016. (JavaScript erforderlich)
- ↑ a b c V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- ↑ R. C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. 66. Auflage. CRC Press, 1985, ISBN 0-8493-0466-0.
- ↑ a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ a b c d Eintrag zu Butene. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Juni 2019.
- ↑ Eintrag zu But-1-ene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu (Z)-but-2-ene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu (E)-but-2-ene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu 2-methylpropene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ C. C. Coffin, O. Maass: The Preparation and Physical Properties of «alpha», «beta»- and «gamma»-Butylene and Normal and Isobutane. In: J. Am. Chem. Soc. 50, 1928, S. 1427–1437.
- ↑ R. B. Scott, W. J. Ferguson, F. G. Brickwedde: Thermodynamic properties of cis-2-butene from 15° to 1,500 K. In: J. Res. NBS. 33, 1944, S. 1–20.
- ↑ L. Guttman, K. S. Pitzer: trans-2-Butene. The heat capacity, heats of fusion and vaporization, and vapor pressure. The entropy and barrier to internal rotation. In: J. Am. Chem. Soc. 67, 1945, S. 324–327.
- ↑ A. B. Lamb, E. W. Roper: The Vapor Pressures of Certain Unsaturated Hydrocarbons. In: J. Am. Chem. Soc. 62, 1940, S. 806–814.
- ↑ C. Tsonopoulos, D. Ambrose: Vapor-Liquid Critical Properties of Elements and Compounds. 6. Unsaturated Aliphatic Hydrocarbons. In: J. Chem. Eng. Data. 41, 1996, S. 645–656.

