Pyridiniumverbindungen
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie

verbindung (R = H, Organylgruppe)
Pyridiniumverbindungen sind eine Gruppe chemischer Verbindungen, bei denen das Stickstoffatom des Pyridin-Rings positiv geladen ist. Sie gehören damit zu den organischen Ammoniumverbindungen. Abhängig vom Rest (R), der sich am Stickstoffatom befindet, lassen sich die Pyridiniumverbindungen in verschiedene Kategorien einteilen. Des Weiteren können die Wasserstoffatome des Rings substituiert sein.[1] Wichtige Vertreter sind der Arzneistoff Cetylpyridiniumchlorid, das bekannte Pflanzenschutzmittel Paraquat und das Coenzym Nicotinamidadenindinukleotid.
Kategorien und Vertreter
[Bearbeiten | Quelltext bearbeiten]Pyridiniumverbindungen lassen sich zunächst durch den Rest, welcher an das Stickstoffatom des Ringes gebunden ist, in verschiedene Kategorien einteilen. Ihre Vertreter unterscheiden sich dann durch die Länge des Alkylrestes und die Substituenten am Ring.
Tertiäre Pyridiniumverbindungen
[Bearbeiten | Quelltext bearbeiten]| Tertiäre Pyridiniumverbindung |
|---|
 |
Tertiäre Pyridiniumverbindungen besitzen ein H am Ringstickstoffatom. Als Beispiel ist der einfachste Vertreter – das Pyridiniumchlorid – aufgeführt.
Alkylpyridiniumverbindungen
[Bearbeiten | Quelltext bearbeiten]| Alkylpyridiniumverbindung |
|---|
 |
Alkylpyridiniumverbindungen zeichnen sich durch den Alkylrest am Ringstickstoffatom aus. Weiterhin können die Wasserstoffatome des Ringes substituiert sein. Als Beispiel ist der einfachste Vertreter – das Methylpyridiniumchlorid – gegeben.[1]
N-Ylide
[Bearbeiten | Quelltext bearbeiten]| N-Ylid |
|---|
 |
Durch Deprotonierung der Alkylpyridiniumverbindungen werden die N-Ylide gewonnen. Diese sind wichtige Zwischenstufen in organischen Synthesen.[1]
N-Cyanopyridiniumsalze
[Bearbeiten | Quelltext bearbeiten]| N-Cyanopyridiniumsalz |
|---|
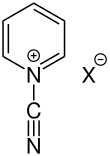 |
N-Cyanopyridiniumverbindungen zeichnen sich durch den elektronenziehenden Rest aus. Dieser bewirkt, dass Nucleophile leicht angreifen können, wodurch Ringöffnung eintritt. Die so entstehenden offenkettigen Aldehyde treten in Zusammenhang mit der Zincke-Reaktion auf und werden als Zincke-Aldehyde bezeichnet.[1] Die Kohlenstoffatome des Ringes können substituiert sein und als Anionen (X–) liegen Halogenidionen vor.
Pyridinium-N-oxide
[Bearbeiten | Quelltext bearbeiten]| Pyridinium-N-oxid |
|---|
 |
Pyridinium-N-oxide zeichnen sich dadurch aus, dass sie sowohl elektrophile als auch nucleophile Substitutionen in ortho- und para-Stellung eingehen. So eignen sie sich besonders gut als Zwischenprodukte für Zweitsubstitutionen von Pyridin–Derivaten. Das Sauerstoffatom kann dann beispielsweise mit Phosphortrichlorid abgespalten werden.[2]
Synthese
[Bearbeiten | Quelltext bearbeiten]Pyridiniumverbindungen lassen sich zum Beispiel durch die Zincke-Reaktion aus Pyridin synthetisieren:[3]

Anwendungen
[Bearbeiten | Quelltext bearbeiten]Arzneistoffe
[Bearbeiten | Quelltext bearbeiten]| Strukturformel der Pyridiniumverbindung | Anwendungsbeispiel |
|---|---|
 |  |
Die wohl bekannteste Pyridiniumverbindung ist das Cetylpyridiniumchlorid, welches als Monopräparat Dobendan oder Kombinationspräparat Dobendan Strepsils Dolo gegen Infektionen und Entzündungen des Rachenraumes eingesetzt wird.[1][4]
| Strukturformel der Pyridiniumverbindung | Anwendungsbeispiel |
|---|---|
 |  |
Auch das Pyridostigminbromid wirkt als Arzneistoff gegen die Autoimmunkrankheit Myasthenia gravis, die sich zum Beispiel durch den sogenannten „Schlafzimmerblick“ äußert.[1]
Pflanzenschutzmittel – Herbizid
[Bearbeiten | Quelltext bearbeiten]| Strukturformel der Pyridiniumverbindung | Anwendungsbeispiel |
|---|---|
 |  |
Das stark toxische Paraquatdichlorid findet Anwendung als wirksames Herbizid.[1]
Bromierungsmittel
[Bearbeiten | Quelltext bearbeiten]
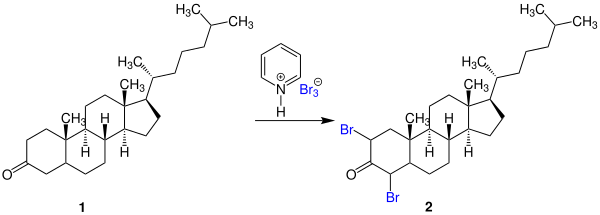
Pyridiniumperbromid eignet sich ausgezeichnet als Bromierungsmittel und hat mehrere Vorteile gegenüber elementarem Brom, wie etwa das sehr präzise Abwiegen bei Reaktionen im kleinen Maßstab. Ein Beispiel für die Anwendung ist die Bromierung des 3-Ketosteroids 1 zum 2,4-Dibromcholestanon (2):[1][5][2]
Oxidationsmittel
[Bearbeiten | Quelltext bearbeiten]
chlorochromat
Pyridiniumchlorochromat (PCC) kann als starkes Oxidationsmittel in der organischen Chemie eingesetzt werden, zum Beispiel für die Oxidation eines primären Alkohols zum Aldehyd oder analog für die Oxidation eines sekundären Alkohols zum Keton. Dabei ist zu beachten, dass PCC aufgrund der schlechten Atomökonomie und der schädlichen Wirkung von Chromverbindungen nur im Labor verwendet wird. Die Abbildung zeigt das Beispiel der Oxidation des Naturstoffes Citronellol (1) zum ebenfalls in der Natur vorkommenden Citronellal (2):[6][2]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Jürgen Falbe, Manfred Regitz: Römpp-Chemie-Lexikon. Thieme, Stuttgart 1992, ISBN 3-13-735009-3, S. 3696–3697.
- ↑ a b c Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, Berlin Heidelberg 2013, ISBN 978-3-642-34715-3, S. 802–804.
- ↑ Jie Jack Lie: Name reactions: a collection of detailed reaction mechanisms. Springer-Verlag Berlin Heidelberg, Berlin, Heidelberg 2006, ISBN 978-3-540-30031-1, S. 637–639, doi:10.1007/3-540-30031-7_288.
- ↑ Rote Liste, Stand 2013.
- ↑ Carl Djerassi, Caesar R. Scholz: Brominations with Pyridine Hydrobromide Perbromide. In: Journal of the American Chemical Society. Band 70, Nr. 1, Januar 1948, S. 417–418, doi:10.1021/ja01181a508.
- ↑ E. J. Corey, J. William Suggs: Pyridinium Chlorochromate. An Efficient Reagent for Oxidation of Primary and Secondary Alcohols to Carbonyl Compounds. In: Tetrahedron Letters. Band 16, Nr. 31, Juni 1975, S. 2647–2650, doi:10.1016/S0040-4039(00)75204-X.