Tantal(IV)-sulfid
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Ta _ S | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tantal(IV)-sulfid | |||||||||||||||
| Andere Namen | Tantaldisulfid | |||||||||||||||
| Verhältnisformel | TaS2 | |||||||||||||||
| Kurzbeschreibung | grauer Feststoff oder schwarzes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 245,08 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | 6,86 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | nahezu unlöslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Tantal(IV)-sulfid ist eine anorganische chemische Verbindung des Tantals aus der Gruppe der Sulfide, also der Übergangsmetalldichalkogenide. Neben diesem sind noch mindestens vier weitere Tantalsulfide (Ta6S, Ta2S, Ta1+xS2 und TaS3) bekannt. Viele davon haben Homogenitätsgebiete oder unterscheiden sich voneinander als Stapelvarianten eines Grundgittertyps.[4]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Tantal(IV)-sulfid kann durch Reaktion von Tantal mit Schwefel bei 900 °C gewonnen werden.[5]
Es kann auch durch Reaktion von Tantal(V)-oxid mit Schwefelwasserstoff oder Kohlenstoffdisulfid gewonnen werden.[6]
Eigenschaften
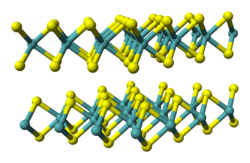
[Bearbeiten | Quelltext bearbeiten]Tantal(IV)-sulfid ist ein bei Raumtemperatur als grauer metallischer oder schwarzes Pulver vorliegender Feststoff, der in mehreren Modifikationen vorkommt. Die bei Raumtemperatur stabile Form wird als 2H-TaS2 bezeichnet. Sie besitzt metallische Eigenschaften (spezifischer Widerstand 120 µΩ·cm)[7], hat eine Schichtstruktur und ist Supraleitend bei 0,75 K. Sie besitzt eine trigonale Kristallstruktur mit der Raumgruppe P63/mmc (Nr. 194) isotyp zu der von Niob(IV)-sulfid.[8] Die gelb aussehenden Hochtemperaturmodifikation 1T-TaS2 liegt ab Temperaturen von 780 °C vor. Diese Modifikation ist ein Halbleiter und kann durch abschrecken auch bei Raumtemperatur metastabil erhalten werden. Sie besitzt eine octahedrale Kristallstruktur mit der Raumgruppe P3m1 (Nr. 164). Daneben existieren auch noch mindestens eine 3R-TaS2, 4H-TaS2 und eine 6R-TaS2 Form.[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Tantal(IV)-sulfid wird als Schmierstoff verwendet.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 410 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer-Verlag, 1998, ISBN 978-3-642-58842-6, S. 754 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1470.
- ↑ a b R.M.A. Lieth: Preparation and Crystal Growth of Materials with Layered Structures. Springer Science & Business Media, 1977, ISBN 978-90-277-0638-6, S. 188 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ NPCS Board of Consultants & Engineers: Handbook on Rare Earth Metals and Alloys (Properties, Extraction, Preparation and Applications). ASIA PACIFIC BUSINESS PRESS Inc., 2009, ISBN 81-7833-120-9, S. 416 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Anja Schlicht: Normalleitende und supraleitende Eigenschaften von Farbstoff-Einlagerungsverbindungen des Wirtsgitters 2H-TaS2. Herbert Utz Verlag, 1999, ISBN 978-3-89675-473-8, S. 11 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Erwin Riedel: Moderne anorganische Chemie. Walter de Gruyter, 2003, ISBN 978-3-11-017838-8, S. 498 (eingeschränkte Vorschau in der Google-Buchsuche).
