Uterusmyom
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Klassifikation nach ICD-10 | |
|---|---|
| D25.- | Leiomyom des Uterus inkl.: Fibromyom des Uterus |
| D25.0 | Submuköses Leiomyom des Uterus |
| D25.1 | Intramurales Leiomyom des Uterus |
| D25.2 | Subseröses Leiomyom des Uterus |
| D25.9 | Leiomyom des Uterus, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Das Uterusmyom (Myom der Gebärmutter; auch Fibroid) ist der häufigste gutartige Tumor bei Frauen. So weisen ca. 25 Prozent der Frauen nach dem 30. Lebensjahr Uterusmyome (englisch Fibroids) auf, etwa 25 Prozent von ihnen haben Beschwerden. Myome können einzeln vorkommen (solitäre Myome), oft aber sind sie in größerer Zahl in der Gebärmutter verteilt. Eine durch Myome vergrößerte Gebärmutter wird als Uterus myomatosus bezeichnet. Von ihrer Form her sind Myome meist rund, histologisch meist Leiomyome (Tumoren der glatten Muskulatur).
Entstehung
[Bearbeiten | Quelltext bearbeiten]Myome entstehen und wachsen unter dem Einfluss von Östrogenen, Progesteron und Wachstumsfaktoren,[1] daher nur im gebärfähigen Alter (in der Zeit zwischen erster und letzter Menstruation der Frau): Junge Mädchen können keine Myome haben, nach der Menopause entstehen keine neuen Myome mehr und bereits bestehende Myome können dann schrumpfen und eventuell verkalken. Myome verschwinden in den Wechseljahren nicht, sind dann aber durch die fehlende Blutungssymptomatik (Ausnahme Patientinnen mit Hormonersatz-Therapie) selten therapiebedürftig. Das Auftreten von Myomen kann erblich bedingt sein (familiäre Risikogruppen), häufig finden sich Chromosomenaberrationen. Das für die Fumarase codierende FH-Gen kann betroffen sein. Bei afrikanischen[2] und afroamerikanischen[3] Frauen treten Myome mehrfach häufiger auf als bei kaukasischen.
Einteilung
[Bearbeiten | Quelltext bearbeiten]
Man unterscheidet nach der Lage des Myoms bezogen auf die unterschiedlichen Schichten des Uterus mehrere unterschiedliche Typen:
- submuköse Myome: direkt unter der Gebärmutterschleimhaut, bzw. im Myometrium mit Kontakt zur Gebärmutterschleimhaut; submuköse Myome verursachen oftmals verstärkte Regelblutungen; eine Sonderform stellt das Myoma in statu nascendi dar; es bezeichnet ein submuköses, gestieltes Myom, welches in den Gebärmutterhalskanal eintritt und „geboren“ wird.
- intramurale Myome: in der Muskelschicht (Myometrium) der Gebärmutter gelegen; oftmals größer als submuköse Myome komprimieren sie die Blase und führen neben Beschwerden beim Wasserlassen (Dysurie) oft auch zu schmerzhaften Regelblutungen.
- subseröse Myome: dem Uterus außen (unter dem Bauchfell der Gebärmutter) aufliegend, entweder breitbasig oder gestielt; subseröse Myome werden dort oftmals sehr groß und können lange beschwerdefrei bleiben. Aufgrund ihrer Größe und des daraus resultierenden Druckes auf Blase und Darm kann es zu häufigem Harndrang oder Druckschmerzen im Bereich des Unterbauches kommen.
- intraligamentär wachsende Myome: seltenere Myome, in den bds. seitlich der Gebärmutter gelegenen Bindegewebsschichten (meist den breiten Gebärmutterbändern) lokalisiert; dort können sie die Harnleiter komprimieren und dann ggf. durch den resultierenden Harnaufstau zu einer Nierenerkrankung führen.
- Zervixmyome: kommen in etwa 8 Prozent der Fälle vor, wachsen innerhalb der Muskulatur des Zervixbereiches und können sowohl den Zervikalkanal komprimieren, als auch Druck auf naheliegende Strukturen (Blase, Mastdarm etc.) ausüben.[4]

Symptome
[Bearbeiten | Quelltext bearbeiten]Abhängig von der Größe und Lage der Myome im Uterus sind zwar die meisten Frauen mit einem Myom beschwerdefrei, es kann aber auch zu massiv verstärkten, verlängerten Regelblutungen (bei intramuralen Myomen wegen Kontraktionsschwäche des Uterus bzw. bei submukösen Myomen wegen gestörter Schleimhautregeneration) und/oder Zwischenblutungen kommen, möglicherweise bis hin zum Auftreten einer sekundären Anämie.

Weitere mögliche Beschwerden sind:
- Schmerzen, Druckgefühl, Fremdkörpergefühl im Unterleib vor allem bei großen Tumoren bzw. subserösen Myomen
- Obstipation (durch Druck auf den Darm)
- Beschwerden beim Wasserlassen (durch Druck auf die Blase; mögliche Folgen: Dysurie, Pollakisurie, Inkontinenz)
- Beschwerden beim Geschlechtsverkehr (Dyspareunie)
- Auch Kreuzschmerzen und (Nerven-)Schmerzen in den Beinen (durch den Druck des Tumors auf die präsakral austretenden Nerven) sind möglich.
- Akutes Abdomen: durch Stieldrehung eines gestielten subserösen Myoms mit Nekrose und reaktiver Peritonitis
Myome und Schwangerschaft
[Bearbeiten | Quelltext bearbeiten]In der Schwangerschaft, meist zwischen drittem und sechstem Monat, können in seltenen Fällen isoliert starke Schmerzen im Bereich des Myoms auftreten, bedingt durch eine Beeinträchtigung der Blutzufuhr, die zur Infarzierung und Nekrose des Myoms führt (auch als rote Degeneration bezeichnet). Sehr selten kann ein großes Myom bei entsprechender Lage ein Geburtshindernis darstellen, sodass ein Kaiserschnitt (Sectio caesarea) durchgeführt werden muss. Das Risiko einer Fehlgeburt und Frühgeburt kann bei Frauen mit großen intrauterinen (sich in der Gebärmutter befindenden) Myomen etwas erhöht sein. Blutungen in der Schwangerschaft sowie (selten) eine vorzeitige Plazentalösung können als Konsequenz einer subplazentaren Lage eines Myoms auftreten.[5] Myome können manchmal eine Ursache für Sterilität (Unfruchtbarkeit) darstellen. Sie werden aber nur in 3 % der Fälle als Hauptursache für die Unfruchtbarkeit angesehen.
Sekundäre Veränderungen
[Bearbeiten | Quelltext bearbeiten]Abgesehen von der Größenveränderung können sich Myome auch strukturell verändern, meist aufgrund gestörter Durchblutung:
- Die häufigste Veränderung betrifft eine Erweichung, welche mehrere Formen einnehmen kann. Die bei Weitem häufigste Form ist die hyaline Degeneration (etwa 60 %), daneben können die zystische Degeneration mit zentraler Hohlraumbildung sowie die myxomatöse Degeneration erwähnt werden. Eine seltene Form stellt die fast ausschließlich in der Schwangerschaft auftretende, beschwerdereiche rote Degeneration dar.
- Eine Verhärtung erfolgt meist in Folge einer Verkalkung oder einer Fibrosierung (Fibroleiomyom).
- Nekrosen sind entweder hämorrhagisch oder ischämisch bedingt.
- Infektionen erfolgen durch aufsteigende Keime
- maligne Degeneration: Etwa 0,1 % der Myome erweisen sich als bösartig (Leiomyosarkome). Während man früher von einer malignen Entartung gutartiger Myome ausging, lassen spätere genetische Untersuchungen (Levy u. a., 2000) stark annehmen, dass die Sarkome schon primär als solche entstehen und vorerst nur verkannt werden aufgrund differentialdiagnostischer Schwierigkeiten. Leiomyosarkome können sowohl sonographisch, als auch tomographisch einem Myom ähneln; meist ist es die rasche Größenprogression die den Verdacht auf eine potentielle Malignität erweckt. Ein Leiomyosarkom kann nur pathologisch nach dessen vollständiger Entfernung nachgewiesen werden, entweder vermittels Enukleation des Myoms oder im Rahmen einer Gebärmutterentfernung.
- Zu den seltenen sekundären Veränderungen der Myome zählen die ödematöse Auflockerung sowie angiomatöse (gefäßreiche), endometriotische, lipomatöse (fettige) oder chronisch entzündliche Veränderungen.[6]
Therapie
[Bearbeiten | Quelltext bearbeiten]

Myome der Gebärmutter sind gutartige Tumoren, die an sich keinerlei Therapie benötigen. Durch ihre Lage in der Gebärmutter und/oder ihre Größe (von sehr klein bis zu 15 cm oder größer) können sie jedoch Beschwerden verursachen, was dann eine Therapie erfordern kann.
- Konservative Therapie: Myome, die keine Beschwerden machen, bedürfen meist keiner Therapie und können klinisch und mittels Ultraschall in regelmäßigen Intervallen kontrolliert werden. Die konservative, medikamentöse Therapie wird meist zuerst angewandt. Als Medikamentengruppen kommen entzündungshemmende, nicht steroidale Medikamente wie Ibuprofen oder Naproxen zum Einsatz, Ovulationshemmer, sowie hormonelle Therapien mit GnRH-Analoga, welche, in der Regel über sechs Monate durchgeführt, ein reversibles, der Postmenopause entsprechendes endokrines Milieu erzeugen. Durch die GnRH-Analoga gelingt häufig eine Größenreduktion der Myome. Nach Absetzen der Therapie kann es jedoch zu einem Wiedereinsetzen des Wachstums auf die Originalgröße kommen. Die möglichen Nebenwirkungen der GnRH-Analoga entsprechen denen des Menopausenstatus, wie Osteoporose, Trockenheit der Scheide und Hitzewallungen.
Seit März 2012 ist in Deutschland für geeignete Patientinnen Ulipristalacetat aus der Gruppe der Selektiven Progesteron-Rezeptor-Modulatoren (SPRM) zur Therapie symptomatischer Myome zugelassen, bei denen nach 12-wöchiger täglicher oraler Gabe einer Tablette mit 5 mg ein operativer Eingriff vorgesehen ist. In randomisierten Doppelblindstudien wurde die Effizienz dieser Behandlung nachgewiesen. Es tritt bei Blutungsstörungen ein Sistieren der Blutung durchschnittlich innerhalb von 7 Tagen und eine durchschnittliche Volumenverkleinerung um 36 % zum Ablauf von drei Monaten ein. Während die Monatsblutungen nach Absetzen rasch, meist reduziert, wieder auftraten, hielt die Volumenreduktion über mehr als 6 Monate an. Häufigste Nebenwirkungen von Ulipristalacetat bestanden in Kopfschmerzen bei ca. 20 % der Anwenderinnen. Im Gegensatz zu GnRH-Analoga werden die Östrogenspiegel nicht beeinflusst, sodass typische vorübergehende menopausenartige Ausfallerscheinungen nicht auftreten. Während der Therapie beobachtete man bei 60 % der Anwenderinnen reversible gutartige Veränderungen am Endometrium (PAEC).[1] Die Bedeutung einer Therapie mit Ulipristalacetat (UPA) in Hinblick auf die Erfüllung eines Kinderwunsches ist unklar: Es liegen bis dato (Dezember 2016) keine vergleichenden Daten UPA vs. Myomentfernung bei dieser Indikation vor.
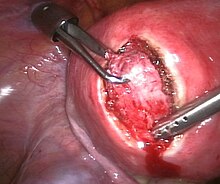
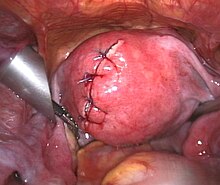
- Operative Therapie: Myome mit Beschwerden werden meist chirurgisch behandelt. Es werden gebärmuttererhaltende und ablative Verfahren unterschieden. Bei den gebärmuttererhaltenden Verfahren werden die Myome aus der Gebärmutter geschält. Dies kann per Bauchschnitt, aber zunehmend auch mittels Bauchspiegelung, unter Voraussetzungen (submuköse Lage[7]) auch mittels Hysteroskopie (Gebärmutterspiegelung) erfolgen. Als ablatives Verfahren gilt die Hysterektomie (Gebärmutterentfernung). Diese kann vaginal, per Bauchschnitt (abdominal) oder per Laparoskopie (Bauchspiegelung) durchgeführt werden. Die Technik des Zerkleinerns (Morcellement) von Myomen und Uteri kann unabhängig vom Operationsweg (Bauchschnitt, Operation über die Scheide oder per Bauchspiegelung) in sehr seltenen Fällen auch zur Streuung von gutartigem, jedoch auch von zunächst nicht bekanntem bösartigem Gewebe im Bauchraum führen.[8][9] Bei der Wahl der richtigen Therapieoption spielt neben dem Alter der Patientin, ihrem Therapiewunsch (z. B. noch Kinderwunsch?) natürlich die Größe und Lage des/der Myome die zentrale Rolle.
- Myomembolisation oder Uterusarterienembolisation (UAE): Bei der Uterusmyomembolisation handelt es sich um eine radiologische, minimal-invasive Behandlung der Myome. Dazu wird über einen Hautschnitt in der rechten Leiste ein Katheter unter Röntgenkontrolle in die den Uterus versorgende Arterie vorgeschoben. Die Embolisation erfolgt meistens über einen Mikrokatheter mit einem geringen Außendurchmesser von 2,5-2,8 F (das entspricht 0,8-0,9 mm).[10] Wenn der Katheter sicher im zuführenden Gefäßsystem des Myoms platziert ist, wird über diesen das zuführende Gefäßsystem mittels des Einspritzens von kleinen Gelatine- oder Plastik-Partikeln embolisiert. Die kleinen Partikel (500-900 Mikrometer) fließen in die Endarterien des Myoms und verbleiben darin (und verschließen damit alle im Uterus befindlichen Myome in einem Eingriff). Über ein paar Minuten werden so die zuführenden Gefäße langsam blockiert. Diese Prozedur muss auch im Gefäßsystem der Gegenseite in gleicher Weise durchgeführt werden. Zur Betäubung der Schmerzen während und nach dem Eingriff bedarf es meist einer PCA-Pumpe (Patienten-kontrollierte Analgesie), wo über eine Perfusorspritze von der Patientin selbstständig Schmerzmittelboli abgerufen werden können. Die meisten Patientinnen beschreiben den Eingriff als gut verträglich. Mit der Uterusmyomembolisation können je nach Myomtyp und präinterventioneller Symptome 78-94 Prozent der so behandelten Frauen symptomfrei werden. Bezüglich Patientinnen mit Kinderwunsch liegt folgender Konsensus des 2. und 3. Radiologisch-Gynäkologischen Expertentreffens vor: „Die UAE ist keine Methode im Rahmen der Kinderwunschbehandlung. Bevor bei einer Patientin mit nicht abgeschlossener Familienplanung eine Hysterektomie in Erwägung gezogen wird, sollte die Möglichkeit einer UAE geprüft werden. Für Patientinnen mit Kinderwunsch ist die Rolle der UAE als Behandlungsoption nicht geklärt. Es existieren bisher keine prospektiv erhobenen Daten, deren Ergebnisse mit der erforderlichen Evidenz eine Aussage über den Einfluss der UAE auf Fertilitätsrate und Schwangerschaftsausgang zulassen.“[11][12] Allerdings ist eine Hysterektomie bei Patientinnen mit Kinderwunsch aus gynäkologischer Sicht grundsätzlich nicht angezeigt.[13] Retrospektive Daten weisen bei nach Myomembolisation eingetretenen Schwangerschaften auf signifikant erhöhte Komplikationsraten hin.[14]
- Fokussierter Ultraschall (MRgFUS, MR-HIFU): eine Methode, die seit etwa 2002 zur Verfügung steht und zunehmend an Bedeutung gewinnt, ist die gezielte Ultraschallerhitzung der Myome auf bis zu 80 °C unter MRT-Kontrolle.[15][16] Kontraindikationen ergeben sich größtenteils aus denen des MRT-Verfahrens an sich (z. B. Metallimplantate, Herzschrittmacher, Platzangst). Des Weiteren beziehen sich die Ein- bzw. Ausschlusskriterien auf die Lage, Größe, Anzahl und Durchblutung der Myome. Die Methode ist für Frauen mit Kinderwunsch prinzipiell geeignet, da die Gebärmutter erhalten wird. Aufgrund noch fehlender ausreichender Daten wird von deutschsprachigen Experten (radiologisch-gynäkologisches Konsensustreffen) eine solche Behandlung bei Frauen mit Kinderwunsch jedoch nicht empfohlen.[17] Die Therapie erfolgt in der Regel ambulant. Die Kosten werden von nur wenigen Krankenkassen pauschal übernommen, bei vielen anderen erfolgt dies pro Einzelfall auf Antrag. Die Methode ist in Deutschland zurzeit (Stand Mai 2014) an acht Standorten verfügbar (Berlin, Bochum, Bottrop, Dachau, Heidelberg, Lübeck, München und Stuttgart).[18]
Literatur
[Bearbeiten | Quelltext bearbeiten]- T. K. Helmberger, T. F. Jakobs, MF Reiser: Technique and methods in uterine leiomyoma embolization. In: Radiologe, 2003, 43(8), S. 634–640.
- T. J. Kröncke, B. Hamm: Role of magnetic resonance imaging (MRI) in establishing the indication for, planning, and following up uterine artery embolization (UAE) for treating symptomatic leiomyomas of the uterus. In: Radiologe, 2003, 43(8), S. 624–633.
- B. Radeleff, S. Rimbach, G. W. Kauffmann u. a.: Risk and complication rate of uterine fibroid embolization (UFE). In: Radiologe, 2004, 43(8), S. 641–650.
- G. M. Richter, B. Radeleff, S. Rimbach u. a.: Uterine fibroid embolization with spheric micro-particles using flow guiding: safety, technical success and clinical results. In: Röfo, 2004, 176(11), S. 1648–1657.
- J. Pelage: Treatment of uterine fibroids. In: Lancet, 2001, 12(357(9267)), S. 1530.
- J. H. Ravina, A. Aymard, N. Ciraru-Vigneron u. a.: Uterine fibroids embolization: results about 454 cases. In: Gynecol Obstet Fertil., 2003, 31(7-8), S. 597–605.
- J. B. Spies, J. Bruno, F. Czeyda-Pommersheim u. a.: Long-term outcome of uterine artery embolization of leiomyomata. In: Obstet Gynecol., 2005, 106(5), S. 933–939.
- D. T. Rein, T. Schmidt, M. Fleisch, R. Wagner, W. Janni: Multimodale Behandlung des Uterus myomatosus. In: Frauenarzt, 50, 2009, S. 752–758, frauenarzt.de (PDF; 520 kB)
- A. Taran, G. Gaffke, M. Rüsch, H. Heuer, B. Hosang, J. Ricke, S.-D. Costa: Die moderne multimodale Therapie des Uterus myomatosus: Wann ist eine Hysterektomie indiziert? In: Ärzteblatt Sachsen-Anhalt, 19, 2008, S. 38–45.
- Jacques Donnez u. a.: Ulipristal Acetate versus Placebo for Fibroid Treatment before Surgery. In: N Engl J Med., 2012, 366, S. 409–420.
- Jacques Donnez u. a.: Ulipristal Acetate versus Leuprolide Acetate for Uterine Fibroids. In: N Engl J Med., 2012, 366, S. 421–432.
- M. Kirschbaum, K. Münstedt: Checkliste Gynäkologie und Geburtshilfe. Georg Thieme Verlag, Stuttgart, ISBN 3-13-126292-3.
- Diedrich u. a.: Gynäkologie & Geburtshilfe. Springer Medizin Verlag, Heidelberg, ISBN 978-3-540-32867-4.
- A. Strauss: Ultraschallpraxis: Geburtshilfe und Gynäkologie. 2. Auflage. Springer Medizin Verlag, Heidelberg 2008, ISBN 978-3-540-78252-0.
- C. Keck, J. Neulen, H. Behre, M. Breckwoldt: Praxis der Frauenheilkunde / Endokrinologie, Reproduktionsmedizin, Andrologie. Georg Thieme Verlag, Stuttgart, ISBN 978-3-13-107162-0.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Bilder einer Myomoperation
- Konsensuspapier von Radiologen und Gynäkologen zur Myomembolisation (2010) (PDF; 208 kB)
- Informationen zu Myomen. Arbeitsgemeinschaft für Gynäkologische Endoskopie der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe.
- Uterus-Myomatosus.net – Gemeinnütziges Patienteninformationsportal zu Myomtherapien
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Ulipristalacetat bei symptomatischem Uterus myomatosus und bei myombedingter Hypermenorrhoe. Gemeinsame Stellungnahme der Deutschen Gesellschaft für Gynäkologische Endokrinologie und Fortpflanzungsmedizin (DGGEF) e. V. und des Berufsverbands der Frauenärzte (BVF) e. V.
- ↑ P. Igboeli, W. Walker, A. McHugh, A. Sultan, A. Al-Hendy: Burden of Uterine Fibroids: An African Perspective, A Call for Action and Opportunity for Intervention. In: Current Opinion in Gynecology and Obstetrics. Band 2, Nr. 1, 2019, S. 287–294, doi:10.18314/cogo.v2i1.1701, PMID 32647835, PMC 7344264 (freier Volltext).
- ↑ William H. Parker: Uterine Fibroids: Clinical Features. In: Andrea Tinelli, Antonio Malvasi (Hrsg.): Uterine Myoma, Myomectomy and Minimally Invasive Treatments. Springer, 2014, ISBN 978-3-319-10305-1, S. 39 (google.com).
- ↑ Einteilung der Myome. frauenaerzte-im-netz.de
- ↑ Myome und Schwangerschaft
- ↑ Dissertation zum Thema Uterusmyome (PDF; 29 MB)
- ↑ Hysteroskopische Myomenukleation ( des vom 6. Juni 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. präsentiert im Portal des Marienhospitals Stuttgart
- ↑ Michael A. Seidman, Titilope Oduyebo, Michael G. Muto, Christopher P. Crum, Marisa R. Nucci, Bradley J. Quade: Peritoneal Dissemination Complicating Morcellation of Uterine Mesenchymal Neoplasms. In: PLoS ONE. 7, 2012, S. e50058; PMID 23189178, doi:10.1371/journal.pone.0050058
- ↑ M. W. Beckmann, I. Juhasz-Böss, D. Denschlag, P. Gaß, T. Dimpfl, P. Harter, P. Mallmann, S. P. Renner, S. Rimbach, I. Runnebaum, M. Untch, S. Y. Brucker, D. Wallwiener: Surgical Methods for the Treatment of Uterine Fibroids – Risk of Uterine Sarcoma and Problems of Morcellation: Position Paper of the DGGG. In: Geburtshilfe Frauenheilkd., 2015, 75, S. 148–164; doi:10.1055/s-0035-1545684, deutschsprachige Version (PDF; 234 kB)
- ↑ „Patienteninformation zur Myomembolisation, Universitätsklinikum Jena“
- ↑ T. J. Kröncke, M. David: Ergebnisse des 2. Radiologisch-gynäkologischen Expertentreffens – Uterusarterienembolisation (UAE) zur Myombehandlung.(Konsensuspapier) In: Fortschr Röntgenstr., 2007, 179, S. 325–326, doi:10.1055/s-2007-972191
- ↑ Thomas Kröncke, Matthias David: Uterusarterienembolisation zur Myombehandlung. In: Frauenarzt. 51 (2010), S. 644–646, online ( des vom 12. Dezember 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 213 kB)
- ↑ Thomas Römer, Hans-Rudolf Tinneberg: Kommentar zu: Thomas Kröncke, Matthias David: Uterusarterienembolisation zur Myombehandlung. In: Frauenarzt. 51 (2010), S. 647–648, frauenarzt.de ( des vom 12. Dezember 2013 im Internet Archive; PDF; 213 kB) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ M. David, T. Kröncke: Uterine Fibroid Embolisation – Potential Impact on Fertility and Pregnancy Outcome. In: Geburtshilfe Frauenheilkd, 2013, 73, S. 247–255.
- ↑ Myome zerstören mit fokussiertem Ultraschall unter Kernspin-Kontrolle
- ↑ Magnetresonanzgeführte (MR) Therapie von Uterusmyomen mit fokussiertem Ultraschall – eine nichtinvasive Behandlung zur Verbesserung der Lebensqualität. ( des vom 6. September 2009 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ T. Kröncke, M. David: Magnetresonanzgeführter fokussierter Ultraschall zur Myombehandlung – Ergebnisse des 2. Radiologisch-gynäkologischen Expertentreffens.(Konsensuspapier) In: Fortschr Röntgenstr., 2015, 187, S. 480–482, doi:10.1055/s-0034-1399342
- ↑ Vorstellung des MRgFUS Verfahrens ( des vom 7. Juni 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. uterusmyome.de, Portal des Klinikums Dachau.