Biotina

| Biotina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
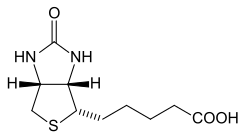
| Ácido 5-[(3aS,4S,6aR)-2-oxohexahidro-1H-tieno[3,4-d]imidazol-4-yl]pentanoico | ||
| General | ||
| Fórmula estructural |  | |
| Fórmula molecular | C10H16N2O3S | |
| Identificadores | ||
| Número CAS | 58-85-5[1] | |
| ChEBI | 15956 | |
| ChEMBL | CHEMBL857 | |
| ChemSpider | 149962 | |
| DrugBank | DB00121 | |
| PubChem | 171548 | |
| UNII | 6SO6U10H04 | |
| KEGG | C00120 D00029, C00120 | |
| Propiedades químicas | ||
| Solubilidad en agua | 1,79 | |
| Biocitina | ||
La biotina (del griego bios, "vida"), a veces también llamada vitamina H, vitamina B7 y vitamina B8, es una vitamina estable al calor, soluble en agua y alcohol, y susceptible a la oxidación que interviene en el metabolismo de los hidratos de carbono, grasas, aminoácidos y purinas.
Es esencial para la síntesis y degradación de grasas y la degradación de ciertos aminoácidos.
La clara de huevo cruda contiene la proteína avidina que impide la absorción de la biotina en el intestino, por lo que se debe consumir perfectamente cocida. La avidina se desnaturaliza por la cocción y pierde función.
Una cantidad considerable se sintetiza por bacterias intestinales y se absorbe por vía intestinal.
No se han llevado a cabo estudios definitivos sobre los requerimientos de biotina por la falta de conocimiento sobre la disponibilidad de este elemento en los alimentos y la contribución microbiana, pero se reconoce que una ingesta segura y adecuada de esta vitamina es de 200 a 300 μg diarios.

Historia
[editar]Su historia comienza aproximadamente en el año 1916, cuando W.G. Bateman observó que una dieta rica en claras de huevo crudas provocaba síntomas tóxicos en perros, gatos, conejos y seres humanos.[2] Este estudio fue seguido en 1927 por Margaret Averil Boas, quien descubrió que una dieta de solo claras de huevo causaba dermatitis, alopecia y pérdida de coordinación muscular en ratas.[3] Ella llamó a este síndrome «enfermedad de la clara de huevo».
En 1939, seis años después de que comenzara a investigar la causa de la lesión de la clara de huevo, el científico húngaro Paul Gyorgy confirmó la existencia de un factor protector, al que llamó vitamina H.[4] En este punto, muchos grupos independientes ya habían aislado el mismo compuesto. En 1936, Kögl y Tönnis aislaron un factor de crecimiento de la yema de huevo que llamaron «Bios aus Eigelb».[5] En esa misma década se encontró en la clara de huevo cruda una glicoproteína llamada avidina que tenía la característica de unirse de manera irreversible con la biotina (complejo avitina + biotina), un complejo con la particularidad de no poder ser absorbido por el tracto gastro-intestinal de los mamíferos, la razón de que Bateman hubiera observado, por primera vez en un medio controlado, un déficit grave de biotina y sus consecuencias. Después de realizar experimentos con levadura y Rhizobium R, West y Wilson aislaron un compuesto que llamaron coenzima R.[6] En 1940, Gyorgy demostró que la vitamina H, la «Bios aus Eigelb» y la coenzima R eran la misma sustancia: biotina.[7]
Estructura química
[editar]Está compuesta de un anillo ureido (imidazolínico) fusionado con un anillo tetrahidrotiofeno. Un ácido valérico sustituto se une a uno de los átomos de carbono del anillo tetrahidrotiofeno. Hay tres formas de biotina: biotina libre , biocitina (e-biotina-L-Lisina) y dos sulfóxidos L y D de la biotina.
Rol biológico
[editar]La biotina es importante como una coenzima de enzimas que intervienen en la catálisis de reacciones metabólicas esenciales para sintetizar ácidos grasos, en la gluconeogénesis y en el metabolismo de la leucina.
Función
[editar]La biotina se encuentra en la célula unida con resto específico de lisina (un aminoácido) formando la biocitina; la biocitina se une covalentemente a ciertas enzimas relacionadas con la formación o la utilización del dióxido de carbono, y ejerce así función de coenzima:[8] actúa en la transferencia (aceptor y donador) de dióxido de carbono en numerosas carboxilasas y decarboxilasas:[9]
- Piruvato carboxilasa
- Acetil-CoA carboxilasa alfa y beta
- Propionil-CoA carboxilasa
- Metilcrotonil-CoA carboxilasa
- Geranoil-CoA carboxilasa
- Urea carboxilasa
- Oxaloacetato decarboxilasa.
- Metilmalonil-CoA decarboxilasa.
- Produce anticuerpos
- Es esencial en la producción de hormonas y colesterol
Todas estas enzimas son esenciales en los procesos de duplicación celular, por ello lo observado por Bateman: al privar de biotina las ratas, comenzaron con déficit de enzimas celulares que afectó inicialmente a los tejidos de rápida reproducción o mitosis (piel, cabellos, células de recubrimiento axónico).
La biotina es usada en el crecimiento celular, la producción de ácidos grasos y en el metabolismo de grasas y aminoácidos. Juega un papel en el ciclo del ácido cítrico o Krebs,[10] el cual es un proceso por el cual la energía bioquímica es generada durante la respiración aeróbica. La biotina no solo asiste en varias conversiones químicas y metabólicas, sino también ayuda a transferir dióxido de carbono.[10] La biotina participa también en el mantenimiento de los niveles de azúcar en la sangre o glucemia.
Las vísceras, la yema de huevo, el pescado, los guisantes secos, las setas, la levadura de cerveza y los frutos secos son fuentes con alto contenido de biotina. La biotina es estable a la cocción, pero menos a la exposición a álcalis. En el caso de la yema del huevo es diferente el cambio que sufre cuando es expuesta a un álcalis, ya que esta sufre una coloración más naranja de lo habitual y su textura se observa dura pero a la vez rugosa, esto se debe a que la biotina se encuentra concentrada al contorno de la yema y que la estructura transparente del huevo permite observar el cambio con más claridad, a diferencia de las vísceras que solo se vuelven secas sin sufrir algún cambio de coloración importante, ya que la biotina en ellas se encuentra en mayor cantidad en su interior.
Usos
[editar]Alivia dolores musculares, el eczema y la dermatitis, y también ayuda a combatir la depresión y la somnolencia. No se han llevado a cabo estudios definitivos sobre los requerimientos de biotina por la falta de conocimiento sobre la disponibilidad de ella en los alimentos y la contribución microbiana, pero se reconoce que una ingesta segura y adecuada de esta vitamina es de 200-300 μg diarios.[cita requerida]
A menudo esta vitamina es recomendada para fortalecer uñas y piel. La deficiencia es extremadamente rara, ya que una bacteria intestinal puede producirla y hasta el 50% del requerimiento diario. Las fuentes principales de la vitamina la constituyen alimentos derivados de origen animal, (principalmente vísceras), leche y derivados, así como la levadura, adicional al 50% proveniente de la microflora intestinal.[cita requerida]
La unión de la biotina a varios sitios químicos, llamado Biotinilación, puede ser usada como una importante técnica de laboratorio para estudiar varios procesos, incluyendo localización de proteínas, interacción de proteínas, transcripción y replicación del ADN. La biotina por sí misma es utilizada para biotinilizar histonas, pero no es encontrada naturalmente en el ADN. La holocarboxilasa sintetasa está involucrada en el ligamiento de la biotina.[cita requerida]
Carencia
[editar]Puede ser deficitaria en individuos que reciben alimentación parenteral total durante varios años. Los síntomas provocan el deterioro de las funciones metabólicas descritas, eczema, dermatitis seca y descamativa, palidez, náuseas, vómitos, gran fatiga y depresión.
¿Qué pasa con la clara del huevo y la avidina?, solo se encuentra avidina activa en la clara cruda del huevo ya que al someterla a cocción se neutraliza, no así la biotina que soporta altas temperaturas sin modificaciones, por lo cual comer huevos cocidos proporciona biotina sin avidina, pero al comerlos crudos no hay ingesta de biotina por inactivación de la misma con la avidina.
Entre otros síntomas, del déficit de biotina se encuentran también: colitis, glositis atrófica y anemia leve. Todas, relacionadas con las células que requieren de rápidas mitosis.
Las dietas bajas en colesterol y grasas también son bajas en biotina.
La biotina se encuentra ampliamente distribuida en los alimentos, principalmente en riñón, hígado, yema de huevo, hongos, algunas verduras (coliflor, patata) y frutas, (plátano, uva, sandía, aguacate y fresas), cacahuete, levadura, leche, almendras, nueces, guisantes secos, pescado, pollo y en la jalea real.
Sobredosificación
[editar]La flora intestinal es capaz de sintetizar gran cantidad de biotina. La eliminación fecal y urinaria, mucho más elevada que la ingesta dietética, indica la magnitud de síntesis por parte de la microflora.
La biotina no registra casos conocidos de sobredosificación, ya que al ser hidrosoluble, se elimina con facilidad por vía renal, en forma de biotina libre o dos metabolitos inactivos Bis-norbiotina y biotina sulfóxido. Se cree que las bacterias intestinales podrían generar biotina o que tendrían capacidad de reciclar metabolitos inactivos a biotina libre (esto último tiene un bajo nivel de evidencia científica).
Usos
[editar]- Problemas de cabello
Los suplementos de biotina son a menudo recomendados como un producto natural para contrarrestar el problema de pérdida de cabello tanto en niños como adultos. Sin embargo, no hay estudios que muestren los beneficios de la biotina cuando el sujeto no está deficiente de la vitamina. Los signos y síntomas por deficiencia de biotina incluyen pérdida del cabello la cual progresa a severidad cuando incluye pérdida de pestañas y cejas. Algunos champús disponibles contienen biotina, pero es dudoso si estos ejercen algún efecto benéfico, ya que la biotina no es absorbida a través de la piel.
Los niños con un raro desorden metabólico hereditario llamado Fenilcetonuria (en el cual es imposible metabolizar el aminoácido fenilalanina), a menudo desarrollan condiciones en la piel como eczema y dermatitis seborreica en otras áreas del cuerpo con excepción del cuero cabelludo. Los cambios escamosos de la piel que ocurren en los individuos con Fenilcetonuria se pueden relacionar con la capacidad pobre de utilizar la biotina. El aumento en la ingesta dietética de biotina se ha asociado con una mejora de la dermatitis seborreica en estos casos.[11]
- Diabetes
Las personas con Diabetes tipo 2 frecuentemente cursan con bajos niveles de biotina. La biotina puede ser involucrada en la síntesis y liberación de insulina- estudios preliminares en animales y personas sugieren que la biotina puede ayudar a mejorar los niveles de azúcar en la sangre en aquellos que padecen Diabetes, particularmente la tipo II.[12]
Deficiencia
[editar]La deficiencia de biotina es relativamente rara y puede ser tratada con suplementación. La deficiencia puede ser causada por el consumo excesivo de clara de huevo cruda, la cual contiene altos niveles de la proteína avidina. Esta proteína se liga fuertemente a la biotina impidiendo su absorción intestinal. La avidina es inactivada con la cocción, mientras que la biotina permanece activa.
La deficiencia de biotina puede estar causada por déficit de la enzima que la metaboliza (biotinidasa) o por trastornos en el metabolismo de la biotina como en personas alcohólicas y en personas con tratamientos anticonvulsivantes (compiten con la biotina por la biotinidasa). Cuando ocurre la deficiencia puede observarse dermatitis seborreica, conjuntivitis, pérdida de cabello, cejas y pestañas e incluso síntomas neurológicos como depresión, irritabilidad y convulsiones. Existe una enfermedad congénita producida por una mutación que afecta al transportador de biotina tipo 2, recibe el nombre de enfermedad de los ganglios basales sensible a la biotina, causa un cuadro de encefalopatía grave que responde favorablemente al tratamiento con biotina.
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ Bateman WG (June 1916). «The Digestibility and Utilization of Egg Proteins». Journal of Biological Chemistry 26: 263-91.
- ↑ Boas, M (1927). «The effect of desiccation on the nutrient value of the protein». Biochemical Journal 21 (3): 712-24. PMC 1251968. PMID 16743887. doi:10.1042/bj0210712.
- ↑ Gyorgy, Paul (December 1939). «The Curative Factor (vitamin H) for Egg White Injury, with Particular Reference to Its Presence in Different Foodstuffs and in Yeast». Journal of Biological Chemistry 131: 733-44.
- ↑ Kögl and Tönnis (1936). «Über das Bios-Problem. Darstellung von krystallisiertem Biotin aus Eigelb. 20. Mitteilung über pflanzliche Wachstumsstoffe». Hoppe-Seyler's Zeitschrift für Physiologische Chemie 242 (1–2): 43-73. doi:10.1515/bchm2.1936.242.1-2.43.
- ↑ West PM, Wilson PW (June 1939). «The Relation of "coenzyme R" to Biotin». Science 89 (2322): 607-8. Bibcode:1939Sci....89..607W. PMID 17751623. doi:10.1126/science.89.2322.607.
- ↑ György P, Rose CS, Eakin RE, Snell EE, Williams RJ (May 1941). «Egg-White Injury as the Result of Nonabsorption or Inactivation of Biotin». Science 93 (2420): 477-8. Bibcode:1941Sci....93..477G. PMID 17757050. doi:10.1126/science.93.2420.477.
- ↑ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Morgan, David; Raff, Martin; Roberts, K.; Walter, P. (2016). Biología molecular de la célula (6ª edición). Barcelona: Omega S.A. pp. 66-7, 146. ISBN 978-84-282-1638-8.
- ↑ Kuroishi, Toshinobu; Zempleni, Janos (1 de marzo de 2012). «Biotin». Advances in Nutrition (en inglés) 3 (2): 213-214. ISSN 2161-8313. doi:10.3945/an.111.001305. Consultado el 1 de abril de 2019.
- ↑ a b Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Morgan, David; Raff, Martin; Roberts, K.; Walter, P. (2016). Biología molecular de la célula (6ª edición). Barcelona: Omega S.A. pp. 66-7. ISBN 978-84-282-1638-8.
- ↑ Makino, Y.; Osada, K.; Sone, H.; Sugiyama, K.; Komai, M.; Ito, M.; Tsunoda, K.; Furukawa, Y. (1999-6). «Percutaneous absorption of biotin in healthy subjects and in atopic dermatitis patients». Journal of Nutritional Science and Vitaminology 45 (3): 347-352. ISSN 0301-4800. PMID 10524353. Consultado el 1 de abril de 2019.
- ↑ Campbell, R. Keith (Nov. 2006). "A Critical Review of Chromium Picolinate and Biotin". U.S. Pharmacist 31 (11).
Bibliografía
[editar]- Campbell, R. Keith (Nov. 2006). "A Critical Review of Chromium Picolinate and Biotin". U.S. Pharmacist 31 (11).
- Holmberg A, Blomstergren A, Nord O et al. (2005). "The biotin-streptavidin interaction can be reversibly broken using water at elevated temperatures". Electrophoresis 26 (3): 501-10. doi:10.1002/elps.200410070. PMID 15690449.
- Jane Higdon, "Biotin", Micronutrient Information Center, Linus Pauling Institute.