Cromosoma


En biología y citogenética, se denomina cromosoma[a] (del griego χρώμα, -τος chroma, color y σώμα, -τος soma, cuerpo o elemento) a cada una de las estructuras altamente organizadas, formadas por ADN y proteínas, que contiene la mayor parte de la información genética de un ser vivo.
En las divisiones celulares (mitosis y meiosis) el cromosoma presenta su forma más conocida, cuerpos bien delineados en forma de X, debido a su alto grado de compactación y duplicación.
En la interfase no pueden ser visualizados mediante el microscopio óptico de manera nítida ya que ocupan territorios cromosómicos discretos. En las células eucariotas y en las arqueas (a diferencia que en las bacterias), el ADN siempre se encontrará en forma de cromatina, es decir, asociado fuertemente a unas proteínas denominadas histonas y no-histonas. La cromatina, organizada en cromosomas, se encuentra en el núcleo de las células eucariotas y se visualiza como una maraña de hebras delgadas. Cuando comienza el proceso de duplicación y división del material genético llamado (cariocinesis), esa maraña de hebras inicia un fenómeno de condensación progresivo que permite visualizar cada uno de los cromosomas.

Cuando se examinan con detalle durante la mitosis, se observa que cada uno de los cromosomas presenta una forma y un tamaño característicos.
Cada cromosoma tiene una región condensada, o constreñida, llamada centrómero, que confiere la apariencia particular a cada cromosoma y que permite clasificarlos según la posición del centrómero a lo largo del cromosoma.
Otra observación que se puede realizar es que el número de cromosomas de los individuos de la misma especie es constante. Esta cantidad de cromosomas se denomina número o Ploidía y se simboliza como 2n o 4n o 1n dependiendo del tipo de célula.
Cuando se examina la longitud de tales cromosomas y la situación del centrómero surge el segundo rasgo general: para cada cromosoma con una longitud y una posición del centrómero determinada existe en el núcleo otro cromosoma con características idénticas, o sea, en las células diploides 2n los cromosomas se encuentran formando pares. Los miembros de cada par se denominan cromosomas homólogos.

En la figura de la derecha se presentan todos los cromosomas de interfase de una niña (obsérvese los dos cromosomas X abajo derecha), ordenados por parejas de homólogos y por su longitud, lo que se denomina cariotipo. Puede observarse que en este cariotipo hay 46 cromosomas (o sea, 2n=46) que es el número cromosómico de la especie humana. Se puede advertir, también, que cada cromosoma tiene una estructura doble, con dos cromátidas hermanas que yacen paralelas entre sí y unidas por un único centrómero. Durante la mitosis las cromátidas hermanas, que son idénticas, se separan una de otra hacia dos nuevas células.
Las parejas de cromosomas homólogos que se observan en la imagen tienen, además, una semejanza genética fundamental: presentan los mismos genes situados en los mismos lugares a lo largo del cromosoma (tales lugares se denominan locus o loci en plural). Esto indica que cada miembro del par de homólogos lleva información genética para las mismas características del organismo. En organismos con reproducción sexual, uno de los miembros del par de cromosomas homólogos proviene de la madre (a través del óvulo) y el otro del padre (a través del espermatozoide). Por ello, y como consecuencia de la herencia biparental, cada organismo diploide tiene dos copias de cada uno de los genes, cada una ubicada en uno de los cromosomas homólogos.
Una excepción importante al concepto de parejas de cromosomas homólogos es que en muchas especies los miembros de la pareja de los cromosomas sexuales, no tienen el mismo tamaño, ni igual situación del centrómero, ni la misma proporción entre los brazos o, incluso, no tienen los mismos loci. Por ejemplo, el cromosoma Y (que determina el sexo masculino en humanos) es de menor tamaño y carece de la mayoría de los loci que se encuentran en el cromosoma X.[2]
Historia y definiciones
[editar]Desde el punto de vista etimológico, el vocablo «cromosoma» procede del griego y significa «cuerpo que se tiñe»; mientras que la palabra «cromatina» significa «sustancia que se tiñe».
Los cromosomas fueron observados en células de plantas por el botánico suizo Karl Wilhelm von Nägeli en 1842 e, independientemente, por el científico belga Edouard Van Beneden en lombrices del género Ascaris.[3][4] El uso de drogas basofílicas (p. ej. las anilinas) como técnica citológica para observar el material nuclear fue fundamental para los descubrimientos posteriores. Así, el citólogo alemán Walther Flemming en 1882 definió inicialmente la cromatina como «la sustancia que constituye los núcleos interfásicos y que muestra determinadas propiedades de tinción».[5]
Por lo tanto, las definiciones iniciales de cromosoma y cromatina son puramente citológicas. La definición biológica solo se alcanzó a principios del siglo XX, con el redescubrimiento de las leyes de Mendel: tanto la cromatina como el cromosoma constituyen el material genético organizado. Para ello, fueron fundamentales los trabajos del neerlandés Hugo de Vries (1848-1935), del alemán Carl Correns (1864-1933) y del austríaco Erich von Tschermak-Seysenegg (1871-1962), cuyos grupos de investigación redescubrieron independientemente las leyes de Mendel y asociaron los factores genéticos o genes a los cromosomas. Un breve resumen de los acontecimientos asociados a la historia del concepto de cromosoma se provee a continuación.[6]
El primer investigador que aisló ADN fue el suizo Friedrich Miescher, entre 1868 y 1869, cuando realizaba sus estudios postdoctorales en el laboratorio de Felix Hoppe-Seyler (uno de los fundadores de la bioquímica, la fisiología y la biología molecular) en Tübingen. Miescher estaba analizando la composición química del pus de los vendajes usados del hospital, para lo cual aisló núcleos y comprobó que estaban formados por una única sustancia química muy homogénea, no proteica, a la que denominó nucleína. Sin embargo, fue Richard Altmann en 1889 quien acuñó la locución «ácido nucleico», cuando se demostró que la nucleína tenía propiedades ácidas. En 1881, E. Zacharias demostró que los cromosomas estaban químicamente formados por nucleína, estableciendo la primera asociación entre los datos citológicos y bioquímicos.
Las primeras observaciones de la división celular (la mitosis, durante la cual la célula madre reparte sus cromosomas entre las dos células hijas), se realizaron entre 1879 y 1882 por Walther Flemming y Robert Feulgen, de forma independiente, gracias al desarrollo de nuevas técnicas de tinción. La asociación entre herencia y los cromosomas se realiza poco después (1889) por August Weismann, de manera teórica, casi intuitiva. Pero los primeros datos experimentales que permitieron a Walter Sutton[7] y Theodor Boveri[8] proponer que los «factores» de Mendel eran unidades físicas que se localizan en los cromosomas (lo que se denomina a menudo la teoría cromosómica de Sutton y Boveri) datan de 1902. Estas ideas permanecieron controvertidas hasta que Thomas Hunt Morgan realizó los experimentos que hoy se consideran clásicos sobre los rasgos genéticos ligados al sexo, publicados en 1910, lo que le valió el Premio Nobel en 1933.[9]
La demostración de que los genes están en los cromosomas se realizó por Calvin Bridges y Nettie Stevens en 1912 y fue Alfred Henry Sturtevant quien probó que los genes se hallan dispuestos linealmente a lo largo del cromosoma, elaborando el primer mapa genético de un organismo, Drosophila melanogaster. Las bases fundamentales de la herencia quedaron definitivamente establecidas en 1915, cuando apareció el libro El mecanismo de la herencia mendeliana escrito por Morgan, Strurtevant, Müller y Bridges.[10][11] En 1919 Phoebus Levene identificó que un nucleótido está formado por una base, un azúcar y un fosfato,[12] iniciando así el análisis molecular del ADN, que llevaría a la comprensión de los mecanismos moleculares de la herencia (véase también Historia del ADN).
Cronología de descubrimientos
[editar]
- 1842, los cromosomas fueron descubiertos por Karl Wilhelm von Nägeli.
- 1865, las leyes de la herencia son descubiertas por Gregor Mendel, directamente relacionadas con la función cromosómica.
- 1869, Friedrich Miescher descubre el ADN.
- 1882, Walther Flemming identifica la cromatina, como sustancia que se tiñe en núcleos interfásicos.
- 1889, Wilhelm von Waldeyer les dio el nombre de cromosoma que significa cuerpo coloreado en idioma griego.
- 1910, Thomas Hunt Morgan describió que son los portadores de los genes.
- 1921, Theophilus Painter estableció erróneamente el número de cromosomas humanos en cuarenta y ocho, conclusión que se mantuvo vigente hasta 1956.
- 1944, Oswald Avery, C. McLeod y M. McCarty descubren que el ADN es el material hereditario.
- 1953, James Dewey Watson y Francis Harry Compton Crick descubren la estructura del ADN.
- 1956, Joe Hin Tjio estableció el número correcto de cromosomas humanos en 46 (cuarenta y seis).
- 1966, Severo Ochoa completa el código genético.
- 1972, D. Jackson, R. Symons, P. Berg: molécula artificial.
- 1973, J. Boyer, S. Cohen: clonación de bacterias.
- 1977, Frederick Sanger: secuenciación del ADN.
- 1978, producción de proteína humana en bacterias.
- 1981, se hace el primer diagnóstico prenatal.
- 1982, se crean los primeros organismos transgénicos.
- 1983, secuenciación de los primeros genomas enteros.
- 2001, secuenciación del genoma humano.
Estructura y composición química de la cromatina
[editar]Los cromosomas eucarióticos son moléculas muy largas de ADN de hélice doble que están estrechamente relacionadas con proteínas llamadas histonas y proteínas llamadas no histonas. Los cromosomas se pueden hallar desde estados laxos o poco compactados, como en los núcleos de las células en interfase, hasta en estados altamente compactados, como sucede en la metafase mitótica.
Los principales componentes que se obtienen cuando se aísla la cromatina de los núcleos interfásicos son el ADN, las proteínas histonas, las proteínas no histonas y el ARN.

Histonas
[editar]Las histonas son proteínas básicas, ricas en residuos de lisina y arginina, que muestran una elevada conservación evolutiva y que interaccionan con el ADN formando una subunidad que se repite a lo largo de la cromatina denominada nucleosoma. Los principales tipos de histonas que se han aislado en los núcleos interfásicos en diferentes especies eucariontes son: H1, H2A, H2B, H3 y H4. Además de estas histonas, también existen otras que son específicas de tejido como la histona H5 muy rica en lisina (25 moles%) específica de eritrocitos nucleados de vertebrados no mamíferos, y las histonas del endosperma.[13] Asimismo, la cromatina centromérica se caracteriza por la presencia de una isoforma específica de la histona H3, denominada CENP-A en vertebrados.
Una de las características más destacables es su elevado conservadurismo evolutivo, sobre todo de las histonas H3 y H4. La histona H4 de guisante y de timo de ternera se diferencian solamente en dos aminoácidos. Este dato indica que las interacciones entre el ADN y las histonas para formar la cromatina deben ser muy semejantes en todos los organismos eucariontes.
Los genes que codifican las histonas se encuentran agrupados en clústeres de genes que se repiten decenas o centenas de veces. Cada clúster o grupo contiene el siguiente orden de genes que codifican histonas: H1-H2A-H3-H2B-H4. Estos genes son ricos en pares G-C, ya que codifican proteínas con un elevado contenido en lisina y arginina, pero están separados por secuencias espaciadoras ricas en pares A-T.[14][15][13][16][17]
Nucleosoma
[editar]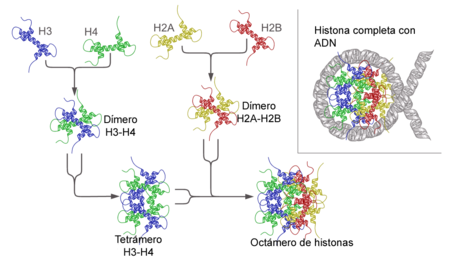
La cromatina de núcleos en interfase, cuando se observa mediante técnicas de microscopia electrónica, se puede describir como un collar de cuentas o un rosario, en el que cada cuenta es una subunidad esférica o globular que se denomina nucleosoma; los nucleosomas se hallan unidos entre sí mediante fibras de ADN. Se sigue, entonces, que la unidad básica de la estructura de la cromatina es el nucleosoma. Un nucleosoma típico está asociado a 200 pares de bases (pb) de ADN y está formado por una médula (core en inglés) y un ligador (o linker). La médula está formada por un octámero constituido por dos subunidades de las histonas H2A, H2B, H3 y H4. En otras palabras, se trata de un dímero: 2×(H2A, H2B, H3, H4). Los trabajos de Aaron Klug y colaboradores[18][19] sobre la disposición de las histonas en la médula del nucleosoma le valieron el Premio Nobel de Química en 1982.
Alrededor de la médula se enrolla el ADN (140 pb) dando casi dos vueltas (una vuelta y tres cuartos). El resto del ADN (60 pb) forma parte del ligador (linker), que interacciona con la histona H1. La cantidad de ADN asociado con un nucleosoma varía de una especie a otra, de 154 pb a 241 pb; esta variación se debe fundamentalmente a la cantidad de ADN asociada al ligador (linker).[14]
Las fibras de ADN dúplex desnudo tienen un grosor de 20 Å. La asociación del ADN con las histonas genera los nucleosomas, que muestran unos 100 Å de diámetro. A su vez, los nucleosomas se pueden enrollar helicoidalmente para formar un solenoide (una especie de muelle) que constituye las fibras de cromatina de los núcleos interfásicos con un diámetro aproximado de 300 Å. Los solenoides pueden volverse a enrollar para dar lugar a super-solenoides con un diámetro de 4000 Å a 6000 Å que constituirían las fibras de los cromosomas metafásicos.[18][20]
Proteínas cromosómicas no histónicas: el armazón proteico
[editar]Las proteínas cromosómicas no histónicas son proteínas diferentes de las histonas que se extraen de la cromatina de los núcleos con cloruro sódico (NaCl) 0.35 mol/L (disolución salina), tienen un alto contenido en aminoácidos básicos (25 % o más), alto contenido en aminoácidos ácidos (20-30 %), una elevada proporción de prolina (7 %), bajo contenido en aminoácidos hidrofóbicos y una alta movilidad electroforética. Las proteínas cromosómicas no histónicas que se extraen de la cromatina de los núcleos varían mucho dependiendo de la técnica de aislamiento empleada. Un grupo de estas proteínas cromosómicas no histónicas presentan alta movilidad electrofóretica y se denominan abreviadamente HMG (grupo de alta movilidad). La cantidad de proteínas no histónicas puede variar de unos tejidos a otros en el mismo individuo y dentro del mismo tejido a lo largo del desarrollo.
Proteínas HMG
[editar]Estas proteínas se agrupan en una superfamilia por sus similitudes físicas y químicas, y porque todas ellas actúan como elementos arquitectónicos que afectan múltiples procesos dependientes de ADN en el contexto de la cromatina. Todas las HMG tienen un terminal carboxilo rico en aminoácidos de tipo ácido, y se clasifican en tres familias (HMGA, HMGB y HMGN), cada una con un motivo funcional único, que induce cambios específicos en sus sitios de unión y participa en funciones celulares diferentes.[21]
La familia HMGA consta de cuatro miembros, y todos ellos contienen un motivo funcional característico, denominado «gancho AT» (AT hook). A través de estas secuencias, las HMGA se unen preferencialmente a secuencias ricas en AT de ADN en forma-B e inducen cambios de conformación que inducen la unión de componentes adicionales. Las proteínas HMGA tienen una cola C-terminal ácida, que podría ser importante para la interacción con otras proteínas. Tradicionalmente, este grupo se denominaba HMG-I/Y.[22]
La familia HMGB consta de tres variantes, cada una de las cuales contiene dos motivos funcionales (las cajas HMG) y un extremo C-terminal muy ácido. Las cajas HMG están formadas por tres α-hélices plegadas conjuntamente para formar una estructura en forma de L, que en parte se introduce en la hendidura menor del ADN, plegándolo intensamente. Existen ligeras diferencias entre las cajas HMG de las diferentes HMGB, lo que confiere especificidad a cada una de ellas. Las colas acídicas modulan la afinidad por una variedad de estructuras de ADN distorsionado.[21] Tradicionalmente estas proteínas se denominaban proteínas HMG-1/-2.[22]
La familia de proteínas HMGN se caracteriza por un dominio cargado positivamente, el dominio de unión a nucleosomas, y por una cola C-terminal ácida, el dominio de desplegado de la cromatina. Las proteínas HMGN se unen específicamente a los nucleosomas y alteran tanto la estructura local como la estructura de nivel superior de la cromatina.[21] Estas proteínas se conocen tradicionalmente como la subfamilia HMG-14/-17.[22]
Se han detectado más de 20 proteínas HMG; las proteínas HMG-1/-2 (HMGB) y HMG-14/-17 (HMGA) se han identificado en todas las especies de mamíferos, aves y peces estudiadas hasta el momento. Las proteínas HMG-1/-2 se encuentran solo en el núcleo, están implicadas en la replicación, se unen preferentemente a ADN de hélice sencilla, desenrollan el ADN dúplex y se estima que existe una molécula de HMG-1 o HMG-2 por cada 15 nucleosomas. Las proteínas HMG-14/-17 se encuentran en el núcleo y en el citoplasma, están relacionadas con la regulación de la transcripción y se estima que existe una molécula de HMG-14 o HMG-17 por cada 10 nucleosomas.
Armazón proteico de los cromosomas
[editar]
Muchos estudios citogenéticos muestran que el ADN está intensamente enrollado, en los cromosomas, cuando se observa al microscopio. El primer nivel de compactación lineal del ADN es el obtenido por el plegamiento de la fibra del ADN alrededor de los nucleosomas,[23] responsable del primer nivel de plegamiento lineal (de 6 a 7 veces). El siguiente nivel de plegamiento corresponde a la denominada «fibra de 30 nm», que es lo que se observa en núcleos en interfase. Aunque ha habido mucha controversia para describir esta estructura,[24] la fibra de 30 nm se considera normalmente como el enrollamiento helicoidal de las fibras de nucleosomas, que genera la compactación de otras 6-7 veces. En mitosis, la fibra de 30 nm debe compactarse otras 200-500 veces hasta alcanzar el diámetro observado al microscopio para las fibras cromosómicas durante la división celular (–700 nm).[25] Por tanto, se han tenido que producir nuevos superenrollamientos. Sin embargo, la explicación de estos plegamientos de orden superior ha generado gran controversia.[24]
Laemmli y colaboradores en 1977 consiguieron aislar cromosomas metafásicos desprovistos de histonas mediante un tratamiento con sulfato de dextrano y heparina.[26] Estos cromosomas metafásicos desprovistos de histonas presentan una médula central densamente teñida que ha sido denominada scaffold (armazón). Este armazón proteico (scaffold) es resistente a la acción de la ADNasa, ARNasa y también a soluciones de ClNa 2M. Sin embargo, desaparece por tratamientos con urea 4M y dodecil sulfato sódico o por tratamiento con enzimas proteolíticas. Por tanto, se trata de un armazón proteico.
La observación a microscopía electrónica pone de manifiesto que de este armazón proteico (scaffold) salen y llegan lazos o fibras que pueden hacerse desaparecer mediante tratamiento con ADNasa. Por tanto, estos lazos o dominios que arrancan del armazón proteico son lazos de ADN. Uno de los principales componentes del armazón proteico es la enzima topoisomerasa II α (topoIIα),[27][28] una enzima que produce cortes en el ADN dúplex a nivel de ambas hélices. La topoisomerasa II (girasa) interviene durante la replicación del ADN creando o relajando los superenrollamientos. En mamíferos se encuentran dos isoformas de esta enzima (α y ß), con propiedades similares in vitro. Sin embargo, aunque topoIIα y β se comportan in vivo de forma similar en interfase, en mitosis tienen un comportamiento diferente: solo topoIIα está asociado mayoritariamente a los cromosomas.[29] La aparición de la topoisomerasa II α solo en el armazón proteico sugiere que se encuentra en la base de los lazos o dominios de ADN, indicando que esta organización en dominios podría estar relacionada con la replicación y transcripción. Otras enzimas, como la topoisomerasa I que produce cortes en el ADN dúplex a nivel de una sola hélice y la HMG-17, se encuentran solo en los lazos o dominios y no en el armazón proteico. La evidencia existente hasta el momento sugiere que las fibras de solenoides (30 nm) formarían los lazos o dominios que emanan del armazón proteico y que este armazón estaría a su vez enrollado formando una espiral.[26]
Además de la enzima topoisomerasa II α, el otro componente fundamental propuesto del armazón proteico es la condensina 13S.[30] La tinción doble con anticuerpos contra topoIIα y condensina genera un armazón con aspecto de un «polo de barbero» (un cilindro con bandas espirales rojas y blancas que simboliza la antigua doble profesión de los barberos como cirujanos), en la cual alternan «cuentas» enriquecidas en topoIIα y en condensina. Esta estructura parece estar generada por dos cadenas yuxtapuestas. Parece ser que el ensamblaje de este armazón proteico tiene lugar en dos fases, ya que la condensina solo se asocia en la transición de profase a metafase durante la mitosis. Sin embargo, el papel estructural de la topoIIα en la organización de los cromosomas aún se discute, ya que otros grupos argumentan que esta enzima se intercambia rápidamente tanto en los brazos cromosómicos como en los cinetocoros durante la mitosis.[31][29]
Los dominios de ADN parecen estar unidos al armazón proteico por unas regiones específicas denominadas abreviadamente SAR (scaffold associated regions, también denominadas MAR, matrix attachment regions) que se detectan cuando los cromosomas metafásicos desprovistos de histonas se tratan con endonucleasas de restricción.[32] Después de este tratamiento quedan regiones de ADN unidas al armazón que a su vez resisten la digestión con exonucleasas gracias a que están protegidas por una proteína. Cuando se digiere esta proteína, las regiones de ADN protegidas contienen secuencias de varios cientos de pares de bases que son muy ricas en AT y que presentan sitios de unión para topoisomerasa II e histona H1. Estas regiones de unión específicas de los dominios al armazón proteico, son las regiones SAR. Se ha sugerido que estas regiones actúan un papel global durante la condensación de los cromosomas mitóticos y son necesarias para el mantenimiento de la estructura de los cromosomas.[33] Las regiones SAR también podrían estar implicadas en la expresión génica, al facilitar tanto la transición como la expansión de una estructura abierta de la cromatina.
Modelos alternativos de la estructura cromosómica
[editar]Es cada vez más evidente que incluso con los métodos de fijación más utilizados[29] se pueden producir cambios significativos en la localización de las proteínas cromosómicas, y estas dificultades técnicas han estado presentes en la mayor parte de las preparaciones cromosómicas utilizadas para realizar los estudios estructurales. Por ello, parece necesario utilizar muestras vivas siempre que sea posible, así como aproximaciones alternativas que permitan un análisis complementario.[34]
Aproximación biofísica
[editar]Un modo alternativo para el análisis estructural de los cromosomas es el biofísico. Las medidas precisas de la rigidez y la elasticidad de los cromosomas pueden guiar la construcción de los modelos estructurales. Estudios realizados en diferentes laboratorios indican que los cromosomas presentan una elasticidad remarcable: tanto dentro de las células como en tampones fisiológicos, los cromosomas pueden estirarse hasta varias veces su longitud normal y volver de nuevo a su longitud original.[35] Sin embargo, los datos obtenidos por diferentes laboratorios son muy variables, probablemente debido a la variedad de tampones utilizado por los distintos grupos. Un estudio de Poirier y Marko en 2002 mostró que la elasticidad de los cromosomas es muy sensible a nucleasa.[36] Estos datos sugieren que la integridad mecánica de los cromosomas mitóticos se mantiene por enlaces entre las fibras cromosómicas, no por la existencia de un armazón proteico. La naturaleza de estos enlaces no está clara, pero este estudio estima su frecuencia en 10-20 kb como mínimo.
Componentes bioquímicos de los cromosomas
[editar]Un método convencional y muy potente para entender una estructura biológica consiste en establecer una lista que incluya todos sus componentes. Los estudios iniciales de la estructura cromosómica se enfrentaron a muchos problemas técnicos para conseguir aislar bioquímicamente los cromosomas mitóticos de las células, aunque métodos sofisticados permitieron el aislamiento de los cromosomas completos y la identificación del armazón proteico.[37]
Un método alternativo consiste en la utilización de extractos libres de células procedentes de huevos de anfibios. Este sistema permite la reconstitución in vitro de cromosomas mitóticos a partir de sustratos simples (por ejemplo, cromatina de esperma) en condiciones fisiológicas, de manera que los componentes proteicos de las estructuras que se ensamblan pueden aislarse por centrifugación en un solo paso y caracterizarse de forma sistemática.[38] Además de las histonas centrales y una histona de ligamiento, la fracción así aislada contiene topoIIα (CAP-B en ese estudio), un complejo de cinco subunidades denominado condensina (CAP-C, -E, -D2, -G y -H),[38][39] cromokinesina (CAP-D/Klp1[40]) y la ATPasa remodeladora de cromatina ISWI[40] (CAP-F). Una de las conclusiones más importantes de estos estudios es que las ATPasas son componentes importantes de los cromosomas. La energía de hidrólisis del ATP es utilizada en muchos casos para inducir cambios locales o globales en los cromosomas, mientras que en otros casos sirve para soportar el movimiento de los cromosomas anclados a los microtúbulos.
Una observación sorprendente fue la identificación de la proteína titina como uno de los componentes de los cromosomas en embriones de Drosophila.[41] La titina es una proteína filamentosa gigante (–3 MDa) que funciona como un componente integral del filamento grueso en el sarcómero de las células musculares. Se ha propuesto que, en analogía con su función muscular, la isoforma de la titina que se encuentra en los cromosomas puede funcionar por un lado como una «regla molecular» que determina la longitud cromosómica, y por otro como un «muelle molecular» que proporciona elasticidad a los cromosomas.[42]
ARN
[editar]El ARN parece jugar algún papel en el plegamiento del cromosoma eucariótico. Al menos en humanos y en Drosophila se han encontrado evidencias de este papel estructural del ARN.[43] Sin embargo, hay que tener en cuenta que el armazón proteico descrito por Laemmli y colaboradores (1978) no se ve afectado por el tratamiento con ARNasa. Podría ser que las propias proteínas del armazón protegieran al ARN de la acción del ARNasa. En cualquier caso, es conveniente recordar que el ADN del cromosoma bacteriano también está organizado en dominios y que el ARN podría jugar algún papel en el mantenimiento de dicha estructura. En organismos con características intermedias entre las de procariontes y eucariontes como los dinoflagelados, también existen datos que apoyan el papel estructural del ARN en la organización cromosómica.
Tipos de cromatina
[editar]La cromatina (la sustancia que compone los núcleos de las células y que resulta de la interacción del ADN con las proteínas histónicas, no histónicas y ARN) puede presentar distintos grados de empaquetamiento o contracción. Cuando los cromosomas se tiñen con sustancias químicas que se unen al ADN aparecen regiones densamente teñidas y regiones menos densamente teñidas. La cromatina mayoritaria, la que constituye la mayor parte del núcleo recibe el nombre de eucromatina y la minoritaria el de heterocromatina. Mientras que la eucromatina representa la fracción que contiene la mayor parte de los genes activos, la heterocromatina interviene en varios procesos nucleares, como la función centromérica, el silenciamiento de genes y la organización nuclear.
La heterocromatina puede aparecer más densamente teñida que la eucromatina (heteropicnosis positiva) o menos densamente teñida que la eucromatina (heteropicnosis negativa). La aplicación de determinados tratamientos experimentales en combinación con diferentes tipos de tinción de los cromosomas, puede producir la aparición de zonas heterocromáticas en los cromosomas de muchas especies. Estas zonas heterocromáticas presentan una distribución característica o patrón de bandas típico de cada cromosoma, que permite identificar cromosomas distintos. Estas técnicas reciben el nombre de "técnicas de bandeo cromosómico" y son enormemente útiles en la identificación individual de los cromosomas y en la construcción de cariotipos.
Diferencias entre eucromatina y heterocromatina
[editar]- Diferencias genéticas: los experimentos de construcción de mapas demuestran que la mayor parte de los genes activos se localizan en la eucromatina. En los núcleos interfásicos, la eucromatina se tiñe menos densamente debido al menor grado de empaquetamiento, y en general se acepta que este es el estado más compatible con la actividad génica y la transcripción. La heterocromatina se encuentra en muchos organismos flanqueando las regiones centroméricas, algunas veces también se encuentra en regiones teloméricas, y en algunos casos se ha observado la existencia de cromosomas completos heterocromáticos (por ejemplo, el cromosoma Y de Drosophila melanogaster). Se han detectado muy pocos genes activos en la heterocromatina.[44] Por ejemplo, en Drosophila existen mutaciones letales en genes que se localizan en regiones heterocromáticas; por tanto estos genes deben poseer alguna actividad. En cualquier caso, el porcentaje de genes activos localizados en regiones heterocromáticas es muy bajo, comparado con el de genes activos situados en la eucromatina. La principal diferencia entre la eucromatina y la heterocromatina radica por tanto en la actividad de estos dos tipos de cromatina. Estudios tempranos de la heterocromatina condujeron al descubrimiento del fenómeno conocido como «variegación por efecto de la posición» (PEV, por sus siglas en inglés),[45] en el cual si un gen eucromático se coloca cerca o dentro de una región heterocromática, deviene silenciado de forma epigenética. Este proceso tiene importantes implicaciones en la regulación génica, el envejecimiento y la progresión tumoral.
- Diferencias citológicas: a nivel estructural, en los núcleos interfásicos, existe un mayor grado de enrollamiento o empaquetamiento en la heterocromatina que en la eucromatina.[46] Esto se demuestra porque la heterocromatina presenta una sensibilidad reducida al tratamiento con nucleasas, lo cual refleja un posicionamiento de los nucleosomas a intervalos cortos y regulares.
- Diferencias bioquímicas: la heterocromatina presenta modificaciones características en las histonas, como un alto grado de metilación en la lisina 9 de la histona H3 (H3K9) y en la lisina 27 (H3K27), combinado con una carencia de acetilación. La heterocromatina también se caracteriza por la presencia de la proteína HP1 (heterochromatin protein 1). Además, la heterocromatina de vertebrados y plantas presenta un elevado grado de metilación en las islas CpG (regiones genómicas ricas en dinucleótidos C+G).[47] La metilación de H3K9 conlleva el reclutamiento de más enzimas que transfieren grupos metilo a las histonas (HMT, histona metiltransferasa), mediado por HP1. Se han descrito dos rutas diferentes para llevar a cabo este proceso. Una de estas rutas utiliza ARN interferente,[48] mientras que la segunda utiliza proteínas de unión a ADN que reconocen secuencias específicas para dirigir las HMT.[48]
- Alociclia: la heterocromatina sigue un ciclo de condensación y descondensación distinto a la eucromatina. La heterocromatina puede aparecer más intensamente teñida que la eucromatina o menos intensamente teñida dependiendo del estado celular (alociclia). La alociclia a su vez está relacionada con la replicación del ADN. La heterocromatina se replica más tarde que la eucromatina.
Tipos de heterocromatina
[editar]Se pueden distinguir dos clases de heterocromatina:
- Heterocromatina constitutiva: cromatina que aparece siempre más intensamente teñida que la eucromatina (heteropicnosis positiva), o menos intensamente teñida que la eucromatina (heteropicnosis negativa), independientemente del estado de desarrollo o fisiológico. HP1 es esencial para la formación de la heterocromatina constitutiva, que se caracteriza por la presencia de H3K9-trimetilada, mediada por las HMT denominadas Suv39h1 y Suv39h2.[49] En este grupo se incluyen el ADN satélite de las regiones centroméricas y la cromatina de los telómeros.
- Heterocromatina facultativa: cromatina que aparece más intensamente teñida que la eucromatina, o menos intensamente teñida que la eucromatina dependiendo del estado fisiológico o del momento de desarrollo. El cromosoma X, en algunas especies animales, como el saltamontes Schistocerca gregaria, aparece más intensamente teñido que el resto de los cromosomas durante la diplotena de la profase I de meiosis. La heterocromatina facultativa se genera de manera diferente a la constitutiva, posiblemente mediada por HMT diferentes (como G9a, ESET/SETDB1 y/o ErHMTasa1), y parece ser que presenta sobre todo H3K9-mono y dimetilada.[47]
En la especie humana, todos los cromosomas X que están en exceso de uno aparecen más intensamente teñido que el resto de los cromosomas (heteropicnosis positiva) en los núcleos de células en interfase. Por tanto, las mujeres normales que tienen dos cromosomas X, tienen un cromosoma X que aparece más intensamente teñido y que está inactivado. Sin embargo, durante las primeras etapas del desarrollo embrionario (durante los 16 primeros días de gestación en la especie humana) ambos cromosomas X son activos.
En algunas especies eucariontes, el ADN satélite o ADN minoritario que presenta un contenido en G+C distinto al ADN principal o mayoritario, está constituido por unas secuencias cortas de ADN que están repetidas millones de veces. En concreto en ratón se ha demostrado que el ADN satélite está localizado en la zona centrómerica. Este ADN satélite constituye un ejemplo de heterocromatina constitutiva cuya presencia y acción es constante en el cromosoma.[50][51]
Elementos diferenciados en la estructura cromosómica
[editar]La organización de la cromatina no es uniforme a lo largo de la estructura del cromosoma. De hecho, se pueden distinguir una serie de elementos diferenciados: los centrómeros (o constricciones primarias), los telómeros (o extremos cromosómicos), las regiones organizadoras del nucléolo (NORs según la abreviatura en inglés) y los cromómeros, todos ellos caracterizados por contener secuencias específicas de ADN.
Centrómeros
[editar]El centrómero es la constricción primaria que utilizando tinciones tradicionales aparece menos teñida que el resto del cromosoma. Es la zona por la que el cromosoma interacciona con las fibras del huso acromático desde profase hasta anafase, tanto en mitosis como en meiosis, y es responsable de realizar y regular los movimientos cromosómicos que tienen lugar durante estas fases. Las estructuras centroméricas que interaccionan con las fibras del huso se denominan cinetocoros. Además, el centrómero contribuye a la nucleación de la cohesión de las cromátidas hermanas. En la estructura del centrómero intervienen tanto el ADN centromérico, que consta fundamentalmente de heterocromatina constitutiva, como proteínas centroméricas.
En la levadura de gemación (Saccharomyces cerevisiae) el ADN centromérico consta únicamente de 125 pb y está conservado entre los diferentes cromosomas.[52] Sin embargo, el ADN centromérico en metazoos puede constar de megabases, y no contiene secuencias consenso fácilmente identificables (ver la revisión de Choo en 1997[53]). A pesar de las diferencias entre el ADN centromérico de levaduras y metazoos, el cinetocoro se ensambla en ambos casos sobre nucleosomas centroméricos que contienen una forma especializada de histona H3 (Cse4p en levaduras[54] o su homólogo CENP-A en metazoos).
Telómeros
[editar]
La palabra «telómero» procede del griego telos, «final» y meros, «parte». Los telómeros son los extremos de los cromosomas. Son regiones de ADN no codificante, altamente repetitivas, cuya función principal es la estabilidad estructural de los cromosomas en las células eucariotas, la división celular y el tiempo de vida de las estirpes celulares. Además están involucradas en enfermedades tan importantes como el cáncer. En los organismos procariotas, los cromosomas son circulares y no poseen telómeros.[55]
Los telómeros fueron descubiertos por Hermann Joseph Muller durante la década de 1930. Desde entonces, se ha avanzado mucho en el conocimiento de los telómeros, gracias a las técnicas de la genética molecular.
| Grupo | Organismo | Secuencia del telómero (Dirección 5'a 3' hasta el fin) |
|---|---|---|
| Vertebrados | Humanos, ratón, Xenopus, Danio rerio | TTAGGG |
| Hongos filamentosos | Neurospora crassa | TTAGGG |
| Mohos del fango | Physarum, Didymium Dictyostelium | TTAGGG AG(1-8) |
| Protozoos cinetoplástidos | Trypanosoma, Crithidia | TTAGGG |
| Protozoos ciliados | Tetrahymena, Glaucoma Paramecium Oxytricha, Stylonychia, Euplotes | TTGGGG TTGGG(T/G) TTTTGGGG |
| Protozoos apicomplexa | Plasmodium | TTAGGG(T/C) |
| Plantas superiores | Arabidopsis thaliana | TTTAGGG |
| Algas verdes | Chlamydomonas | TTTTAGGG |
| Insectos | Bombyx mori | TTAGG |
| Ascáridos | Ascaris lumbricoides | TTAGGC |
| Levaduras aisladas | Schizosaccharomyces pombe | TTAC (A)(C) G(1-8) |
| Levaduras agregadas | Saccharomyces cerevisiae Candida glabrata | TGTGGGTGTGGTG (de copias de ARN) o G(2-3)(TG)(1-6)T (consenso) |
Regiones organizadoras del nucléolo
[editar]Además de las constricciones primarias, en algunos cromosomas se puede distinguir otro tipo de «adelgazamiento» denominada constricción secundaria, las que se hallan relacionadas normalmente con la presencia de las secuencias de ADN ribosómico. Tales regiones se denominan regiones organizadoras del nucléolo (o, sencillamente, NOR por el acrónimo en inglés para nucleolus organizer regions). Las secuencias de ADN ribosómico quedan englobadas dentro del nucléolo, que permanece adosado a las NOR durante buena parte del ciclo celular. Los cromosomas portadores de NOR en muchos casos presentan un segmento que une a esta región con el telómero, el cual se denomina satélite o trabante.[56]
Cromómeros
[editar]Los cromómeros son «engrosamientos» o regiones más compactadas de la eucromatina, que se distribuyen de manera más o menos uniforme a lo largo de los cromosomas y se pueden visualizar durante las fases de la mitosis o de la meiosis de menor condensación de la cromatina (profase). Su naturaleza molecular sigue siendo controvertida, pero podrían ser consecuencia de un cierto grado de compartimentalización en la distribución de las secuencias de ADN y en la organización de los cromosomas. Desde hace varios años, el grupo de Giorgio Bernardi en Italia, sostiene que hay una distribución compartimentalizada de secuencias relativamente grandes de ADN (llamadas «isócoras») en el genoma de los vertebrados de sangre caliente, de modo tal que cada isócora tiene un contenido en bases (porcentaje de C+G) relativamente homogéneo pero diferente al de las demás.[57][58][59][60] Después de publicado el primer borrador del Proyecto Genoma Humano, parece confirmarse la existencia de cinco isócoras en el genoma de los humanos, dos de ellas ricas en A y T, y tres ricas en G y C. La distribución alternante de ambos tipos de isócoras podría ser la explicación molecular de la existencia de cromómeros.[61][62]
Estructura externa de los cromosomas: número, forma y tamaño
[editar]El estudio de la estructura externa de los cromosomas de cualquier especie eucariótica consiste en analizar la forma, tamaño y número de los cromosomas que posee. El mejor momento para llevar a cabo dicho estudio suele ser aquel en el que los cromosomas han alcanzado su máximo grado de contracción y tienen sus bordes perfectamente definidos. Dicho momento suele ser la metafase mitótica. El estudio de la estructura externa de los cromosomas culmina con la obtención del cariotipo.[2]
Los cromosomas se pueden estudiar en distintos momentos según la especie y dependiendo de los objetivos planteados. Algunas especies tienen cromosomas que se pueden observar con gran detalle en interfase, tal es el caso de Drosophila melanogaster, que posee cromosomas politénicos gigantes que se observan en las glándulas salivales de dicho insecto, y el de Chironomus tentans, otro díptero. El cariotipo se confecciona usualmente después de un apropiado pre-tratamiento y tinción de las células, para hacer más visibles los cromosomas individuales. Al diagrama simplificado de los cromosomas metafásicos del cariotipo se lo denomina idiograma, que se construye con el número genómico.
Para realizar el ordenamiento de los cromosomas tanto en cariotipos como idiogramas se debe tener en cuenta el tamaño cromosómico (ubicados de mayor a menor, con el brazo corto «bc» o «p» hacia arriba y el brazo largo «bl» o «q» hacia abajo); posición del centrómero (generalmente alineados) y presencia de constricciones secundarias y satélites.[2]
Constancia del número de cromosomas
[editar]| Especie | Número de cromosomas |
|---|---|
| Hormiga Myrmecia pilosula, macho | 1 |
| Hormiga Myrmecia pilosula, hembra | 2 |
| Mosca de la fruta (Drosophila melanogaster) | 8 |
| Centeno (Secale cereale) | 14 |
| Caracol (Helix) | 24 |
| Gato (Felis silvestris catus) | 38 |
| Cerdo (Sus scrofa) | 38 |
| Ratón (Mus musculus) | 40 |
| Trigo (Triticum aestivum) | 42 |
| Rata (Rattus rattus) | 42 |
| Conejo (Oryctolagus cuniculus) | 44 |
| Liebre (Lepus europaeus) | 46 |
| Humano (Homo sapiens sapiens) | 46 |
| Chimpancé (Pan troglodytes) | 48 |
| Patata, Papa (Solanum tuberosum) | 48 |
| Oveja (Ovis aries) | 54 |
| Vaca (Bos taurus) | 60 |
| Asno (Equus asinus) | 62 |
| Mula (Equus mulus) | 63 (estéril) |
| Caballo (Equus caballus) | 64 |
| Camello ( Camelus bactrianus) | 74 |
| Llama (Lama glama) | 74 |
| Perro (Canis lupus familiaris) | 78 |
| Gallina (Gallus gallus) | 78 |
| Paloma Columbia livia | 80 |
| Diamante mandarín (Taeniopygia guttata) | 72[63] |
| Pez Carassius auratus | 94 |
| Equisetum arvense Equisetum arvense | 216 |
| Mariposa | 380 |
| Helecho Ophioglussum reticulatum | 1260 |
| Protozoario Aulacantha scolymantha | 1600 |
Usualmente las especies animales y vegetales tienen un número de cromosomas constante y determinado que constituyen su cariotipo (ley de la constancia numérica de los cromosomas), aunque existen especies con una alta variabilidad cariotípica, no solo en número sino en forma y tamaño de los cromosomas.

El número de cromosomas de una especie (o fase vital) diploide se identifica como 2n mientras que ese número en una especie (o fase vital) haploide se identifica con la letra n. En aquellas especies que presentan un número repetido de cromosomas superior a dos complementos se habla de poliploidía, representándose el múltiplo por delante de la letra n. Así: 3n indicaría un complemento cromosómico triploide, 4n un tetraploide, etc. Todas estas son situaciones de euploidía. Con la indicación x se quiere expresar el número básico de cromosomas de una especie que presenta individuos con diversos grados de ploidía o el de una línea filogenética a partir de la cual diversos taxones han alcanzado situaciones aneuploides variadas, siendo en este caso el número cromosómico una variación del número original con aumento o disminución del número básico, por pérdida, fusión o división de cromosomas (p. ej., n+1 o n-1). Un ejemplo de esta situación anormal la tenemos en los individuos de la especie humana que presentan el llamado síndrome de Down, situación de aneuploidía (2n=47) por la presencia de un ejemplar más de lo habitual del cromosoma 21 (trisomía).
El número de cromosomas 2n varía mucho de unas especies a otras y no existe relación entre el número de cromosomas y la complejidad de los mismos: existen especies vegetales con pocos cromosomas como Haplopappus gracilis (2n=4), Crepis capillaris (2n=6) y Secale cereale (2n=14), especies vegetales con bastantes cromosomas como Triticum aestivum (2n=42) y especies vegetales con muchos cromosomas como Ophioglossum petiolatum (n >500). En animales sucede algo semejante, hay especies con pocos cromosomas como la hormiga australiana Myrmecia pilosula cuyos machos tienen un cromosoma (2n=1) y las hembras dos cromosomas (2n=2), especies con bastantes cromosomas como la humana Homo sapiens (2n=46) y especies con muchos cromosomas como el lepidóptero Lysandra atlantica (2n=434-466). No existe ninguna relación entre el número de cromosomas 2n y la complejidad evolutiva, ni entre el número de cromosomas y la cantidad de ADN. Un ejemplo claro de esta situación es el de los ciervos del género Muntiacus en el que hay especies muy similares (denominadas especies gemelas) una con 2n=6 (M. muntjak) y otra con 2n=46 (M. reevesi).[65][66]
Cromosomas sexuales
[editar]En muchos organismos, uno de los pares de los cromosomas homólogos es distinto al resto, realizando la determinación del sexo del individuo. A estos cromosomas se les llama cromosomas sexuales o heterocromosomas e incluso gonosomas, porque determinan el sexo.
- Sistema de determinación XY: es propio del ser humano y muchos otros animales. Las hembras, siendo XX, darán gametos iguales con cromosoma X, sexo homogamético y los machos, siendo XY, darán dos tipos de gametos, uno con el cromosoma X y otro con el cromosoma Y. La probabilidad de que en la fecundación, al unirse los gametos, resulte una combinación XX (hembra) o XY (macho) es aproximadamente del 50 %.
- Sistema de determinación ZW: en otras especies (p. ej. mariposas y aves) ocurre lo contrario, el sexo masculino es homogamético (ZZ) y el femenino heterogamético (ZW).
- Sistema de determinación XO: En otras especies (peces, insectos, anfibios, etc) que no tienen el cromosoma Y, determinándose el sexo por el número de cromosomas X, macho XO y hembra XX.
Forma de los cromosomas
[editar]


La forma de los cromosomas es para todas las células somáticas constante y característica de cada especie. La forma depende fundamentalmente de las constricciones que presente el cromosoma y de su localización en la cromátida.
El cromosoma se encuentra constituido básicamente por el centrómero que divide el cromosoma en un brazo corto o brazo p y un brazo largo o brazo q. Algunos cromosomas presentan satélites en el brazo corto.
El brazo “p” es el brazo menor. Esta nomenclatura viene del primer trabajo sobre cromosomas que se publicó en francés y el brazo corto se llamó “petite”, es decir pequeño, y de ahí que se adaptara para el mismo la letra “p”.[67]
Según la posición del centrómero, los cromosomas se clasifican en:
- Metacéntricos
- El centrómero se localiza a mitad del cromosoma y los dos brazos presentan igual longitud.
- Submetacéntricos
- La longitud de un brazo del cromosoma es algo mayor que la del otro.
- Acrocéntricos
- Un brazo es muy corto (p) y el otro largo (q).
- Telocéntricos
- Solo se aprecia un brazo del cromosoma al estar el centrómero en el extremo.
El par de gonosomas o sexocromosomas se constituyen por un cromosoma X (submetacéntrico mediano) y un cromosoama Y considerado acrocéntrico sin satélites, aunque en algunas revisiones de la literatura se le refiere como submetacéntrico.
Tamaño cromosómico
[editar]Los cromosomas sufren grandes variaciones en su tamaño a lo largo del ciclo celular, pasando de estar muy poco compactados (interfase) a estar muy compactados (metafase), por tal motivo, los estudios sobre el tamaño suelen realizarse en metafase mitótica. Además, es necesario tener en cuenta que los tratamientos para teñir los cromosomas y para obtener las metafases mitóticas influyen de manera muy importante en el tamaño de los cromosomas. En cualquier caso, en general es posible decir que hay especies eucarióticas con cromosomas grandes y especies con cromosomas pequeños. Las monocotiledóneas (vegetales) y los anfibios y ortópteros (animales) poseen cromosomas muy largos (de 10 a 20 micras). Las dicotiledóneas, las algas, los hongos y la mayoría de las especies animales poseen cromosomas pequeños (longitud inferior a 5 micras). Naturalmente, existen algunas excepciones en los ejemplos citados. El cromosoma 1 humano tiene 0,235 pg de ADN, que equivalen a una longitud total de ADN doble hélice de 7,3 cm y en metafase mitótica presenta una longitud aproximada de 0,001 cm.
Bandeo cromosómico
[editar]En algunas especies los pares cromosómicos no pueden diferenciarse claramente considerando solo sus componentes distintivos en sentido longitudinal; en estos casos se debe recurrir a técnicas citológicas especiales para la tinción de los cromosomas, que evidencian «bandas» transversales (oscuras y claras) a lo largo de los mismos, y que corresponden a los distintos tipos de cromatina. En una especie dada, estas variantes de la cromatina presentan un tamaño y disposición constante.[68]
Las técnicas de bandeo cromosómico más usadas son:
- Bandeo C: es relativamente sencilla, y se basa en el uso del colorante Giemsa que tiñe regiones con heterocromatina constitutiva, que en vegetales se halla localizada principalmente en regiones teloméricas, mientras que en animales, se encuentra en regiones centroméricas.
- Bandeos G, R, Q: son técnicas basadas en tratamientos enzimáticos que ponen de manifiesto distintos patrones de bandas de la eucromatina a lo largo del cromosoma. El material se tiñe con colorante Giemsa (G, R) o colorantes fluorescentes, como la quinacrina (Q). Son las bandas más estudiadas en animales y en el hombre. En los vegetales son muy difíciles de obtener por el alto grado de empaquetamiento de los cromosomas metafásicos.
- Bandeo NOR: permite identificar cromatina con secuencias medianamente repetidas de ADNr, asociada a las regiones NOR del cromosoma. El número total y localización de las regiones NOR es variable, por lo cual, como ya se expresó, además de su importancia funcional tiene valor cariotípico.[2]
Cromosomas humanos
[editar]El ser humano presenta 23 pares de cromosomas en sus células somáticas: 22 autosomas y un par de cromosomas sexuales (dos X en el caso de las mujeres y un cromosoma X y un Y en el caso de los varones). El tamaño total aproximado del genoma humano es de 3 200 millones de pares de bases de ADN (3 200 Mb) que contienen unos 20 000-25 000 genes.[69] De las 3 200 Mb unas 2 950 Mb corresponden a eucromatina y unas 250 Mb a heterocromatina. El Proyecto Genoma Humano produjo una secuencia de referencia del genoma humano eucromático, usado en todo el mundo en las ciencias biomédicas.
La secuencia de ADN que conforma el genoma humano contiene codificada la información necesaria para la expresión, altamente coordinada y adaptable al ambiente, del proteoma humano, es decir, del conjunto de proteínas del ser humano. El genoma humano presenta una densidad de genes muy inferior a la que inicialmente se había predicho, con solo en torno al 1,5 %[70] de su longitud compuesta por exones codificantes de proteínas. Un 70 % está compuesto por ADN extragénico y un 30 % por secuencias relacionadas con genes. Del total de ADN extragénico, aproximadamente un 70 % corresponde a repeticiones dispersas, de manera que, más o menos, la mitad del genoma humano corresponde a secuencias repetitivas de ADN. Por su parte, del total de ADN relacionado con genes se estima que el 95 % corresponde a ADN no codificante: pseudogenes, fragmentos de genes, intrones, secuencias UTR, entre otras. Aunque tradicionalmente esas secuencias de ADN han sido consideradas regiones del cromosoma sin función, hay datos que demuestran que esas regiones desarrollan funciones relacionadas con la regulación de la expresión génica.
En la siguiente tabla se listan los cromosomas humanos, el número de genes codificantes conocidos que presenta cada uno, su tamaño en pares de bases y su morfología.
| Cromosoma | Genes | Bases | Formato |
|---|---|---|---|
| 1 | 4.222 | 247.199.719[71] | metacéntrico, grande. |
| 2 | 2.613 | 242.751.149[72] | submetacéntrico, grande. |
| 3 | 1.859 | 199.446.827[73] | metacéntrico, grande. |
| 4 | 451 | 191.263.063[74] | submetacéntrico, grande. |
| 5 | 617 | 180.837.866[75] | submetacéntrico, grande. |
| 6 | 2.280 | 170.896.993[76] | submetacéntrico, mediano. |
| 7 | 2.758 | 158.821.424[77] | submetacéntrico, mediano. |
| 8 | 1.288 | 146.274.826[78] | submetacéntrico, mediano. |
| 9 | 1.924 | 140.442.298[79] | submetacéntrico, mediano. |
| 10 | 1.793 | 131.624.737[80] | submetacéntrico, mediano. |
| 11 | 449 | 131.130.853[81] | submetacéntrico, mediano. |
| 12 | 1562 | 132.289.534[82] | submetacéntrico, mediano. |
| 13 | 924 | 114.127.980[83] | acrocéntrico, mediano, con satélite en su brazo corto. |
| 14 | 1.803 | 106.360.585[84] | acrocéntrico, mediano, con satélite en su brazo corto. |
| 15 | 1122 | 100.114.055[85] | acrocéntrico, mediano, con satélite en su brazo corto. |
| 16 | 1098 | 88.822.254[86] | submetacéntrico, pequeño. |
| 17 | 1576 | 78.654.742[87] | submetacéntrico, pequeño. |
| 18 | 766 | 76.117.153[88] | submetacéntrico, pequeño. |
| 19 | 1859 | 63.806.651[89] | metacéntrico, pequeño. |
| 20 | 1012 | 62.436.224[90] | metacéntrico, pequeño. |
| 21 | 582 | 46.944.323[91] | acrocéntrico, pequeño. |
| 22 | 1816 | 49.528.953[92] | acrocéntrico, pequeño. |
| X | 1850 | 154.913.754[93] | submetacéntrico, mediano. |
| Y | 454 | 57.741.652[94] | acrocéntrico, pequeño. |
Técnica de estudio
[editar]Es posible visualizar los cromosomas por medio de la microscopía óptico y de tinciones especiales. El proceso para obtener el material cromosómico se realiza en diversos pasos, que incluyen la obtención de una muestra viva, la siembra e incubación de la misma y la posterior tinción y lectura.[N 1]
Tipos especiales de cromosomas
[editar]Existen algunos tipos de cromosomas presentes solo en algunos tipos celulares o en poblaciones concretas de una especie. Entre ellos, destacan los cromosomas politénicos, en escobilla, cromosomas B e isocromosomas.
Cromosomas politénicos
[editar]

Las células de las glándulas salivares de los insectos del orden de los Dípteros presentan núcleos que se hallan en una interfase permanente. Durante el crecimiento y desarrollo de las larvas de estos insectos, la división celular se detiene en algunos tejidos pero las células continúan su crecimiento por incremento de volumen. Este proceso ocurre, por ejemplo, en los tubos de Malpighi, en las células nutricias de los ovarios, en el epitelio intestinal y en las células de las glándulas salivares. En las células de tejidos mencionados, los cromosomas sufren rondas repetidas de duplicaciones pero sin separarse, proceso conocido como endomitosis. Esto lleva a la producción de cromosomas constituidos por varios cientos o aun miles de hebras. Durante este proceso de politenización o politenia, los cromosomas incrementan tanto su longitud como su diámetro. De hecho, la longitud de los cromosomas de Drosophila en una metafase es del orden de 7,5 μm mientras que el largo total de los cromosomas en un núcleo de las glándulas salivares es de alrededor de 2000 μm.[56][96]
Además del cambio en el tamaño, los cromosomas politénicos presentan otras dos características. En primer lugar, los cromosomas homólogos están asociados entre sí en toda su extensión. Esta condición, denominada apareamiento somático es propia de la mitosis de la mayoría de los Dípteros.[97] La otra característica peculiar es que los cromosomas muestran un patrón particular de bandeo transversal que consiste en zonas más oscuras, llamadas bandas, que alternan con zonas claras, llamadas interbandas. Cuando se observan al microscopio óptico se identifican como bandas oscuras y claras transversales alternantes.[98] Aunque la mayoría de las bandas son continuas a través del cromosoma, otras aparecen como una serie de puntos. Este bandeo es reproducible de núcleo a núcleo, formando un patrón constante de tal manera que los cromosomas pueden ser identificados y mapeados en toda su longitud. Hay aproximadamente 5000 bandas y 5000 interbandas en total en el genoma de Drosophila melanogaster. Debido a que el patrón de bandeo que presentan los cromosomas politénicos es un reflejo constante de las secuencias de ADN, las bandas sirven como marcadores para localizar varias características genéticas (lugar de los genes, o cambios en el genoma debido a reordenamientos cromosómicos, por ejemplo deleciones, duplicaciones de bandas y translocaciones)[99][100] y se han utilizado en diversos estudios genéticos y evolutivos.[101][102][103][104][105]
En D. melanogaster el patrón de bandeo no se distingue en aquellas regiones heterocromáticas presentes en región centromérica de todos sus cromosomas (n=4). Las regiones heterocromáticas están asociadas formando un cromocentro. Ya que dos miembros del complemento haploide de esta especie son metacéntricos (los cromosomas II y III) y dos son acrocéntricos (cromosoma sexual X o Y y el cromosoma IV), los cromosomas politénicos en esta especie aparecen como cinco brazos desiguales que irradian del cromocentro: un brazo correspondiente al cromosoma X, los dos brazos del cromosoma II y los dos brazos del cromosoma III (3L y 3R). En algunos casos se puede visualizar un sexto brazo muy pequeño que representa el cromosoma IV.[56]
Cromosomas en escobilla
[editar]
Los cromosomas en escobilla (también llamados cromosomas plumosos), observados por primera vez por Walther Flemming en 1882 en oocitos de salamandra (Ambystoma mexicanum),[107] son uno de los tipos de cromosomas más grandes y se hallan en los oocitos de la mayoría de los animales, exceptuando a los mamíferos. Se hallan durante el estadio de la meiosis I denominado diploteno. Luego de este relativamente largo período de la meiosis I, los cromosomas en escobilla vuelven a compactarse durante el período de metafase I. Son estructuras transitorias, específicamente bivalentes (es decir, dos cromosomas apareados cada uno de los cuales está formado por dos cromátidas hermanas). Cada uno de los dos cromosomas está constituido por dos largas hebras que forman muchos «rulos» o «bucles», a la manera de un cepillo o escobilla, a lo largo del eje mayor del cromosoma. Esos «rulos» permiten que el ADN se halle disponible para el proceso de transcripción durante la maduración del ovocito.[108][109] De hecho, la presencia de cromosomas en escobilla en una célula es indicador de que está ocurriendo la transcripción del ARN mensajero.[110][111][112] La locución «cromosomas en escobilla» (lampbrush chromosome) fue acuñado por J. Rückert en 1892,[113] quien asimiló la forma de estos cromosomas a un cepillo del siglo XIX, bastante equivalente a lo que actualmente se denomina «limpiatubos».[110]
Cromosomas B
[editar]La mayoría de los organismos son habitualmente muy poco tolerantes a la adición o pérdida de material cromosómico, incluso en cantidades ínfimas. Así, alteraciones cromosómicas como las deleciones, duplicaciones y aneuploidías (el exceso o defecto respecto al número cromosómico normal en una especie dada) provocan en el individuo afectado desde malformaciones hasta inviabilidad en diferentes niveles del desarrollo. Sin embargo, una excepción a este hecho en muchas especies animales y vegetales consiste en la existencia de cromosomas supernumerarios o cromosomas B. La distinción entre cromosomas B y los del complemento normal (cromosomas A) fue realizada por primera vez por Randolph en 1928.[114] En general, los cromosomas accesorios presentan las siguientes características:[115]
- no son indispensables para la vida normal de sus portadores;
- no son homólogos de ninguno de los cromosomas A, de los que probablemente proceden;
- por lo general tienen sistemas de herencia irregulares y no mendelianos;
- morfológicamente, suelen ser más pequeños que los cromosomas del complemento normal, heterocromáticos y alocíclicos;
- en cuanto a su distribución, los cromosomas B varían en frecuencia
- dentro de poblaciones de la misma especie (por ejemplo, en el saltamontes Myrmeleotettix maculatus solo se han encontrado cromosomas B en la parte sur de Gran Bretaña, no apareciendo ni en otras poblaciones del país ni en las poblaciones de países continentales adyacentes como Francia o Bélgica[116]);
- dentro de individuos de la misma población;
- dentro de células del mismo organismo (por ejemplo, en Aegilops mutica y Aegilops speltoides los B solo están presentes en varias partes aéreas de las plantas, como hipocótilos y ápices, y no en las raíces;[117]
- en general carecen de genes mayores,[118] no tienen efectos cualitativos sobre el fenotipo[116] y son dañinos para los individuos que los portan en número elevado.[115]
Sin embargo, el término «cromosoma B» integra un conjunto heterogéneo de cromosomas, que varían tanto en su comportamiento como en su forma y tamaño, por lo que las generalizaciones deben realizarse con precaución.
Isocromosomas
[editar]Un isocromosoma es un cromosoma metacéntrico anormal originado durante la meiosis o mitosis cuando la división del centrómero se produce según el plano horizontal en vez de vertical. Como consecuencia, uno de los brazos del cromosoma original se pierde y los brazos del isocromosoma resultante son genéticamente idénticos entre sí pero en sentido inverso.[2]
En los humanos, los isocromosomas se hallan asociados a ciertas enfermedades. Así, por ejemplo, se hallan en algunas niñas que presentan el síndrome de Turner, en los pacientes con el síndrome de Pallister-Killian y en algunos tumores. El isocromosoma «17q» (o sea, el isocromosoma formado por dos brazos largos del cromosoma 17 y que ha perdido el brazo corto) y el isocromosoma «14q» están asociados a ciertos tipos de leucemia.[119][120] Además, los individuos portadores de isocromosomas pueden tener descendientes con mayor número de cromosomas que el normal.[121]
Cromosoma en organismos procariotas
[editar]Los procariotas, bacteria y archaea, presentan típicamente un solo cromosoma circular, si bien existen algunas variantes a esta regla.[122] El cromosoma bacteriano puede tener un tamaño desde 160 000 pares de bases (como en el endosimbionte Carsonella ruddii,[123] a 12 200 000 pares de bases en la bacteria del suelo Sorangium cellulosum.[124]
Las bacterias usualmente tienen un solo punto en su cromosoma desde el cual se inicia la duplicación, mientras que algunas archeas presentan múltiples sitios de inicio de la duplicación.[125] Por otro lado, los genes de los procariotas están organizados en operones y no contienen intrones.
Los procariotas no poseen un núcleo verdadero, en cambio su ADN está organizado en una estructura denominada nucleoide.[126] El nucleoide es una estructura distintiva y ocupa una región definida en la célula bacteriana. Esta estructura es muy dinámica y se halla mantenida y remodelada a través de la acción de proteínas similares a histonas, las cuales se asocian al cromosoma bacteriano.[127] En archaea, el ADN en el cromosoma se halla todavía más organizado, con el ADN empacado dentro de estructuras similares a los nucleosomas eucarióticos.[128][129]
Cromosomas artificiales
[editar]Los cromosomas artificiales son cromosomas que han sido manipulados a través de herramientas de ingeniería genética para que presenten estructuras precisas que permiten su integración, permanencia y duplicación en determinados organismos.[130] El cromosoma artificial de levadura o YAC (acrónimo inglés por yeast artificial chromosome) es un tipo de vector de clonación de alta capacidad siendo, de hecho, el de mayor capacidad (200 kb a 3000 kb). Fueron descritos por primera vez en 1983.[131] Es un vector que imita las características de un cromosoma normal de una levadura, ya que porta un centrómero y los telómeros terminales. Esto permite clonar (es decir, multiplicar) en levaduras secuencias de ADN de hasta un millón de pares de bases o más, al comportarse como un cromosoma propio de la levadura. Son utilizados en construcción de genotecas genómicas, siendo muy extendido su uso en los primeros años del Proyecto Genoma Humano.[132] Sin embargo, son más inestables que otros vectores, tales como BAC (acrónimo inglés de bacterial artificial chromosome o cromosoma artificial bacteriano), que han acabado imponiéndose.[133] Estos últimos son también vectores de clonación usados para clonar fragmentos de ADN de 100 a 300 kb de tamaño en la bacteria Escherichia coli. Su estructura es análoga a la del plásmido factor-F encontrado de modo natural en esa especie bacteriana.
Véase también
[editar]- Anexo:Conteo cromosómico por organismo
- Estructura supracromosómica
- Genoma
- Genoma humano
- Citogenética
- Cariotipo
- Aberración cromosómica
Nota
[editar]- ↑ Los pasos para realizar el estudio de los cromosomas humanos mediante técnicas convencionales son los siguientes:[95]
- Obtención de la muestra: se realiza exclusivamente de tejidos vivos que contengan células con núcleo. Principalmente se emplean los glóbulos blancos que se hallan en la sangre por su fácil accesibilidad.
- Siembra: la cual se realiza agregando aproximadamente 1 mililitro de sangre entera heparinizada a un medio de cultivo enriquecido con suero fetal bovino, antibióticos y mitógenos, lo cual estimulará el crecimiento y división de las células.
- Incubación: se mantiene a 38 °C con una atmósfera de CO2 al 5 % y humedad por 72 horas.
- Cosecha: Se agrega colchicina a la muestra para detener la mitosis en metafase, posteriormente se cenfrifuga la mezcla para retirar el sobrenadante (suero sanguíneo y medio de cultivo). Se agrega solución hipotónica de cloruro de potasio para romper las membranas celulares y para finalizar el paso de la cosecha se realizan 3 lavados con una solución de metanol y ácido acético.
- Goteo: con posterioridad a los lavados, por medio de centrifugación, se obtiene un botón celular blanco, el cual se suspende en la misma solución fijadora de metanol y ácido acético y se procede a gotear en un portaobjetos a unos cuantos centímetros, esto es con el objetivo de «reventar» las células y obtener los cromosomas.
- Envejecimiento: en este paso se espera a que la muestra pierda humedad. Se puede aplicar calor al portaobjetos para deshidratar la muestra.
- Tinción: existen muchos tipos de tinciones para observar los cromosomas. La más utilizada es la tinción con colorante Giemsa, se conoce como técnica de bandas GTG. En este caso se expone la muestra del portaobjetos a tripsina, con el objetivo de desnaturalizar algunas de las proteínas constitutivas de los cromosomas. Posteriormente se tiñen con dos colorantes, Giemsa y Wright, en algunos laboratorios puede emplearse un solo colorante, pero el empleo de los dos mejora la calidad del resultado, puesto que facilita el análisis al microscopio para el citogenetista creando un contraste de color en las bandas que se formaron al emplear la tripsina. Por medio de estas bandas podemos distinguir las características de un cromosoma y determinar si es normal o presenta alguna anomalía estructural. Existen otras técnicas de tinción, como bandas NOR, ICH, bandas Q, bandas R, técnicas para teñir centrómero y heterocromatina. Con este tipo de técnicas se puede llegar a realizar un diagnóstico citogenético acerca de una enfermedad cromosómica.
- Lectura: el último paso consiste en observar por lo menos 20 placas metafásicas y formar un cariotipo o cariograma, donde se acomodan los cromosomas por grupos según el tamaño y la localización del centrómero.
Referencias
[editar]- ↑ «cromosomal». RANME.
- ↑ a b c d e Facultad de Ciencias Agropecuarias. Universidad Nacional de Córdoba (Argentina). Genética. Capítulo 2. Forma y tamaño cromosómico. Cariotipo. [1]
- ↑ Nägeli, C. «Memoir on the nuclei, formation, and growth of vegetable cells» (A. Henfrey, trans.). En: C. y J. Adlard, eds., Reports and Papers on Botany. London: The Ray Society, 1846.
- ↑ Daintith, John, et al., (eds), Biographical Encyclopedia of Scientists, second edition. Bristol, UK: Institute of Physics Publishing, 1994.
- ↑ Flemming, W. 1882. Zell-substanz, Kern und Zelltheilung (Citoplasma, núcleo y división celular).
- ↑ Olins, D.E.; Olins, A.L. (2003), «Chromatin history: our view from the bridge», Nature Reviews Molecular Cell Biology 4 (10): 809-13, archivado desde el original el 10 de septiembre de 2006, consultado el 14 de diciembre de 2008.
- ↑ Crow, E.W.; Crow, J.F. (2002), «100 Years Ago: Walter Sutton and the Chromosome Theory of Heredity», Genetics 160 (1): 1-4.
- ↑ Satzinger, Helga (2008), «Theodor and Marcella Boveri: chromosomes and cytoplasm in heredity and development», Nature Reviews Genetics 9 (3): 231, ISSN 1471-0056, doi:10.1038/nrg2311.
- ↑ Morgan, Thomas Hunt, «Chromosomes and Heredity.» The American Naturalist, 44(524):449-496, 1910.
- ↑ Claros Días, Manuel. «Historia de la Biologìa (V): La naturaleza química del DNA (hasta el primer tercio del siglo XX)». Encuentros en la Biología. Facultad de Ciencias. Universidad de Málaga. ISSN= 1134-8496.
- ↑ [2] Archivado el 22 de septiembre de 2010 en Wayback Machine.
- ↑ Levene, P. (1919). «The structure of yeast nucleic acid». J Biol Chem 40 (2): 415-24. Archivado desde el original el 29 de junio de 2009. Consultado el 14 de diciembre de 2008.
- ↑ a b Kornberg, R.D.; Lorch, Y. (1999), «Twenty-Five Years of the Nucleosome, Fundamental Particle of the Eukaryote Chromosome», Cell 98: 285-294, doi:10.1016/S0092-8674(00)81958-3, archivado desde el original el 22 de junio de 2010, consultado el 6 de diciembre de 2008.
- ↑ a b Facultad de Ciencias Veterinarias. Universidad Nacional de la Plata. MORFOLOGÍA CROMOSÓMICA - CARIOTIPO Archivado el 2 de diciembre de 2008 en Wayback Machine..
- ↑ Isenberg, I. (1979), «Histones», Annual Reviews in Biochemistry 48 (1): 159-191, doi:10.1146/annurev.bi.48.070179.001111.
- ↑ Grunstein, M. (1990), «Histone Function in Transcription», Annual Reviews in Cell Biology 6 (1): 643-676, doi:10.1146/annurev.cb.06.110190.003235.
- ↑ Kedes, L.H. (1979), «Histone Genes and Histone Messengers», Annual Reviews in Biochemistry 48 (1): 837-870, doi:10.1146/annurev.bi.48.070179.004201.
- ↑ a b Klug, A., Rhodes, D., Smith, J., Finch, J. T., Thomas, J. O. «A low resolution structure for the histone core of the nucleosome.» Nature. 1980 Oct 9;287(5782):509-516.
- ↑ Klug, A. & L. C. Lutter. 1981. «The helical periodicity of DNA on the nucleosome». Nucleic Acids Res. September 11; 9(17): 4267-4283.
- ↑ Klug, A. & L C Lutter. 1981. «The helical periodicity of DNA on the nucleosome.» Nucleic Acids Res. September 11; 9(17): 4267-4283.
- ↑ a b c Hock, R.; Furusawa, T.; Ueda, T.; Bustin, M. (2007), «HMG chromosomal proteins in development and disease», Trends in Cell Biology 17 (2): 72-79, doi:10.1016/j.tcb.2006.12.001.
- ↑ a b c Bustin, M. (1999), «Regulation of DNA-Dependent Activities by the Functional Motifs of the High-Mobility-Group Chromosomal Proteins», Molecular and Cellular Biology 19 (8): 5237-5246.
- ↑ Kornberg, Roger D. (1974), «Chromatin Structure: A Repeating Unit of Histones and DNA», Science 184 (4139): 868-871, PMID 4825889, doi:10.1126/science.184.4139.868.
- ↑ a b Woodcock, C.L.; Dimitrov, S. (2001), «Higher-order structure of chromatin and chromosomes», Current Opinion in Genetics & Development 11 (2): 130-135.
- ↑ Li, Gang; Sudlow, Gail; Belmont, Andrew S. (1998), «Interphase Cell Cycle Dynamics of a Late-Replicating, Heterochromatic Homogeneously Staining Region: Precise Choreography of Condensation/Decondensation and Nuclear Positioning», The Journal of Cell Biology 140 (5): 975-989, PMID 9490713, doi:10.1083/jcb.140.5.975.
- ↑ a b Paulson, J.R.; Laemmli, U.K. (1977), «The structure of histone-depleted metaphase chromosomes», Cell 12 (3): 817-28, doi:10.1016/0092-8674(77)90280-X. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Earnshaw, W.C.; Halligan, B.; Cooke, C.A.; Heck, M.M.; Liu, L.F. (1985), «Topoisomerase II is a structural component of mitotic chromosome scaffolds», The Journal of Cell Biology 100 (5): 1706-1715, PMID 2985625, doi:10.1083/jcb.100.5.1706.
- ↑ Gasser, S.M.; Laroche, T.; Falquet, J.; Tour, E.; Laemmli, U.K. (1986), «Metaphase chromosome structureInvolvement of topoisomerase II», J. Mol. Biol 188: 613-629, doi:10.1016/S0022-2836(86)80010-9.
- ↑ a b c Christensen, Morten O.; Larsen, Morten K.; Barthelmes, Hans Ullrich; Hock, Robert; Andersen, Claus L.; Kjeldsen, Eigil; Knudsen, Birgitta R.; Westergaard, Ole; Boege, Fritz; Mielke, Christian (2002), «Dynamics of human DNA topoisomerases II{alpha} and II{beta} in living cells», The Journal of Cell Biology 157 (1): 31-44, PMID 11927602, doi:10.1083/jcb.200112023.
- ↑ Maeshima, K.; Laemmli, U.K. (2003), «A Two-Step Scaffolding Model for Mitotic Chromosome Assembly», Developmental Cell 4 (4): 467-480, doi:10.1016/S1534-5807(03)00092-3.
- ↑ Tavormina, Penny A.; Come, Marie-George; Hudson, Joanna R.; Mo, Yin-Yuan; Beck, William T.; Gorbsky, Gary J. (2002), «Rapid exchange of mammalian topoisomerase II{alpha} at kinetochores and chromosome arms in mitosis», The Journal of Cell Biology 158 (1): 23-29, PMID 12105179, doi:10.1083/jcb.200202053.
- ↑ Mirkovitch, J.; Mirault, M.E.; Laemmli, U.K. (1984), «Organization of the higher-order chromatin loop: specific DNA attachment sites on nuclear scaffold», Cell 39 (1): 223-32, doi:10.1016/0092-8674(84)90208-3.
- ↑ Hart, C. M.; Laemmli, U. K. (1998), «Facilitation of chromatin dynamics by SARs», Current Opinion in Genetics & Development 8 (5): 519-525, doi:10.1016/S0959-437X(98)80005-1, archivado desde el original el 24 de abril de 2009, consultado el 10 de diciembre de 2008.
- ↑ Swedlow, J. R.; Hirano, T. (2003), «The Making of the Mitotic Chromosome: Modern Insights into Classical Questions», Molecular Cell 11 (3): 557-569, doi:10.1016/S1097-2765(03)00103-5. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Poirier, M.G.; Eroglu, S.; Marko, J.F. (2002), «The Bending Rigidity of Mitotic Chromosomes», Molecular Biology of the Cell 13 (6): 2170-2179, consultado el 28 de abril de 2009.
- ↑ Poirier, M.G.; Marko, J.F. (2002), «Mitotic chromosomes are chromatin networks without a mechanically contiguous protein scaffold», Proc. Natl. Acad. Sci. USA 99: 15393-15397.
- ↑ Lewis, C. D.; Laemmli, U. K. (1982), «Higher order metaphase chromosome structure: evidence for metalloprotein interactions», Cell 29 (1): 171-81, doi:10.1016/0092-8674(82)90101-5.
- ↑ a b Hirano, T.; Mitchison, T. J. (1994), «A heterodimeric coiled-coil protein required for mitotic chromosome condensation in vitro», Cell 79 (3): 449-58, doi:10.1016/0092-8674(94)90254-2.
- ↑ Hirano, M.; Kobayashi, R. (1997), «Condensins, Chromosome Condensation Protein Complexes Containing Xcap-c, Xcap-e and a Xenopus…», Cell 89 (4): 511-521, archivado desde el original el 8 de noviembre de 2009, consultado el 28 de noviembre de 2008.
- ↑ a b Vernos, I.; Raats, J.; Hirano, T.; Heasman, J.; Karsenti, E.; Wylie, C. (1995), «Xklp 1, A Chromosomal Xenopus Kinesin-like Protein Essential for Spindle Organization and Chromosome…», Cell 81 (1): 117-127, archivado desde el original el 8 de noviembre de 2009, consultado el 28 de noviembre de 2008.
- ↑ MacHado, C.; Sunkel, C. E.; Andrew, D. J. (1998), «Human Autoantibodies Reveal Titin as a Chromosomal Protein», The Journal of Cell Biology 141 (2): 321-333.
- ↑ MacHado, C.; Andrew, D. J. (2000), «D-Titin a Giant Protein with Dual Roles in Chromosomes and Muscles», The Journal of Cell Biology 151 (3): 639-652.
- ↑ Clemson, C. M. (1996), «X chromosome at interphase: evidence for a novel RNA involved in nuclear/chromosome structure», The Journal of Cell Biology 132 (3): 259-275.
- ↑ Elgin, S. C. R. (1996), «Heterochromatin and gene regulation in Drosophila», Current Opinion in Genetics & Development 6 (2): 193-202.
- ↑ Lewis, E. B. (1950), «The phenomenon of position effect», Adv Genet 3: 73-115, doi:10.1016/S0065-2660(08)60083-8.
- ↑ Heitz, E. (1928), «Das heterochromatin der moose», Jahrb. Wiss. Botanik 69: 762-818.
- ↑ a b Grewal, S. I. S.; Rice, J. C. (2004), «Regulation of heterochromatin by histone methylation and small RNAs», Current Opinion in Cell Biology 16 (3): 230-238, doi:10.1016/j.ceb.2004.04.002, archivado desde el original el 29 de junio de 2010.
- ↑ a b Volpe, Thomas A.; Kidner, Catherine; Hall, Ira M.; Teng, Grace; Grewal, Shiv I. S.; Martienssen, Robert A. (2002), «Regulation of Heterochromatic Silencing and Histone H3 Lysine-9 Methylation by RNAi», Science 297 (5588): 1833-1837, PMID 12193640, doi:10.1126/science.1074973. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Lachner, M.; O'Sullivan, R. J.; Jenuwein, T. (2003), «An epigenetic road map for histone lysine methilation», Journal of Cell Science 116: 2117-2124, doi:10.1242/10.1242/jcs.00493.
- ↑ Hennig, W. (1999), «Heterochromatin», Chromosoma 108 (1): 1-9, doi:10.1007/s004120050346.
- ↑ Craig, J. M. (2005), «Heterochromatin-many flavours, common themes», BioEssays 27 (1): 17-28, doi:10.1002/bies.20145, archivado desde el original el 16 de agosto de 2011, consultado el 6 de diciembre de 2008.
- ↑ Fitzgerald-hayes, M.; Clarke, L.; Carbon, J. (1982), «Nucleotide sequence comparisons and functional analysis of yeast centromere DNAs», Cell 29 (1): 235-44, doi:10.1016/0092-8674(82)90108-8.
- ↑ Choo, K. H. A. (1997), The centromere.
- ↑ Meluh, P. B.; Yang, P.; Glowczewski, L.; Koshland, D.; Smith, M. M. (1998), «Cse 4 P is a Component of the Core Centromere of Saccharomyces Cerevisiae», Cell 94 (5): 607-613, archivado desde el original el 8 de noviembre de 2009, consultado el 28 de noviembre de 2008.
- ↑ Kurenova, E. V.; Mason, J. M. (1997), «Telomere functions. A review», Biochemistry (Mosc) 62 (11): 1242-53.
- ↑ a b c Panzera, F., Rubén Pérez y Yanina Panzera. Identificación cromosómica, cariotipo. Archivado el 2 de marzo de 2012 en Wayback Machine. Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata.
- ↑ Saccone, S.; Federico, C.; Andreozzi, L.; D'antoni, S.; Bernardi, G.; Molecolare, E.; Zoologica, S.; Slota, E. et al. (2002), «Chromosome structure», Chromosome Research 10 (1): 1-50, archivado desde el original el 22 de julio de 2011 .
- ↑ Bernardi, G. (1989), «The Isochore Organization of the Human Genome», Annual Reviews in Genetics 23 (1): 637-659, doi:10.1146/annurev.ge.23.120189.003225.
- ↑ Saccone, S.; Bernardi, G. (2001), «Human chromosomal banding by in situ hybridization of isochores», Methods in Cell Science 23 (1): 7-15, doi:10.1023/A:1013173011458.
- ↑ Bernardi, G. (1995), «The Human Genome: Organization and Evolutionary History», Annual Reviews in Genetics 29 (1): 445-476, doi:10.1146/annurev.ge.29.120195.002305.
- ↑ Costantini, M.; Clay, O.; Auletta, F.; Bernardi, G. (2006), «An isochore map of human chromosomes», Genome Research 16 (4): 536-541, doi:10.1101/gr.4910606.
- ↑ Bernardi, G. (2000), «Isochores and the evolutionary genomics of vertebrates», Gene 241 (1): 3-17, doi:10.1016/S0378-1119(99)00485-0, archivado desde el original el 13 de octubre de 2008, consultado el 13 de diciembre de 2008.
- ↑ Ensembl
- ↑ Bendich, Arnold J., Karl Drlica. 2000. «Prokaryotic and eukaryotic chromosomes: what's the difference?» BioEssays 22: 481-486.
- ↑ Wurster, Doris H. y Kurt Benirschke. 1970. «Indian Momtjac, Muntiacus muntiak: A Deer with a Low Diploid Chromosome Number.» Science 12 de junio de 1970: Vol. 168. no. 3937, pp. 1364-1366.
- ↑ McClintock, B. (1984). «The significance of responses of the genome to challenge.» Science 226, 792-801.
- ↑ Sabater-Tobella J. (2020). «Cromosoma brazo p».
- ↑ Drets, Máximo (2002). «Una saga citogenética: El descubrimiento de los métodos de bandeo cromosómico. Significado y proyección bio-médica». Rev. Méd. Urug. (Montevideo: SciELO) 18 (2). Consultado el 3 de febrero de 2023.
- ↑ International Human Genome Sequencing Consortium (2004). «Finishing the euchromatic sequence of the human genome». Nature 431 (7011): 931-45. PMID 15496913. [3]
- ↑ International Human Genome Sequencing Consortium (2001). «Initial sequencing and analysis of the human genome». Nature 409 (6822): 860-921. PMID 11237011. [4]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 1. Accedido 12 de diciembre de 2008. [5]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 2. Accedido 12 de diciembre de 2008. [6]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 3. Accedido 12 de diciembre de 2008. [7]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 4. Accedido 12 de diciembre de 2008. [8]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 5. Accedido 12 de diciembre de 2008. [9]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 6. Accedido 12 de diciembre de 2008. [10]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 7. Accedido 12 de diciembre de 2008. [11]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 8. Accedido 12 de diciembre de 2008. [12]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 9. Accedido 12 de diciembre de 2008. [13]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 10. Accedido 12 de diciembre de 2008. [14]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 11. Accedido 12 de diciembre de 2008. [15]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 12. Accedido 12 de diciembre de 2008. [16]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 13. Accedido 12 de diciembre de 2008. [17]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 14. Accedido 12 de diciembre de 2008. [18]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 15. Accedido 12 de diciembre de 2008. [19]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 16. Accedido 11 de enero de 2009. [20]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 17. Accedido 11 de enero de 2009. [21]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 18. Accedido 11 de enero de 2009. [22]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 19. Accedido 11 de enero de 2009. [23]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 20. Accedido 11 de enero de 2009. [24]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 21. Accedido 11 de enero de 2009. [25]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 22. Accedido 11 de enero de 2009. [26]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome X. Accedido 11 de enero de 2009. [27]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome Y. Accedido 11 de enero de 2009. [28]
- ↑ Paz y Miño, César. 1999. Citogenética humana: manual de prácticas. Práctica 5: Cultivo y preparación de linfocitos para análisis cromosómico. Laboratorio de Genética Molecular y Citogenética Humana, Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales y Facultad de Medicina. Pontificia Universidad Católica del Ecuador.
- ↑ Ashburner, M. (1970), «Function and structure of polytene chromosomes during insect development», Adv Insect Physiol 7 (1): 3S4.
- ↑ Rudkin, G. T. (1972), «Replication in polytene chromosomes», Results Probl Cell Differ 4: 59-85.
- ↑ G. (1974), «The Relationship Between Genes and Polytene Chromosome Bands», Annual Reviews in Genetics 8 (1): 51-62, doi:10.1146/annurev.ge.08.120174.000411.
- ↑ Lewis, E. B. (1954), «The Theory and Application of a New Method of Detecting Chromosomal Rearrangements in Drosophila», The American Naturalist 88 (841): 225, doi:10.1086/281833.
- ↑ C. A. (1971), «The Genetic Organization of Chromosomes», Annual Reviews in Genetics 5 (1): 237-256, doi:10.1146/annurev.ge.05.120171.001321.
- ↑ Gunderina, L. I.; Kiknadze, I. I.; Istomina, A. G.; Gusev, V. D.; Miroshnichenko, L. A. (2005), «Divergence of the polytene chromosome banding sequences as a reflection of evolutionary», Russian Journal of Genetics 41 (2): 130-137, doi:10.1007/s11177-005-0036-6.
- ↑ Gunderina, L.I. (2005). «Divergence patterns of banding sequences in different polytene chromosome arms reflect relatively independent evolution of different genome components.». Russian Journal of Genetics 41 (4). Consultado el 11 de diciembre de 2019.
- ↑ Coluzzi, Mario; Sabatini, Adriana; Della Torre, Alessandra; Di Deco, María Ángela; Petrarca, Vincenzo (2002), «A Polytene Chromosome Analysis of the Anopheles gambiae Species Complex», Science 298 (5597): 1415-1418, PMID 12364623, doi:10.1126/science.1077769.
- ↑ Moltó, M. D.; Frutos, R.; Martínez-Sebastián, M. J. (1987), «The banding pattern of polytene chromosomes of Drosophila guanche compared with that of D», Genética 75 (1): 55-70, doi:10.1007/BF00056033.
- ↑ Zhao, J. T.; Frommer, M.; Sved, J. A.; Zacharopoulou, A. (1998), «Mitotic and polytene chromosome analyses in the Queensland fruit fly, Bactrocera tryoni (Diptera: Tephritidae)», Genome 41: 510-526, doi:10.1139/gen-41-4-510. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Oscar Hertwig, 1906: Lehrbuch der Entwicklungsgeschichte des Menschen und der Wirbeltiere. Achte Auflage.
- ↑ Flemming, W. 1882. Zellsubstanz, Kern- und Zelltheilung. Vogel, Leipzig.
- ↑ Izawa, M.; Allfrey, V. G.; Mirsky, A. E. (1963), «The Relationship between RNA Synthesis and Loop Structure in Lampbrush Chromosomes», Proceedings of the National Academy of Sciences 49 (4): 544-551.
- ↑ Callan, H. G. (1963), «The Nature of Lampbrush Chromosomes», Int Rev Cytol 15: 1-34, doi:10.1016/S0074-7696(08)61114-6.
- ↑ a b Macgregor, H. Lampbrush chromosomes . School of Biosciences, University of Exeter.
- ↑ Callan, H. G. (1986), «Lampbrush chromosomes», Mol Biol Biochem Biophys 36: 1-252.
- ↑ Gall, J. G.; Murphy, C.; Callan, H. G.; Wu, Z. A. (1991), «Lampbrush chromosomes», Methods Cell Biol 36: 149-66, doi:10.1016/S0091-679X(08)60276-9.
- ↑ Rückert, J. 1892. «Zur Entwicklungsgeschichte des Ovarialeies bei Selachiern.» Anat Anz 7: 107-158.
- ↑ Randolph, L. F. (1928). «Chromosome numbers in Zea Mays». L. Cornel1 Agric. Exp. Sta. Memoir 117. 44.
- ↑ a b Jones, R. N.; Rees, H. (1982), B chromosomes. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ a b Hewitt, G. M.; East, T. M. (1978), «Effects of B chromosomes on development in grasshopper embryos», Heredity 41: 347-356, doi:10.1038/hdy.1978.105.
- ↑
- ↑ Fox, D. P.; Hewitt, G. M.; Hall, D. J. (1974), «DNA replication and RNA transcription of euchromatic and heterochromatic chromosome regions during …», Chromosoma 45 (1): 43-62, doi:10.1007/BF00283829.
- ↑ Hernández-Boluda, J. C.; Cervantes, F.; Costa, D.; Carrio, A.; Montserrat, E. (2000), «Chronic myeloid leukemia with isochromosome 17q: report of 12 cases and review of the literature», Leuk Lymphoma 38 (1-2): 83-90.
- ↑ Liu, H. W.; Lie, K. W.; Chan, L. C. (1992), «Isochromosome 14 q and leukemia with dysplastic features», Cancer genetics and cytogenetics 64 (1): 97-98, doi:10.1016/0165-4608(92)90333-4, archivado desde el original el 8 de noviembre de 2009, consultado el 28 de noviembre de 2008.
- ↑ Kleczkowska, A.; Fryns, J. P.; Buttiens, M.; Bisschop, F.; Emmery, L.; Berghe, H. V. (1986), «Trisomy (18q) and tetrasomy (18p) resulting from isochromosome formation», Clinical Genetics 30 (6): 503-508, doi:10.1111/j.1399-0004.1986.tb01918.x.
- ↑ Thanbichler, M., Shapiro, L. (2006). «Chromosome organization and segregation in bacteria». J. Struct. Biol. 156 (2): 292-303. PMID 16860572. doi:10.1016/j.jsb.2006.05.007.
- ↑ Nakabachi, A., Yamashita, A., Toh, H., Ishikawa, H., Dunbar, H., Moran, N., Hattori, M. (2006). «The 160-kilobase genome of the bacterial endosymbiont Carsonella». Science 314 (5797): 267. PMID 17038615. doi:10.1126/science.1134196.
- ↑ Pradella, S., Hans, A., Spröer, C., Reichenbach, H., Gerth, K., Beyer, S. (2002). «Characterisation, genome size and genetic manipulation of the myxobacterium Sorangium cellulosum So ce56». Arch Microbiol 178 (6): 484-92. PMID 12420170. doi:10.1007/s00203-002-0479-2.
- ↑ Kelman, L. M., Kelman, Z. (2004). «Multiple origins of replication in archaea». Trends Microbiol. 12 (9): 399-401. PMID 15337158. doi:10.1016/j.tim.2004.07.001.
- ↑ Thanbichler, M., Wang, S. C., Shapiro, L. (2005). «The bacterial nucleoid: a highly organized and dynamic structure». J. Cell. Biochem. 96 (3): 506-21. PMID 15988757. doi:10.1002/jcb.20519.
- ↑ Sandman, K., Pereira, S. L., Reeve, J. N. (1998). «Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome». Cell. Mol. Life Sci. 54 (12): 1350-64. PMID 9893710. doi:10.1007/s000180050259.
- ↑ Sandman, K., Reeve, J. N. (2000). «Structure and functional relationships of archaeal and eukaryal histones and nucleosomes». Arch. Microbiol. 173 (3): 165-9. PMID 10763747. doi:10.1007/s002039900122.
- ↑ Pereira, S. L., Grayling, R. A., Lurz, R., Reeve, J. N. (1997). «Archaeal nucleosomes». Proc. Natl. Acad. Sci. U.S.A. 94 (23): 12633-7. PMID 9356501. doi:10.1073/pnas.94.23.12633.
- ↑ Basu, J. y Huntington F. Willard. «Artificial and engineered chromosomes: non-integrating vectors for gene therapy.» Trends in Molecular Medicine, Volume 11, Issue 5, May 2005, 251-258.
- ↑ Murray, A. W., Szostak, J. W. (1983): «Construction of artificial chromosomes in yeast.» Nature 305, 2049-2054.
- ↑ Larin, Z., Monaco, A. P., Lehrach, H. (1991): «Yeast artificial chromosome libraries containing large inserts from mouse and human DNA.» Proceedings of the National Academy of Sciences (USA) 88, 4123-4127.
- ↑ Bellanné-Chantelot, C. et al. (1992): «Mapping the whole human genome by fingerprinting yeast artificial chromosomes», Cell 70, 1059-1068.
Bibliografía
[editar]- Adolph, K. (ed.) (1988) Chromosomes and chromatin 1-3 Boca Ratón FL: CRC Press.
- Hsu, T. C. (1979) Human and mammalian cytogenetics: an historical perspective. Nueva York: Springer Verlag.
- Stewart, A. (1990) «The functional organization of chromosomes and the nucleus, a special issue.» Trends Genet. (6):377-379
- Price, C. M. (1992) «Centromeres and telomeres.» Curr. Opin. Cell Biol. (4): 379-384.
- Gall, J. G. (1981) «Chromosome structure and the C-value paradox.» J. Cell Biol. (91):3-14
- Blackburn, E. H., Szostak, J. W. (1984) «The molecular structure of centromeres and telomeres.» Annu. Rev. Biochem. (53): 163-194.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre cromosomas.
Wikimedia Commons alberga una categoría multimedia sobre cromosomas.
- El Diccionario de la Real Academia Española tiene una definición para cromosoma.
- Exploring Genes and Genetic Disorders (en inglés).
- Los cromosomas. Video en Youtube
- Tres Etapas en la Historia de la Citogenética Clínica