Carcinoma epatocellulare

| Carcinoma epatocellulare | |
|---|---|
 | |
| Specialità | oncologia |
| Classificazione e risorse esterne (EN) | |
| ICD-O | 8170/3 |
| ICD-9-CM | 155 |
| ICD-10 | C22.0 |
| OMIM | 114550 |
| MeSH | D006528 |
| MedlinePlus | 000280 |
| eMedicine | 278354 |
Il carcinoma epatocellulare o epatocarcinoma (CEC o HCC) o più raramente epatoma è la forma più comune di tumore del fegato. Nel mondo è l'ottavo tipo di neoplasia solida più frequentemente riscontrata. Le morti attribuite a tale forma tumorale sono un milione all'anno[1].
Epidemiologia
[modifica | modifica wikitesto]Generale
[modifica | modifica wikitesto]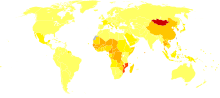
nessun dato
meno di 7.5
7.5-15
15-22.5
22.5-30
30-37.5
37.5-45
45-52.5
52.5-60
60-67.5
67.5-75
75-110
più di 110
Si sviluppa prevalentemente in fegati cirrotici di persone intorno alla quinta e sesta decade di anzianità. Nei soli USA si registrano quasi 16 000 casi all'anno.[3] In Europa i casi sono 50 000 (stima basata sull'anno 2000), gli stati più a rischio sono Grecia, Francia e Inghilterra, mentre in Italia si è registrato un leggero aumento. L'incidenza massima si registra in alcuni paesi dell'Africa e nelle isole del Pacifico (incidenza massima riscontrata: 104 su 100 000, contro la media 2-7 su 100 000), in paesi come Cina, Taiwan e Corea vi sono 150 casi ogni milione di abitanti.[4] I paesi invece con la minore incidenza sono l'Australia, India e quelli del Sud America.[5]
Sesso
[modifica | modifica wikitesto]Colpisce con maggiore frequenza gli uomini (nel sesso maschile è la quinta forma più diffusa) rispetto alle donne (il rapporto è stato calcolato come 4 a 1).[6]
Età
[modifica | modifica wikitesto]Per quanto riguarda l'età è maggiormente diffusa intorno ai 50-60 anni, ma in alcuni paesi dell'Africa e nella Cina l'età media diminuisce notevolmente. Si sono registrati casi in età adolescenziale e anche in età infantile, l'età minima è stata di due anni.[7]
Sintomatologia
[modifica | modifica wikitesto]Anche se nei paesi più industrializzati viene diagnosticato negli stadi iniziali in assenza di sintomi (25% dei casi) grazie allo screening dei pazienti cirrotici, con il progredire si mostra dolore in sede addominale, calo ponderale, ascite, dispepsia, gonfiore addominale, anoressia, astenia, epatomegalia, febbre fino ai più rari addome acuto e dispnea.
In alcuni casi, soprattutto nel paziente pediatrico, si può osservare produzione di beta-gonadotropina.[8]
Eziologia
[modifica | modifica wikitesto]Si considera spesso causato da una malattia epatica preesistente, tipo la cirrosi o l'infezione da epatite virale. In alcuni stati dell'Africa o dell'Asia vi è un'elevata incidenza legata a infezioni da virus dell'epatite B[9], C e G.[10]
Fra le altre cause troviamo l'esposizione all'aflatossina, che lascia un'impronta molecolare, ovvero la mutazione di un gene. Inoltre emocromatosi e tirosinemia costituiscono altre condizioni associate alla massa tumorale. Inoltre l'alcolismo è da tempo associato allo stato di cirrosi, e quindi a un incremento di rischio di cancro al fegato.
Fattori di rischio minori
[modifica | modifica wikitesto]Fra gli altri fattori di rischio troviamo la sindrome di Alagille[11], la malattia di Wilson[12], la citrullinemia, la galattosemia, l'eccessivo utilizzo di androgeni[13], mentre non è stato determinato il grado di rischio relativo al fumo di sigaretta. Lo stesso dicasi per la malnutrizione, molto diffusa nei paesi endemici e l'obesità associata a numerose patologie.
Stadiazione
[modifica | modifica wikitesto]Esistono diverse classificazioni per quanto riguarda gli stadi del tumore:
Classificazione TNM
[modifica | modifica wikitesto]Fra le varie quella più diffusa è indicata con l'acronimo TNM: indicano le tre sottoforme per cui vengono poi raggruppate "Tumore primitivo, linfonodi (node) e metastasi a distanza", arrivata alla sesta edizione[14] adottata dall'AJCC (American Joint Committee on Cancer) e dall'UICC (International Union Against Cancer), mentre la variante studiata in Giappone dal LCSGJ (Liver Cancer Study Group of Japan) è stata accertata essere migliore negli stadi iniziali del tumore.[15]
| Tumore primitivo | Linfonodi regionali | Metastasi a distanza |
|---|---|---|
| TX, non determinato | NX, non determinabili | MX, non determinabili |
| T0, non si evidenzia | N0, assenza metastasi | M0, assenza a distanza |
| T1, si mostra un nodulo singolo | N1, presenza di metastasi | M1, presenza delle forme a distanza |
| T2, noduli multipli (dimensioni inferiori ai 5 cm) | * | |
| T3, noduli multipli (dimensioni superiori ai 5 cm) | * | |
| T4, interessamento altri organi o con perforazione peritoneo viscerale | * |
In definitiva gli stadi secondo il TNM sarebbero:
| Stadio | T-N-M |
|---|---|
| I | T1 - N0 - M0 |
| II | T2 - N0 - M0 |
| IIIA | T3 - N0 - M0 |
| IIIB | T4 - N0 - M0 |
| IIIC | T (ogni forma)- N1 - M0 |
| IV | T (ogni forma)- N (ogni forma)- M1 |
Classificazione CLIP
[modifica | modifica wikitesto]Un'altra classificazione è quella individuata in Italia dal CLIP (Cancer of the Liver Italian Program) che comparata alle altre si è dimostrata quella più accurata[16].
Tiene conto di quattro caratteristiche fra cui la classificazione di Child-Pugh, calcolata nel modo seguente:
| Manifestazione | Punti 1 | Punti 2 | Punti 3 |
|---|---|---|---|
| Grado di encefalopatia | Assenza | 1-2 (lieve) | 3-4 (moderata) |
| Ascite | Assenza | Lieve | Moderata |
| Albumina | Maggiore di 3,5 | 2,8 - 3,5 | Inferiore a 2,8 |
| PT (in rapporto all'allungamento espresso in secondi) | 1-4 | 4-6 | maggiore di 6 |
| Bilirubina | 1-2 | Fino a 3 | superiore a 3 |
Il punteggio CLIP viene quindi calcolato nel seguente modo:
| Caratteristica | Punti 0 | Punti 1 | Punti 2 |
|---|---|---|---|
| Classe Child-Pugh | A (fino a 6 punti) | B (fino a 9 punti) | C (superiore a 9 punti) |
| Noduli | Nodulo singolo | Noduli multipli | Massivo (o con volume epatico superiore al 50%) |
| livello di alfa-fetoproteina | Minore di 400 ng/mL | Pari o superiore a 400 ng/mL | * |
| Trombosi venosa portale | No | Si | * |
Altri tipi di classificazione
[modifica | modifica wikitesto]La TNM e la CLIP non sono le uniche considerate, esistono quella di Okuda che ha mostrato notevoli limiti[17], e quella di Barcellona, che attualmente è la più utilizzata dai medici e negli studi clinici e che prende in considerazione i seguenti criteri:
• Numero di lesioni
• Volume delle lesioni
• Invasione vascolare
• Funzionalità epatica
Diagnosi
[modifica | modifica wikitesto]Dopo aver avviato un'accurata anamnesi ed esame obiettivo occorre una conferma in sede di analisi istologica o citologica. Quando vengono a mancare si utilizzano altri esami diagnostici:
- Ecografia, utilizzata nello screening può differenziarla dalla trombosi non neoplastica
- Tomografia computerizzata spirale multislice
- Risonanza magnetica
- Biopsia, tenendo conto delle possibili complicazioni viene utilizzata quando i valori di alfa-fetoproteina sono inferiori a 400 ng/mL
- Laparoscopia con ecografia intraoperatoria
L'arteriografia e scintigrafia epatica una volta utilizzate ormai sono state sostituite da esami più specifici
Terapie
[modifica | modifica wikitesto]
Il trattamento che fornisce maggiori riscontri è quello chirurgico.
Terapia chirurgica
[modifica | modifica wikitesto]Si procede con resezione nei casi in cui la massa tumorale è di dimensioni ridotte o in caso di nodulo singolo.[18] Le dimensioni non devono superare i 5 cm nel caso di nodulo singolo, 3 cm nel caso di noduli plurimi (massimo tre) secondo le indicazioni dei criteri di Milano e non viene accompagnata da ipertensione portale,[19] in ogni caso le persone a cui si può applicare tale tipo di intervento risultano inferiori al 18%.[20] Recentemente sono stati approvati nuovi criteri che suggeriscono come unica controindicazione alla chirurgia epatica la presenza di massa epatica funzionante inferiore al 30% nel postoperatorio.
L'epatectomia regolata deve fare attenzione alla quantità eventuale di parenchima da asportare che non deve superare il 20%. Spesso tale pratica viene utilizzata per anticipare un possibile trapianto successivo,[21] mentre viene scartata la possibilità tumorectomia. La sopravvivenza in seguito a procedure di resezione in casi di masse di notevoli dimensioni scende notevolmente, arrivando al 17% a 5 anni.
Trapianto
[modifica | modifica wikitesto]Il trapianto epatico previsto nei casi di presenza di cirrosi sia di livello moderato sia grave,[22] ma entrambe forniscono raramente i risultati sperati.
Nel caso di valutazione per un possibile trapianto di fegato occorrono altri esami per escludere il coinvolgimento di altri organi, in tali casi si effettua la scintigrafia ossea e nell'attesa di effettuare l'operazione vengono monitorate le condizioni della persona ripetendo alcuni esami (come nel caso della risonanza magnetica ogni tre mesi). La lista segue le condizioni "MELD" (Model for End stage Liver Disease) cambiata nel corso del tempo per adeguarsi alla mortalità (lo stesso sistema viene utilizzato in Italia).
Il "MELD" è stato progettato per prevedere la prognosi dei pazienti affetti da epatopatia cronica. Oggigiorno viene utilizzato per la valutazione della necessità di trapianto di fegato al posto del punteggio Child-Pugh. Rispetto a quest'ultimo il MELD possiede un range di valori più ampio inoltre rappresenta un mezzo di valutazione più oggettivo. Viene calcolato utilizzando tre variabili: creatinina, bilirubina sierica, il tempo di protrombina (espresso come INR International Normalized Ratio).
È calcolato secondo la seguente formula: MELD = 3,78 [Ln bilirubina sierica (mg/dL)] + 11,2 [Ln EUR] + 9,57 [Ln creatinina sierica (mg/dL)] + 6,43
- Se il paziente è stato dializzato due volte negli ultimi 7 giorni, allora il valore di creatinina sierica utilizzato deve essere 4,0
- Qualsiasi valore inferiore è dato un valore di 1 (cioè se bilirubina è 0,8, il valore di 1,0 è utilizzato) per impedire il verificarsi di punteggi inferiori a 0 (il logaritmo naturale di 1 è 0, e qualsiasi valore inferiore a 1 produrrebbe un risultato negativo).
Terapia non chirurgica
[modifica | modifica wikitesto]Molti sono i trattamenti non chirurgici sperimentati:
- Radioterapia, utilizzata raramente per via degli effetti nocivi di dosi superiori ai 30 Gy.
- Chemioembolizzazione (TACE)
- Radiembolizzazione (TARE)
- Ablazione laser (Terapia Termoablativa Laser, termoterapia interstiziale laser o termoablazione percutanea), tecnica mini invasiva, ben tollerata dal paziente, applicabile in assenza di indicazioni all'intervento chirurgico resettivo e al fine di contenere la progressione della malattia in attesa del trapianto.[23][24]
- Alcolizzazione (PEI), procedura non invasiva dai notevoli risultati, si procede con iniezione percutanea di etanolo. Fra gli effetti collaterali febbre e dolore (ma compaiono raramente).
- Radiofrequenza (RF), con risultati superiori al PEI nel caso di masse di piccole dimensioni.[25]
- Ormonoterapia, provata con diversi studi, si è visto che la somministrazione di tamoxifen non ha portato alcun risultato[26], mentre sono in corso di sperimentazione somatostatina e octreotide.
- Interventi nutrizionali (assunzione di vitamina K), dimostratasi inefficace.
Chemioterapia
[modifica | modifica wikitesto]Sono state studiate associazioni tra vari chemioterapici antiblastici (l'adriamicina, la gemcitabina e l'oxaliplatino). È stata anche tentata l'infusione intrarteriosa ripetuta di zinostatina stimalamer (SMANCS), un derivato della zinostatina coniugato con un polimero di stirene-acido maleico, ma i risultati sono stati modesti.[27][28] Migliori risultati sono stati ottenuti con farmaci chemioterapici inibenti la neoangiogenesi tumorale; attualmente sono stati approvati per l'uso clinico due molecole chemioterapiche: sorafenib, per il trattamento dell'epatocarcinoma avanzato in assenza di cirrosi o cirrosi epatica Child-Pugh A, con un aumento di circa tre mesi della sopravvivenza media e del tempo di progressione radiologica, e regorafenib come trattamento di seconda linea in pazienti precedentemente trattati con sorafenib[29].
Complicanze
[modifica | modifica wikitesto]Fra le varie complicanze possibili, la comparsa di ittero e la sindrome di Budd-Chiari, mentre raramente si assiste alla rottura della massa.
Prevenzione
[modifica | modifica wikitesto]La malattia viene in parte prevenuta grazie alla vaccinazione per l'epatite B. E nell'evitare i fattori di rischio come l'esposizione all'aflatossina e l'alcolismo cronico. Pazienti con cirrosi devono evitare il consumo di alcool. Inoltre lo screening per l'emocromatosi potrebbe essere utile per alcuni pazienti per identificare condizioni di rischio[30].
Prognosi
[modifica | modifica wikitesto]Al 2014, gli studi ancora sono aperti e non controllati e non tutti i tumori hanno la stessa evolutività. La sopravvivenza dipende da numerosi fattori: dal numero dei noduli, dal tessuto funzionale epatico e dalle dimensioni del tumore. A tre anni la sopravvivenza è del 55-75%, ma a cinque anni dalla diagnosi essa è in genere molto bassa, anche perché la malattia viene spesso scoperta quando è già estesa. La sopravvivenza è migliore se il paziente viene trattato.
Per masse inferiori a 5 cm in classe A si ha come percentuale di sopravvivenza a 5 anni: dopo resezione del tumore, il 49%; dopo PEI, il 48%; dopo embolizzazione, il 44%; e dopo il trapianto di fegato, il 70%.
In caso di presenza di recidiva (cioè riappare un nuovo tumore dopo il trattamento/intervento, distinto dal primitivo), o di metastasi, la sopravvivenza a cinque anni si riduce: dopo PEI, 5%; per metastasi il 17-46% e per recidiva (tumore nuovo), il 5-50%.
Note
[modifica | modifica wikitesto]- ^ Sun VC, Sarna L., Symptom management in hepatocellular carcinoma., in Clin J Oncol Nurs., vol. 12, 1973, pp. 759-66.
- ^ WHO Disease and injury country estimates, su World Health Organization, 2009. URL consultato l'11 novembre 2009.
- ^ Una stima bassa rispetto ad altri paesi. La mortalità è del 2,9% delle morti per tumore. Come da US Mortality Public Use Data Tables, 1969–2004, National Center for Health Statistics, Centers for Disease Control and Prevention 2006
- ^ Rustgi VK., Epidemiology of hepatocellular carcinoma., in Gastroenterol Clin North Am., vol. 16, dicembre 1987, pp. 545-51.
- ^ Wu PC. Hepatocellular carcinoma: epidemiology and pathology. Hong Kong Pract. 1983;5:790–5.
- ^ Gianni Bonadonna, Gioacchino Robustelli Della Cuna, Pinuccia Valgussa, Medicina oncologica (8ª edizione) p.1040, Milano, Elsevier Masson, 2007, ISBN 978-88-214-2814-2.
- ^ Fan ST, Wong J. Terblanche J. Churchill Livingstone; London: 1996. Hepatocellular carcinoma in the East, Hepatobiliary malignancy; pp. 169–83.
- ^ Orphanet: Epatocarcinoma, su orpha.net. URL consultato il 5 febbraio 2019.
- ^ Fra gli studi condotti a dimostrazione del collegamento fra epatite B e carcinoma epatocellulare quello effettuato su più di 22.000 nello stato di Taiwan Beasley RP, Hwang LY, Lin CC, Chien CS., Hepatocellular carcinoma and hepatitis B virus. A prospective study of 22 707 men in Taiwan., in Lancet., vol. 2, 1981, pp. 1129-1133.
- ^ Yuan JM, Govindarajan S, Ross RK, Yu MC., Chronic infection with hepatitis G virus in relation to hepatocellular carcinoma among non-Asians in Los Angeles County, California., in Cancer., vol. 86, 1999, pp. 936-43.
- ^ Kim B, Park SH, Yang HR, Seo JK, Kim WS, Chi JG., Hepatocellular carcinoma occurring in alagille syndrome., in Pathol Res Pract., vol. 201, 2005, pp. 55-60.
- ^ Harada M.., Wilson disease and hepatocellular carcinoma., in Intern Med., vol. 43, novembre 2004.
- ^ P Bhosale, J Szklaruk, P M Silverman, Current staging of hepatocellular carcinoma: imaging implications, in Cancer Imaging, vol. 6, 2006.
- ^ Zhou L, Rui JA, Wang SB, Chen SG, Qu Q., LCSGJ-T Classification, 6th or 5th Edition TNM Staging Did Not Independently Predict the Long-Term Prognosis of HBV-Related Hepatocellular Carcinoma After Radical Hepatectomy., in J Surg Res. ., ottobre 2008.
- ^ Minagawa M, Ikai I, Matsuyama Y, Yamaoka Y, Makuuchi M., Staging of hepatocellular carcinoma: assessment of the Japanese TNM and AJCC/UICC TNM systems in a cohort of 13,772 patients in Japan, in Ann Surg. ., vol. 245, giugno 2007, pp. 909-22.
- ^ Huo TI, Hsia CY, Huang YH, Lin HC, Lee PC, Lui WY, Chiang JH, Chiou YY, Loong CC, Lee SD., Selecting a Short-term Prognostic Model for Hepatocellular Carcinoma: Comparison Between the Model for End-stage Liver Disease (MELD), MELD-sodium, and Five Cancer Staging Systems, in J Clin Gastroenterol., 2009.
- ^ Pons F, Varela M, Llovet JM., Staging systems in hepatocellular carcinoma., in HPB (Oxford)., vol. 7, 2005, pp. 35-41.
- ^ Choi GH, Han DH, Kim DH, Choi SB, Kang CM, Kim KS, Choi JS, Park YN, Park JY, Kim DY, Han KH, Chon CY, Lee WJ., Outcome after curative resection for a huge (>/=10 cm) hepatocellular carcinoma and prognostic significance of gross tumor classification., in Am J Surg., 2009.
- ^ Said A, Wells J., Management of hepatocellular carcinoma., in Minerva Med., vol. 100, 2009, pp. 51-68.
- ^ Hung H., Treatment modalities for hepatocellular carcinoma., in Curr Cancer Drug Targets., vol. 5, 2005, pp. 131-8.
- ^ Kamiyama T, Nakanishi K, Yokoo H, Kamachi H, Tahara M, Suzuki T, Shimamura T, Furukawa H, Matsushita M, Todo S., Recurrence Patterns After Hepatectomy of Hepatocellular Carcinoma: Implication of Milan Criteria Utilization., in Ann Surg Oncol., 2009.
- ^ Cunningham SC, Tsai S, Marques HP, Mira P, Cameron A, Barroso E, Philosophe B, Pawlik TM., Management of Early Hepatocellular Carcinoma in Patients with Well-Compensated Cirrhosis., in Ann Surg Oncol., 2009.
- ^ Pacella CM , Francica G , Di Lascio FM , Arienti V , Antico E , Caspani B , Magnolfi F , Megna AS , Pretolani S , Regine R , Sponza M , Stasi R ., Long-term outcome of cirrhotic patients with early hepatocellular carcinoma treated with ultrasound-guided percutaneous laser ablation: a retrospective analysis., in J Clin Oncol., 16:2615-21, giugno 2009.
- ^ Pompili M , Pacella CM , Francica G , Angelico M , Tisone G , Craboledda P , Nicolardi E , Rapaccini GL , Gasbarrini G ., Percutaneous laser ablation of hepatocellular carcinoma in patients with liver cirrhosis awaiting liver transplantation., in Eur J Radiol., 74(3):e6-e11, giugno 2010.
- ^ Orlando A, Leandro G, Olivo M, Andriulli A, Cottone M., Radiofrequency thermal ablation vs. percutaneous ethanol injection for small hepatocellular carcinoma in cirrhosis: meta-analysis of randomized controlled trials., in Am J Gastroenterol., vol. 104, febbraio 2009, pp. 514-24.
- ^ Roxburgh P, Evans TR., Systemic therapy of hepatocellular carcinoma: Are we making progress?, in Adv Ther. 2008, vol. 25, novembre 2008, pp. 1089-104..
- ^ T. Okusaka, S. Okada; H. Ishii; M. Ikeda; H. Nakasuka; H. Nagahama; R. Iwata; H. Furukawa; K. Takayasu; Y. Nakanishi; M. Sakamoto, Transarterial chemotherapy with zinostatin stimalamer for hepatocellular carcinoma., in Oncology, vol. 55, n. 4, pp. 276-83, PMID 9663415.
- ^ T. Okusaka, S. Okada; H. Ueno; M. Ikeda; R. Iwata; H. Furukawa; K. Takayasu; N. Moriyama; T. Sato; K. Sato, Transcatheter arterial embolization with zinostatin stimalamer for hepatocellular carcinoma., in Oncology, vol. 62, n. 3, 2002, pp. 228-33, PMID 12065870.
- ^ (EN) Center for Drug Evaluation and Research, Regorafenib, in FDA, 3 maggio 2023. URL consultato il 14 settembre 2023.
- ^ Prevention, su nlm.nih.gov. URL consultato il 12 maggio 2010.
Bibliografia
[modifica | modifica wikitesto]- Gianni Bonadonna, Gioacchino Robustelli Della Cuna, Pinuccia Valgussa, Medicina oncologica (8ª edizione), Milano, Elsevier Masson, 2007, ISBN 978-88-214-2814-2.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su carcinoma epatocellulare
Wikimedia Commons contiene immagini o altri file su carcinoma epatocellulare
Collegamenti esterni
[modifica | modifica wikitesto]- Avere fegato è una questione di cervello, su averefegato.net. URL consultato il 15 settembre 2009 (archiviato dall'url originale il 9 agosto 2009).
- La chirurgia del fegato, su chirurgiadelfegato.it.
- Conoscere e prevenire le malattie del fegato, su malattiedelfegato.blogspot.com.
- Centro per lo studio e la cura dei tumori del fegato, su fegatochirurgia.com.
- Chirurgia Epatobiliare, Ospedale San Raffaele, Milano https://www.hsr.it/strutture/ospedale-san-raffaele/chirurgia-epatobiliare