Elettrochimica


L'elettrochimica è quella branca della chimica che si occupa dei processi che coinvolgono il trasferimento di elettroni tramite un circuito elettrico esterno e non per scambio diretto come per le reazioni di ossidoriduzione (dette comunemente redox). Tratta quindi le trasformazioni chimiche prodotte dal passaggio di elettricità in determinati sistemi chimici e la produzione/immagazzinamento di elettricità per mezzo di trasformazioni chimiche.
Oltre ad avere numerose applicazioni, l'elettrochimica fornisce i mezzi per indagare e regolare fenomeni quali la corrosione dei metalli, la loro raffinazione, e la maggior parte delle reazioni biochimiche che presiedono al funzionamento degli organismi viventi (ad esempio: la fotosintesi, la respirazione cellulare, la trasmissione degli impulsi nervosi). Mentre l'elettrosintesi permette di sfruttare l'energia elettrica per scopi sintetici, la chimica elettroanalitica permette di sfruttare i principi dell'elettrochimica applicati all'analisi chimica. L'elettrochimica si occupa anche di studiare tutti i fenomeni e le possibili applicazioni della conduzione di corrente da parte degli elettroliti.
Storia
[modifica | modifica wikitesto]
Le prime osservazioni degli effetti fisiologici della corrente elettrica furono dimostrati da Luigi Galvani durante esperimenti sulla muscolatura delle rane nel tardo '700.[2][3] La prima conversione dell'energia chimica in energia elettrica fu realizzata da Alessandro Volta nel 1799 con l'invenzione della pila.[4] Questa invenzione rappresentò un'importante fonte di corrente elettrica, prima dell'avvento del generatore. Il chimico inglese William Nicholson e il chimico tedesco Johann Wilhelm Ritter furono i primi ad effettuare l'elettrolisi dell'acqua, nel 1800, decomponendola in idrogeno ed ossigeno gassosi che Ritter riuscì ad isolare.[5] Proprio lavorando con l'elettrolisi, Sir Humphry Davy isolò il sodio, il potassio e i metalli alcalino terrosi a partire dai loro composti (1808).[6][7]
Nel 1832 Michael Faraday (che coniò termini quali elettrolita, elettrodo, anodo, catodo, catione, anione[8]) enunciò le leggi fondamentali dell'elettrolisi che portano il suo nome.[9] John Daniell, nel 1836, creò una pila, che porta il suo nome,[10] utilizzando come prototipo la pila di Volta e con accorgimenti costruttivi che conferiscono un migliore voltaggio legato all'assenza di polarizzazione dovuta allo sviluppo di idrogeno gassoso. Nel 1866 Georges Leclanché inventò l'antecedente della pila a secco[11] che sarà il prototipo delle future pile zinco-carbone. William Grove realizzò la prima pila a combustibile nel 1839, tecnologia che nel secolo successivo verrà utilizzata per fornire energia nelle missioni spaziali.[12]
Nel 1884 Svante August Arrhenius pubblicò i suoi studi riguardanti le proprietà degli elettroliti, mentre dieci anni più tardi Wilhelm Ostwald stabilì la relazione esistente tra la conduttività ionica e il grado di dissociazione. Walther Hermann Nernst, nel 1889, formulò l'equazione di Nernst, stabilendo il rapporto esistente tra l'energia libera di Gibbs relativa ad una reazione redox ed il potenziale elettrico di una cella galvanica che sfrutta la medesima reazione.
Nel 1922 Jaroslav Heyrovský, futuro premio Nobel, inventò l'elettrodo a goccia di mercurio e segnò l'inizio della moderna chimica elettroanalitica. Arne Tiselius sviluppò la tecnica elettroforetica nel 1937 e ricevette, undici anni dopo, il premio Nobel per il suo lavoro sull'elettroforesi delle proteine. Negli anni sessanta, grazie al lavoro di Revaz Dogonadze, nacque l'elettrochimica quantistica.
Concetti fondamentali
[modifica | modifica wikitesto]Reazione redox
[modifica | modifica wikitesto]Una reazione redox (o di ossidoriduzione) è una reazione chimica che avviene con cambiamento del numero di ossidazione dei reagenti dovuto a scambio di elettroni diretto in situ . La specie chimica, che acquista elettroni, diminuendo il suo numero di ossidazione, si riduce e viene detta ossidante in quanto, riducendosi, provoca ossidazione. Di contro, una specie, che cede elettroni, aumentando il suo numero di ossidazione, si ossida e viene detta riducente in quanto provoca riduzione, ossidandosi. I due fenomeni ossidazione e riduzione devono essere contemporanei e non possono esistere l'uno senza l'altro.
Un esempio di reazione redox è il seguente:
qui l'atomo di azoto del nitrobenzene C6H5NO2 acquista 6 elettroni, passando da un numero di ossidazione +3 a -3, è la specie che si riduce e, quindi, è la specie ossidante; il ferro, che cede 3 elettroni passando da numero di ossidazione 0 a +3, è la specie che si ossida, e quindi è la specie riducente . La reazione è condotta in ambiente acido (in particolare in acido cloridrico). C6H5NH2/C6H5NO2 e Fe2+/Fe rappresentano due coppie redox.
Potenziale standard di riduzione
[modifica | modifica wikitesto]Il potenziale standard di riduzione (simboleggiato comunemente con E°) è una grandezza di fondamentale importanza in elettrochimica. Concettualmente rappresenta il potenziale assunto da un elettrodo in esame, in condizioni di temperatura e pressione standard (298K e 1 atm), con attività unitaria delle specie redox, riferito all'elettrodo standard a idrogeno. Oltre a essere impiegato nel calcolo delle proprietà termodinamiche di un equilibrio chimico, la valutazione del potenziale standard di riduzione permette anche di prevedere la spontaneità di una data reazione redox.
Dai potenziali standard di riduzione, tramite l'equazione di Nernst è possibile risalire al potenziale di cella all'equilibrio, da cui si ottiene il valore del potenziale di cella tenendo conto degli effetti dissipativi delle sovratensioni e delle cadute ohmiche.[13]
Applicazioni
[modifica | modifica wikitesto]Conversione dell'energia chimica in energia elettrica
[modifica | modifica wikitesto]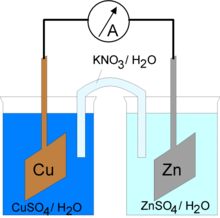
Utilizzando due semielementi galvanici collegati tramite setto poroso o ponte salino, è possibile costituire un sistema elettrochimico in grado di convertire l'energia chimica in energia elettrica. Le reazioni redox spontanee possiedono variazione di energia libera di Gibbs negativa e tale energia può essere sfruttata per produrre lavoro. In particolare, chiudendo il circuito formato dai due semielementi galvanici si possono sfruttare gli elettroni messi in gioco generando un flusso esterno di corrente elettrica. Un siffatto sistema costituisce una "pila".
Per capire ciò che accade all'interno di una semicella galvanica, si consideri ad esempio una pila Daniell: essa è composta da due semicelle, delle quali una semicella è costituita da un elettrodo di zinco immerso in una soluzione di ZnSO4, mentre l'altra semicella è costituita da un elettrodo di rame immerso in una soluzione di CuSO4.
Tra i due elettrodi si stabilirà una differenza di potenziale: lo zinco (anodo) tenderà a liberare in soluzione ioni Zn2+ mentre la matrice dell'elettrodo tende ad assumere carica negativa (dovuta alla liberazione di cationi), in tal modo viene a crearsi un potenziale anodico di semicella; nello stesso modo ioni Cu2+ tendono a depositarsi sull'elettrodo di rame (catodo) provocando un eccesso di cariche negative in soluzione e un accumulo di cariche positive sul catodo, con la conseguente generazione di un potenziale catodico. Chiudendo il circuito si otterrà quindi una corrente elettrica dovuta a una differenza di potenziale teorica data dalla differenza tra il valore del potenziale catodico e il valore del potenziale anodico (E = E+-E-), con migrazione di elettroni dall'anodo di zinco al catodo di rame.
L'uso di un setto poroso, o meglio di un ponte salino, mantiene il contatto tra le due semicelle impedendo il mescolamento e assicurando il bilanciamento delle cariche in eccesso presenti in soluzione permettendo il flusso di ioni. Il ponte salino inoltre evita che si crei il cosiddetto potenziale di contatto dovuto alla differente velocità di migrazione posseduta da ioni differenti e che in pratica genera una forza controelettromotrice dovuta alla distribuzione asimmetrica degli ioni sull'interfaccia del setto poroso.
Conversione dell'energia elettrica in energia chimica
[modifica | modifica wikitesto]
L'energia elettrica può essere sfruttata per fornire il lavoro necessario affinché avvenga una reazione redox energeticamente sfavorita e non spontanea (ΔGr° > 0). Questo rappresenta il caso opposto della pila e trova diverse applicazioni pratiche. L'elettrolisi rappresenta un esempio classico di conversione di energia elettrica in energia chimica e può essere utilizzata, ad esempio, per produrre idrogeno gassoso dall'acqua, per la raffinazione dei metalli o per scopi sintetici come nel caso della sintesi industriale dell'idrossido di sodio. Le leggi di Faraday descrivono quantitativamente il processo di elettrolisi: la prima legge afferma che la quantità di sostanza prodotta è direttamente proporzionale alla quantità di carica fatta passare, mentre la seconda legge stabilisce che a parità di tale carica si ottiene una maggiore quantità di sostanza maggiore è il suo peso equivalente. In chimica analitica l'elettrogravimetria permette la determinazione quantitativa accurata di concentrazioni di metalli in soluzione, con la possibilità di poterne determinare anche il livello di purezza (ad esempio, analisi delle leghe).
Le batterie ricaricabili vengono rigenerate applicando una corrente elettrica, mentre l'elettrosintesi sfrutta tale corrente a scopo sintetico.
Protezione dalla corrosione
[modifica | modifica wikitesto]
Il fenomeno della corrosione a cui sono soggetti metalli e leghe rappresenta uno dei principali problemi in grado di compromettere la corretta funzionalità e tenuta dei materiali utilizzati comunemente in ambito ingegneristico, arrivando anche a rappresentare una delle potenziali cause di incidenti mortali qualora la corrosione protratta porti a un cedimento strutturale. Ciò può verificarsi per il semplice contatto atmosferico, a causa di agenti chimici (si pensi alle tubazioni delle industrie chimiche che trasportano agenti corrosivi) o per depositi di calcare (problema spesso riscontrato in apparecchi quali le caldaie o tubazioni in cui fluisce acqua). Un campo di ricerca interdisciplinare molto attivo riguarda proprio lo studio dei metodi di protezione dalla corrosione.
Tecniche elettroanalitiche
[modifica | modifica wikitesto]In ambito analitico esistono un insieme di tecniche applicative fondate sui principi dell'elettrochimica. Queste sono di vario tipo e sfruttano la relazione esistente tra la concentrazione dell'analita e grandezze quali la differenza di potenziale, la conduttanza elettrica, la quantità di corrente trasportata ecc. La diversa velocità di migrazione sotto l'azione di un campo elettrico è utilizzata dall'elettroforesi per separare specie cariche, mentre l'elettrogravimetria consente di determinare per via ponderale la quantità di analita ridottosi al catodo di una cella elettrolitica.
Applicazioni elettrometallurgiche
[modifica | modifica wikitesto]
Le applicazioni elettrometallurgica includono l'elettroriduzione e la raffinazione elettrolitica; grazie all'elettroriduzione vengono prodotti metalli dalla riduzione dei minerali che li contengono (quindi anodo e catodo hanno natura chimica differente), mentre la raffinazione elettrolitica è un processo di purificazione del metallo stesso (quindi anodo e catodo sono costituiti dallo stesso metallo, ma a purezza differente), con il quale si possono raggiungere purezze maggiori del 99,99%.
L'elettroriduzione dell'alluminio è uno dei processi elettrochimici eseguiti su più vasta scala. Anche i metalli alcalini, alcalino terrosi e metalli quali titanio, rame, nichel e cromo sono prodotti per elettroriduzione. Questa tecnica si adotta o perché per essi il carbonio non ha un potere sufficientemente riducente neanche negli altoforni, oppure perché è richiesta elevata purezza. In generale, partendo da un minerale quale fonte, prima di ottenere per via elettrochimica l'elemento di interesse è necessario effettuare la lisciviazione seguita dalla concentrazione e purificazione.
La raffinazione elettrolitica viene utilizzata per purificazione del rame, per estrarre uranio dalle scorie radioattive (contenenti impurezze di plutonio, cesio e stronzio) o per sottrarre metalli tossici o preziosi dalle correnti di scarto di origine industriale.
Produzione di acido perossidisolforico e perossidisolfati
[modifica | modifica wikitesto]Trattamenti elettrochimici delle acque
[modifica | modifica wikitesto]Purificazione di gas per via elettrochimica
[modifica | modifica wikitesto]Branche dell'elettrochimica
[modifica | modifica wikitesto]All'interno dell'elettrochimica possono essere individuate varie branche, tra cui:
- energetica elettrochimica: studia i processi elettrochimici che avvengono all'equilibrio (ad esempio nelle celle galvaniche a circuito aperto);
- cinetica elettrochimica: studia i processi elettrochimici che avvengono in condizioni di non equilibrio (ad esempio il fenomeno dell'elettrocatalisi);
- ionica: studia i processi elettrochimici che avvengono all'interno di un elettrolita;
- elettrodica: studia i processi elettrochimici che avvengono in corrispondenza della superficie di un elettrodo;
- elettrochimica analitica (o chimica elettroanalitica): studia i metodi elettroanalitici, che hanno lo scopo di determinare la presenza e la concentrazione di specie elettroattive (ioni) all'interno di una soluzione elettrolitica;
- elettrochimica quantistica;
- elettrochimica organica: studia le reazioni organiche che avvengono all'interno di celle elettrochimiche;
- bioelettrochimica;
- fotoelettrochimica.
Note
[modifica | modifica wikitesto]- ^ (EN) Electrochemistry, Theoretical Electrochemistry and its physico-chemical foundations, Heinrich Daneell (1907).
- ^ Il dibattito Volta-Galvani
- ^ La rana elettrica La disputa Galvani – Volta e l'invenzione della pila Archiviato l'11 novembre 2013 in Internet Archive.
- ^ 1799-1999 I duecento anni della pila di Volta Archiviato il 30 giugno 2007 in Internet Archive.
- ^ I risultati applicativi inaspettati della ricerca fondamentale (PDF), su roma1.infn.it. URL consultato il 1º maggio 2010 (archiviato dall'url originale il 17 aprile 2015).
- ^ Sir Humphry Davy[collegamento interrotto]
- ^ Open Site - Elementi
- ^ Zoski, p. 3.
- ^ Storia della chimica e della scienza. Biografie di scienziati. Faraday, Michael, su minerva.unito.it. URL consultato il 1º maggio 2010 (archiviato dall'url originale il 25 febbraio 2009).
- ^ Evoluzione della pila - Pila Daniell, su museo.liceofoscarini.it. URL consultato il 1º maggio 2010 (archiviato dall'url originale il 14 novembre 2010).
- ^ Pila a secco allo zinco-carbone, su ing.unitn.it. URL consultato il 1º maggio 2010 (archiviato dall'url originale il 19 dicembre 2010).
- ^ Celle (o pile) a combustibile Archiviato il 2 giugno 2010 in Internet Archive.
- ^ Ullmann's, cap. 2.
Bibliografia
[modifica | modifica wikitesto]- Giuseppe Bianchi, Torquato Mussini, Elettrochimica, Elsevier, 1976, ISBN 88-214-0500-1.
- (EN) Cynthia G. Zoski, Handbook of Electrochemistry, Elsevier Science, 2007, ISBN 978-0-444-51958-0.
- (EN) Vladimir S. Bagotsky, Fundamentals of Electrochemistry (PDF), 2ª ed., Wiley-Interscience, 2005, ISBN 978-0-471-70058-6 (archiviato dall'url originale il 12 giugno 2010).
- (EN) John O'M. Bockris, Amulya K. N. Reddy, Modern Electrochemistry: An introduction to an interdisciplinary area - Volume 1, Plenum Press, 1977, ISBN 0-306-25001-2.
- (EN) John O'M. Bockris, Amulya K. N. Reddy, Modern Electrochemistry: An introduction to an interdisciplinary area - Volume 2, Plenum Press, 1977, ISBN 0-306-25002-0.
- (EN) Carl H. Hamann, Andrew Hamnett, Wolf Vielstich, Electrochemistry, 2ª ed., Wiley-VCH, 2007, ISBN 3-527-31069-X. URL consultato il 30 novembre 2010 (archiviato dall'url originale il 7 marzo 2016).
- (EN) Hartmut Wendt, Ullmann's Encyclopedia of Industrial Chemistry, "Electrochemistry", 7ª ed., Wiley-VCH, 2004, DOI:10.1002/14356007.a09_183.
- (EN) Encyclopedia of 20th Century Technology - "Electrochemistry", Londra, Routledge, 2005.
Riviste
[modifica | modifica wikitesto]- Bioelectrochemistry (1974- ), Elsevier.
- Electroanalysis (1989- ), Wiley.
- Electrochemical and Solid State Letters (1998- ), The Electrochemical Society.
- Electrochemistry Communications (1999- ), Elsevier.
- Electrochimica Acta (1959- ), Elsevier.
- Journal of Applied Electrochemistry (1971- ), Kluwer Academic Publishers.
- Journal of Electroanalytical Chemistry and Interfacial Chemistry (1959–1992),
- Journal of Electroanalytical Chemistry (1992- ), Elsevier.
- Journal of the Electrochemical Society (1902- ), The Electrochemical Society.
- Journal of Solid State Electrochemistry (1997- ), Springer-Verlag.
Voci correlate
[modifica | modifica wikitesto]- Cataforesi
- Cinetica elettrochimica
- Conduttività ionica
- Elettrocatalisi
- Galvanoplastica
- Galvanostegia
- International Society of Electrochemistry
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «elettrochimica»
Wikizionario contiene il lemma di dizionario «elettrochimica» Wikimedia Commons contiene immagini o altri file su elettrochimica
Wikimedia Commons contiene immagini o altri file su elettrochimica
Collegamenti esterni
[modifica | modifica wikitesto]- elettrochimica, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) electrochemistry, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Quaderni di analisi chimica strumentale - Elettrochimica (PDF), su uniroma2.it. URL consultato il 19 ottobre 2010 (archiviato dall'url originale il 7 aprile 2017).
- CNR (Dipartimento di progettazione molecolare) - Elettrochimica (PDF), su dpm.cnr.it. URL consultato il 19 ottobre 2010 (archiviato dall'url originale il 12 agosto 2011).
- CNR (Dipartimento di progettazione molecolare) - Esercizi di elettrochimica (con risultati) (PDF), su dpm.cnr.it. URL consultato il 19 ottobre 2010 (archiviato dall'url originale il 6 settembre 2012).
- Fun Science Gallery - Esperienze di elettrochimica, su funsci.com. URL consultato il 19 ottobre 2010 (archiviato dall'url originale il 20 ottobre 2010).
- (EN) Electrochemistry Encyclopedia, su electrochem.cwru.edu. URL consultato il 21 maggio 2011 (archiviato dall'url originale il 14 maggio 2011).
- (EN) The Electrochemical Society, su electrochem.org.
- (EN) International Society of Electrochemistry, su ise-online.org.
- (EN) Society for Electroanalytical Chemistry, su electroanalytical.org.
- Elettrochimica, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 21238 · LCCN (EN) sh85042105 · GND (DE) 4014241-3 · BNF (FR) cb119313445 (data) · J9U (EN, HE) 987007538291205171 · NDL (EN, JA) 00561331 |
|---|
