Perossiacido


In chimica, i perossiacidi (o peracidi, sebbene quest'ultimo termine sia sconsigliato in quanto ambiguo[1]) sono un acidi derivanti dagli ossiacidi per sostituzione formale di un ossidrile (–OH) con il gruppo idroperossidico[2] –O–OH,[3] derivante, a sua volta, dal gruppo caratteristico dei perossidi (–O–O–), il quale conferisce loro scarsa stabilità e forte potere ossidante. Tale sostituzione comporta anche un deciso abbassamento della forza dell'acido, come si può vedere dal confronto tra l'acido trifluoroacetico (CF3COOH, pKa = 0,52[4]) e il perossitrifluoroacetico (CF3COOOH, pKa = 3,7[5]).
Tra i perossiacidi inorganici ci sono l'acido perossiborico H3BO4 [(HO)2B–O–OH], instabile, da cui derivano i suoi sali, detti perborati, molto usati come sbiancanti in lavanderia;[6] l'acido perossinitrico HNO4 (O2N–O–OH)[7] e il perossinitroso HNO3 (formula empirica uguale a quella dell'acido nitrico ma è, strutturalmente, O=N–O–OH),[8] che sono instabili, con i loro anioni perossinitrato e perossinitrito, un po' più stabili, che partecipano in equilibri di interconversione;[9] l'acido perossimonosolforico o acido di Caro H2SO5 (HO–SO2–O–OH) è un po' più stabile, contiene il gruppo idroperossidico, ma gli resta un gruppo ossidrilico[10] ed è perciò teoricamente un acido di forza simile al solforico, anche se in acqua tende a decomporsi reversibilmente in acido solforico e acqua ossigenata:[11]
H2SO5 + H2O ⇄ H2SO4 + H2O2
H2SO5 si può preparare dalla reazione del cloruro dell'acido solforico, ossia l'acido clorosolforico, con perossido di idrogeno:[12]
ClSO3H + H2O2 → H2SO5 + HCl
Aggiungendo un'altra mole di ClSO3H si ottiene l'acido perossidisolforico, che però non risponde alla definizione di perossiacido, non contenendo il gruppo –O–OH:[12]
ClSO3H + H2SO5 → HO–O2S–O–O–SO2–OH + HCl
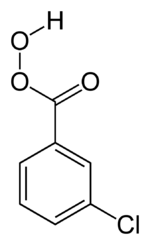
Nei perossiacidi organici il gruppo funzionale –C(=O)O–OH viene a sostituire il gruppo carbossilico –C(=O)OH degli acidi carbossilici.[13] Tra questi, l'acido perossiacetico e il perossitrifluoroacetico sono ben conosciuti e molto usati come ossidanti, anche selettivi, in particolare per le reazioni di epossidazione di olefine o nella reazione di Baeyer-Villiger. Uno dei peracidi più adoperati per la sua facilità di uso è l'acido meta-cloroperossibenzoico.[14][15]
I perossiacidi, essendo agenti ossidanti molto forti, sono piuttosto instabili e tendono a decomporsi nei corrispondenti ossiacidi (–O–OH → –OH) rilasciando ossigeno: per generarli si deve ricorrere spesso ad elettrolisi (ossidazione anodica) ad alta intensità di corrente elettrica.
Note
[modifica | modifica wikitesto]- ^ (EN) IUPAC Gold Book, "per acids"
- ^ (DE) Arnold F. Holleman, Egon Wiberg e Nils Wiberg, Appendice VIII - Nomenclatura Inorganica, in Anorganische Chemie, 103ª ed., De Gruyter, 2017, ISBN 978-3-11-026932-1.
- ^ (EN) Peroxy acid | chemical compound | Britannica, su www.britannica.com. URL consultato il 2 marzo 2023.
- ^ William M. Haynes, David R. Lide e Thomas J. Bruno, CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data., 2016-2017, 97th edition, 2017, ISBN 978-1-4987-5429-3, OCLC 957751024. URL consultato il 2 marzo 2023.
- ^ A Kinetic and Thermodynamic Study of the Reduction of Peroxyacids by Iodide and Aryl Alkyl Sulfides in the Presence of Non-Ionic Surfactants and α-Cyclodextrin - ProQuest, su www.proquest.com. URL consultato il 2 marzo 2023.
- ^ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo e Manfred Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley Interscience, 1999, p. 173, ISBN 0-471-19957-5.
- ^ (EN) Sayuri Miyamoto, Graziella E. Ronsein e Thaís C. Corrêa, Direct evidence of singlet molecular oxygen generation from peroxynitrate, a decomposition product of peroxynitrite, in Dalton Transactions, n. 29, 14 luglio 2009, pp. 5720–5729, DOI:10.1039/B905560F. URL consultato il 2 marzo 2023.
- ^ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo e Manfred Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley Interscience, 1999, p. 333, ISBN 0-471-19957-5.
- ^ (EN) Barbara J. Finlayson-Pitts e James N. Pitts, Preface, Academic Press, 1º gennaio 2000, pp. xvii–xviii, DOI:10.1016/b978-012257060-5/50000-9, ISBN 978-0-12-257060-5. URL consultato il 2 marzo 2023.
- ^ È sia un ossiacido, che un perossiacido.
- ^ (DE) Arnold F. Holleman, Egon Wiberg e Nils Wiberg, Anorganische Chemie, 103ª ed., De Gruyter, 2017, p. 675, ISBN 978-3-11-026932-1.
- ^ a b (DE) Arnold F. Holleman, Egon Wiberg e Nils Wiberg, Anorganische Chemie, 103ª ed., De Gruyter, 2017, pp. 289-290, ISBN 978-3-11-026932-1.
- ^ (EN) IUPAC Gold Book, "peroxy acids" Archiviato il 12 agosto 2011 in Internet Archive.
- ^ 3-Chloroperoxybenzoic acid, MCPBA, meta-Chloroperbenzoic acid, su www.organic-chemistry.org. URL consultato il 2 marzo 2023.
- ^ (EN) PubChem, 3-Chloroperoxybenzoic acid, su pubchem.ncbi.nlm.nih.gov. URL consultato il 2 marzo 2023.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Perossiacido
Wikimedia Commons contiene immagini o altri file su Perossiacido
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) peroxy acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4385954-9 |
|---|