Tetranitruro di tetrazolfo

| Tetranitruro di tetrazolfo | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | S4N4 |
| Massa molecolare (u) | 184,29 |
| Aspetto | solido giallo arancio |
| Numero CAS | |
| PubChem | 141455 |
| SMILES | N1=S=NSN=S=NS1 |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 187 °C (460 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | +460 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
Il tetranitruro di tetrazolfo è il composto inorganico con formula S4N4. In condizioni standard è un solido cristallino giallo arancio. È il più importante dei nitruri di zolfo, composti binari tra zolfo e azoto. Ha attratto molta curiosità perché ha struttura e legami inusuali, ed è il precursore di molti composti S–N.[1][2]
Le impurità di zolfo hanno potere stabilizzante dell'intero composto, che diviene meno soggetto ad esplosione.
Azoto e zolfo hanno valori di elettronegatività simile; in questi casi i due atomi formano spesso una gran numero di strutture con legami covalenti. S4N4 può essere considerato il capostipite di numerosi composti noti S–N e S–NH.
Caratteristiche
[modifica | modifica wikitesto]S4N4 è uno dei più noti composti a gabbia (struttura con simmetria D2d) ed è stato descritto per la prima volta nel 1835 da W. Gregory. Tende a decomposizione esplosiva e termocromismo, che significa un passaggio del composto da incolore (a 77 K) ad un tipico color giallo-arancio (a 298 K, che è pure il colore a temperatura ambiente) fino ad un rosso intenso (a 373 K).[3]
Quando il tetranitruro di tetrazolfo passa allo stato gassoso, in presenza di lana d'argento (da 200 a 300 °C), si scompone formando S2N2.[4]
Il tetranitruro di tetrazolfo sublima a temperature inferiori a 130 °C e a 0.1 mbar di pressione. È insolubile in acqua, negli alcali e negli acidi solo con decomposizione sotto protonazione. Il tetranitruro di tetrazolfo solido di decompone esplodendo (detonazione) quando riscaldato oltre i 130 °C o in caso di impatto (460 kJ/mol).
Il composto gassoso si decompone principalmente oltre i 200 °C in forma S3N3 e S4N2. Sopra i 300 °C si decompone in elementi mononitridici SN.[5]
Il tetranitruro di tetrazolfo è una delle principali materie prime per la produzione di composti di zolfo e azoto, come il trimero ciclico tionitrosilcloruro.[3]
Proprietà fisiche
[modifica | modifica wikitesto]S4N4 è un solido cristallino diamagnetico, stabile all'aria. Avendo una entalpia di formazione di +460 kJ mol−1 è però termodinamicamente instabile perché i prodotti di decomposizione zolfo e azoto elementari sono molto stabili. Questa entalpia endotermica di formazione contribuisce alla sua instabilità intrinseca, e proviene dalla differenza di energia di S4N4 rispetto ai suoi prodotti di decomposizione altamente stabili (zolfo e azoto):
- 2S4N4 → 4N2 + S8
Dato che uno dei prodotti di decomposizione è gassoso, S4N4 è un esplosivo e può detonare se colpito o riscaldato rapidamente, specie se la purezza del composto è alta.[1] Campioni puri tendono ad essere più facilmente esplosivi.
S4N4 è termocromico: cambiando colore da giallo chiaro a –30 °C fino a rosso scuro sopra 100 °C.[1]
Sebbene molte molecole complesse sono instabili in senso termodinamico, possono essere ancora cineticamente stabili, questo è raro nelle composizioni molto semplici, come nel nitruro di zolfo.
Proprietà chimiche
[modifica | modifica wikitesto]Il tetranitruro di tetrazolfo forma cristalli giallo-arancio a struttura ortorombica, gruppo spaziale P mmm, parametri di cella a = 0,847 нм, b = 0,887 нм, c = 0,720 нм, Z = 4.
- Si decompone a caldo:
- Si decompone in acqua calda:
- Reagisce con acidi concentrati caldi:
- Reagisce con gli alcali:
- Reagisce con zolfo disciolto in solfuro di carbonio:
- È un agente ossidante debole:
Reagisce anche nelle seguenti reazioni chimiche complesse, ottenute principalmente in laboratorio o comunque per via sperimentale:
- Dissoluzione di zolfo in ammoniaca liquida con reazione di ioduro d'argento (è più veloce):
- Dissoluzione in ammoniaca liquida:
Struttura
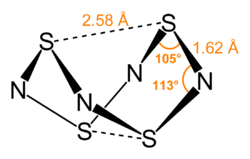
[modifica | modifica wikitesto]Questo composto può essere visto formalmente come un derivato di un ipotetico anello a otto di atomi di zolfo alternati e azoto. Il legame S4N4 è considerato delocalizzate, e questo è indicato dal fatto che le distanze di legame tra atomi di zolfo vicini e atomi di azoto sono quasi le stesse. S4N4 ha una struttura inusuale a culla molto pronunciata, con simmetria D2d. Misure di diffrazione a raggi X indicano che i due atomi di zolfo transannulari sono a distanza di 2,586 Å, in modo tale che la struttura della molecola assomiglia a una gabbia (come determinato dal singolo cristallo di diffrazione ai raggi X).[6] La distanza S–S transannulare rimane oggetto di indagine perché è significativamente minore della somma delle distanze dei raggi di van der Waals, ma è stata spiegata nel contesto della teoria dell'orbitale molecolare.[7] e maggiore di quella prevista da un legame semplice, indicando che tra questi atomi di zolfo esiste una interazione debole ma significativa.[1] Il legame in S4N4 si considera delocalizzato, come indicato dalle distanze tutte uguali tra atomi di zolfo e azoto adiacenti.
Sintesi
[modifica | modifica wikitesto]S4N4 fu preparato per la prima volta da W. Gregory nel 1835,[8] facendo reagire S2Cl2 con ammoniaca. In seguito è stato usato anche SCl2.[9] I meccanismi di reazione non si conoscono, ma la stechiometria complessiva è:
- 6 S2Cl2 + 16 NH3 → S4N4 + S8 + 12 NH4Cl
- 24 SCl2 + 64 NH3 → 4S4N4 + S8 + 48 NH4Cl
Un'altra sintesi simile usa invece S2Cl2 e cloruro d'ammonio:[1]
- 4 NH4Cl + 6 S2Cl2 → S4N4 + 16 HCl + S8
Una sintesi più recente usa [(Me3Si)2N]2S come precursore con legami S–N preformati. [(Me3Si)2N]2S si ottiene facendo reagire bis(trimetilsilil)ammide di litio e SCl2:
- 2 [Me3Si]2NLi + SCl2 → [(Me3Si)2N]2S + 2 LiCl
[(Me3Si)2N]2S reagisce quindi con SCl2 e SO2Cl2 per formare S4N4, trimetilclorosilano e diossido di zolfo:[10]
- [(Me3Si)2N]2S + SCl2 + SO2Cl2 → S4N4 + 4 Me3SiCl + SO2
Il tetranitruro di tetrazolfo può essere ottenuto anche con ammoniaca in aggiunta a cloruro di metilene e seguita da ricristallizzazione in toluene per reazione di zolfo (II), cloruro di zolfo (I) e miscela cloruro.[3]
Inoltre è possibile riscontrare una reazione dello zolfo con l'ammoniaca liquida in presenza di nitrato d'argento.[5]
Reattività
[modifica | modifica wikitesto]Reazioni acido-base
[modifica | modifica wikitesto]
S4N4 può funzionare come base di Lewis e legare con l'azoto acidi di Lewis forti come SbCl5, BF3 e SO3. Nell'addotto la struttura a gabbia di S4N4 viene distorta, e quindi si può perdere la delocalizzazione degli elettroni.[1]
- S4N4 + SbCl5 → S4N4·SbCl5
- S4N4 + SO3 → S4N4·SO3
S4N4 può essere protonato con HBF4 per formare un sale tetrafluoroborato:
- S4N4 + HBF4 → [S4N4H]+[BF4]–
L'acido di Lewis debole CuCl forma un polimero dove anelli intatti S4N4 funzionano da leganti a ponte:[1]
- n S4N4 + n CuCl → (μ-S4N4)n(-Cu-Cl-)n
In presenza di basi S4N4 è sensibile all'idrolisi. Con NaOH diluita l'idrolisi porta a tiosolfato e tritionato:[1]
- 2S4N4 + 6 OH− + 9H2O → S2O32– + 2 S3O62– + 8 NH3
Se la base è più concentrata si ottiene tiosolfato e solfito:
- S4N4 + 6 OH– + 3 H2O → S2O32– + 2 SO32– + 4 NH3
Reazioni con complessi metallici
[modifica | modifica wikitesto]Questo argomento è stato recensito;[2][11] esistono reazioni dove l'anello S4N4 rimane quasi intatto e reazioni dove l'anello viene rotto.
Ad esempio, S4N4 dà addizione ossidativa con il complesso di Vaska, Ir(CO)(Cl)(PPh3)2, per formare un complesso esacoordinato di iridio dove S4N4 è legato con due atomi di zolfo e uno di azoto. Il composto si forma rompendo uno dei legami S–N durante l'addizione ossidativa; il secondo atomo di zolfo appartiene all'anello e si coordina con un doppietto non condiviso. A partire dal sale di Zeise si ottiene un analogo complesso di Pt(IV). La reazione tra S4N4 e [Pd2Cl6]2− porta invece a una serie di tre complessi di palladio dove l'anello S4N4 è stato frammentato.
Come precursore di altri composti S–N
[modifica | modifica wikitesto]A partire da S4N4 si preparano molti composti S–N importanti.[12] La reazione con piperidina produce [S4N5]−:
- 3S4N4 + 4C5H10NH → (C5H10NH2)+[S4N5]− + (C5H10N)2S + ⅜S8 + N2
Ad indicare la ricchezza di quest'area, è noto anche il catione [S4N5]+.
La reazione con l'azide di tetrametilammonio produce l'eterociclo [S3N3]−:
- S4N4 + NMe4N3 → NMe4[S3N3] + ⅛S8 + 2 N2

Per quanto riguarda il conteggio degli elettroni, [S3N3]− ha 10 elettroni pi greco: due per ogni S, più uno per ogni N, più uno per la carica negativa.
In una reazione apparentemente simile, con [(Ph3P)2N]N3 si ottiene un sale contenente l'anione blu scuro NS4−:[13]
- 2S4N4 + [(Ph3P)2N]N3 → [(Ph3P)2N][NS4] + ½S8 + 5 N2
L'anione NS4− è descritto come ibrido di risonanza delle strutture [S=S=N-S-S]−↔[S–S–N=S=S]−.
Passando S4N4 gassoso su argento metallico si ottiene il Polythiazyle, indicato spesso semplicemente come "(SN)x", che è un superconduttore a bassa temperatura (temperatura di transizione 0,26±0,03 K[14]). Nella conversione, l'argento dapprima diventa solfuro, Ag2S, che poi catalizza la conversione di S4N4 nella specie ciclica a quattro membri S2N2, che polimerizza subito.[1]
- S4N4 + 8 Ag → 4 Ag2S + 2N2
- S4N4 → (SN)x
- S2N2 → (SN)x (polimerizzazione termica)
Produzione di altri nitruri di zolfo
[modifica | modifica wikitesto]- Trattamento con tetrametilammonio acido:
S4N4 + (CH3)4N+N3– → (CH3)4N+[S3N3]– + 3/8 S8 + 2 N2.
- In una reazione simile reagisce con bis(trifenilfosfina)imminio cloruro ([(C6H5)3P)2N]+N3– che contiene l'anione blu [NS4]−)
2 S4N4 + [(C6H5)3P)2N]+N3– → [(C6H5)3P)2N]+[NS4]– + 3/8 S8 + 5 N2.
Altre reazioni
[modifica | modifica wikitesto]S4N4 reagisce con metalli alcalini poveri di elettroni.[15]
S4N4 ha dimostrato di co-cristallizzare con benzene e fullerene (C60).[16]
Il composto similare di selenio Se4N4 è noto ed è stato oggetto di una ricerca.[senza fonte]
Sicurezza
[modifica | modifica wikitesto]S4N4 è molto sensibile agli urti e bisogna evitare di macinare campioni solidi. È stato riportato che campioni più puri sono più sensibili di quelli contaminati con zolfo elementare. Esplode per accensione se acceso in grosse quantità o se confinato dentro contenitori, mentre in piccole quantità ed allo stato di polvere impalpabile tende a deflagrare. Utilizzare le normali precauzioni adottate per gli esplosivi primari.
Note
[modifica | modifica wikitesto]- ^ a b c d e f g h i N. N. Greenwood, A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- ^ a b T. Chivers, A guide to chalcogen-nitrogen chemistry, Singapore, World Scientific Publishing Company, 2004, ISBN 981-256-095-5.
- ^ a b c (DE) Ralf Alsfasser e Erwin Riedel, Moderne Anorganische Chemie, Walter de Gruyter, 2007, p. 121, ISBN 978-3-11-019060-1.
- ^ Hans-Georg Elias, Makromolekule Band 3: Industrielle Polymere und Synthesen, John Wiley & Sons, 2009, ISBN 3-527-62652-2.
- ^ a b (DE) Arnold F. Holleman, Lehrbuch der anorganischen Chemie, Walter de Gruyter, 1995, p. 600, ISBN 978-3-11-012641-9.
- ^ B. D. Sharma, J. Donohue, The crystal and molecular structure of sulfur nitride, S4N4, in Acta Crystallographica, vol. 16, n. 9, 1963, pp. 891–897, DOI:10.1107/S0365110X63002401.
- ^ H. S. Rzepa, J. D. Woollins, A PM3 SCF-MO study of the structure and bonding in the cage systems S4N4 and S4N4X (X=N+, N–, S, N2S, P+, C, Si, B– and Al–, in Polyhedron, vol. 9, n. 1, pp. 107-111, DOI:10.1016/S0277-5387(00)84253-9.
- ^ W. L. Jolly, S. A. Lipp, Reaction of tetrasulfur tetranitride with sulfuric acid, in Inorg. Chem., vol. 10, n. 1, 1971, pp. 33-38, DOI:10.1021/ic50095a008.
- ^ M. Villena-Blanco, W. L. Jolly, Tetrasulfur tetranitride, S4N4, in Inorg. Synth., vol. 9, 1967, pp. 98-102, DOI:10.1002/9780470132401.ch26.
- ^ A. Maaninen, J. Siivari, R. S. Laitinen, T. Chivers, Tetrasulfur-tetranitride (S4N4), in Inorg. Synth., vol. 33, 2002, pp. 196-199.
- ^ P. F. Kelly, A. M. Z. Slawin, D. J. Williams, J. D. Woollins, Caged explosives: metal-stabilized chalcogen nitrides, in Chem. Soc. Rev., vol. 21, 1992, pp. 245-252, DOI:10.1039/CS9922100245.
- ^ J. Bojes, T. Chivers, R. T. Oakley, Binary cyclic nitrogen-sulfur anions, in Inorg. Synth., vol. 25, 1989, pp. 30-40, DOI:10.1002/9780470132562.ch7.
- ^ J. Bojes, T. Chivers, R. T. Oakley, Binary catena-nitrogen-sulfur anoins, in Inorg. Synth., vol. 25, 1989, pp. 35-38.
- ^ R. L. Greene, G. B. Street, L. J. Suter, Superconductivity in polysulfur nitride (SN)x, in Phys. Rev. Lett., vol. 34, 1975, pp. 577–579, DOI:10.1103/PhysRevLett.34.577.
- ^ Dunn, P. J. e Rzepa, H. S., The Reaction between Tetrasulphur Tetranitride (S4N4) and Electron-deficient Alkynes. A Molecular Orbital Study, in Journal of the Chemical Society, Perkin Transactions 2, vol. 1987, n. 11, 1987, pp. 1669–1670, DOI:10.1039/p29870001669.
- ^ Konarev, D. V.; Lyubovskaya, R. N.; Drichko, N. V.; Yudanova, E. I.; Shulga, Yu. M.; Litvinov, A. L.; Semkin V. N.; Tarasov, B. P., Donor-Acceptor Complexes of Fullerene C60 with Organic and Organometallic Donors, in Journal of Materials Chemistry, vol. 10, n. 4, 2000, pp. 803–818, DOI:10.1039/a907106g.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Tetranitruro di tetrazolfo
Wikimedia Commons contiene immagini o altri file su Tetranitruro di tetrazolfo
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) tetrasulfur tetranitride, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.













