Рибозим


Рибозим (від англ. ribozyme — ribonucleic acid enzyme), що також називається РНК-ферментом або каталітичною РНК — молекула РНК, яка володіє каталітичною активністю. Багато природних рибозим каталізують або гідролізують одного із своїх власних фосфодіестерних зв'язків, або гідролізують фосфодіестерні зв'язки інших молекул РНК. Крім того, рибозими входять до складу рибосом, де вони каталізують амінотрансферазну активність.
Дослідники виникнення життя створили також штучні рибозими, здатні каталізувати свій власний синтез, подібно до РНК-полімерази, хоча й у дуже специфічних умовах[1]. Мутегенез і селекція виявилися ефективними для розвитку цих рибозим, і привели до створення й ізоляції покращених варіантів рибозим-полімераз. Наприклад, рибозим «B6.61» здатен додавати до праймеру до 20 нуклеотидів за 24 години, після чого він руйнується через гідроліз власного ланцюжка[2]. Такі експерименти ставляться здебільшого для підтвердження гіпотези світу РНК, згідно з якою перші живі організми на Землі не мали білків і каталізували всі необхідні хімічні реакції за допомогою рибозимів.
До відкриття рибозимів, ферменти, які були визначені як каталітичні білки,[3] були єдиними відомими біологічними каталізаторами. 1967 року Карл Воуз, Френсіс Крік і Леслі Орджел першими припустили, що РНК може виступати в ролі каталізатора. Ця ідея базувалася на тому, що РНК може утворювати складні вторинні структури.[4] Ці рибозими були знайдені в інтроні транскрипту РНК, а також у РНК-компоненті комплексу РНКази Р, який бере участь у дозріванні пре-тРНК. У 1989 р.Томас Р. Чех і Сідні Олтмен отримали Нобелівську премію з хімії за "відкриття каталітичних властивостей РНК".[5] Термін рибозим був вперше введений Келлі Крюгером та співавторами у 1982 р. у статті, опублікованій у Cell.[6]
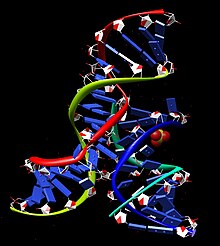
На почтаку 1980-х років Томас Р. Чех та його колеги з Університету Колорадо в Боулдері вивчав видалення інтронів у гені рибосомної РНК у інфузорії Tetrahymena thermophila. Намагаючись виідлити фермент, відповідальний за реакцію сплайсингу, він виявив, що окремий сегмент РНК якимось чином опинився відділений від інших, немов його вирізали ножицями. Коли вчені прибрали всі ферменти і інші молекули, які могли виступати молекулярними ножицями, РНК продовжувала виробляти. Так вони знайшли перший РНК-фермент: коротку ділянку РНК, яка здатна вирізати себе з довгого ланцюга, частиною якої вона є. Приблизно в той же час Сідні Олтмен, професор Єльського університету, вивчав спосіб обробки молекул тРНК у клітині, коли він та його колеги виділили фермент під назвою РНКаза Р, який відповідає за перетворення тРНК-попередника в активну тРНК. На їхнє здивування вони виявили, що РНКаза Р, крім білка, містить РНК, і що РНК є важливим компонентом активного ферменту. Наступного року Альтман продемонстрував, що РНК може діяти як каталізатор, показавши, що субодиниця РНКази Р може каталізувати розщеплення тРНК-попередника до активної тРНК за відсутності будь-якого білкового компонента.
В процесі, який каталізує рибозим, в якості кофактора бере участь гуанозин. На першій стадії сплайсингу він приєднується фосоефірним зв'язком до 5'-фосфату першого нуклеотидного залишку інтрона. Одночасно відбувається розрив фосфодиефірного зв'язку між цим фосфатом та 3'-кінцем лівого екзона. Проте лівий екзон, навіть не будучи ковалентно зв'язаним з іншою частиною попередника, залишається поблизу цієї частини і бере участь у другій стадії, яка є також реакцією переестерифікації. При цьому утворюється зв'язок між 3'-кінцем лівого екзона та 5'-кінцем правого. В результаті інтрон відщеплюється у вигляді похідної, яка містить додатковий залишок гуанозину на 5'-кінці.
Другий тип вирізання інтронів був виявлений при вивченні сплайсингу мітохондріальних пре-мРНК. В цьому випадку сплайсинг починається з внутрішньомолекулярної атаки 2'-ОН-групи одного з внутрішніх залишків аденозину на 5'-кінцевій фосфат інтрона. Виникає структура, в якій цей внутрішній аденозин пов'язаний трьома фосфодиефірними зв'язками за участі всіх його ОН-груп з сусідами зліва та справа і з кінцевим фосфатом інтрона. Після цього відбувається приєднання екзонів і відщеплення інтрона у вигляді структури типу "ласо" (lariat).[7]
Рибозим також може каталізувати утворення пептидного зв'язку між сусідніми амінокислотами, знижуючи ентропію активації.[8]
Згідно з гіпотезою РНК-світу на зорі зародження життя повинні були існувати рибонуклеїнові кислоти, що володіли каталітичними властивостями, тобто рибозими, і здійснювали матричний синтез молекул РНК.[9] Однак такі рибозими володіють недостатньо високою каталітичною активністю на відміну від тої, яка передбачена гіпотезою. Високою каталітичною активністю володіють лише рибозими, що каталізують синтез поліпептидних ланцюгів білкових молекул.[10][11] Прикладом може слугувати пептидилтрансферазний центр (пептидилтрансфераза, РТС) рибосом, що являє собою рибозим і каталізує процес поєднання амінокислот у поліпептидному ланцюзі.[12][13]
Рибозими, які здійснюють синтез РНК з РНК-полімеразною активністю, є ключовим компонентом концепції РНК-світу. Без таких рибозимів була б неможливою спадковість та еволюція за Дарвіном.[14] У природі такі рибозими практично не зустрічаються, оскільки вони були витіснені ефективнішими ферментами білкової природи – полімеразами.[15] Тому, для того, щоб реконструювати початкові етапи зародження життя і довести можливість існування стійкого до «дарвінівської» еволюції світу РНК, важливо отримати такий рибозим у штучних умовах.
Вперше штучний абіогенний синтез РНК продемонстрували 1974 року німецькі вчені Манфред Сампер та Рудигер Льюс, які інкубували суміш окремих нуклеотидів зі специфічним вірусним ферментом Qβ-репліказою. У суміші не містилося первинних молекул РНК. Через деякий проміжок часу спостерігалося утворення невеликих олігонуклеотидних ланцюжків РНК, здатних до самоподвоєння (самореплікації).[16]
Штучно створені рибозими здатні продукувати невеликі олігонуклеотидні ланцюжки, що складаються найчастіше з 12-14 нуклеотидів (максимальна кількість нуклеотидів може сягати 20). Приблизно через 24 години після завершення синтезу відбувається гідроліз фосфодіефірних зв'язків з наступним руйнуванням ланцюжків. Проте найновіші біохімічні та цито-генетичні методи дозволяють вдосконалити каталітичну активність рибозимів.[17] Так, американські вчені створили «покращений» рибозим з РНК-полімеразною активністю, здатний копіювати молекули РНК завдовжки до 95 нуклеотидів. Цей експеримент підтверджує положення концепції РНК-світу, оскільки тут вперше показано синтез РНК без допомоги ферментів білкової природи.
- ↑ Johnston W, Unrau P, Lawrence M, Glasner M, Bartel D (2001). RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension (PDF). Science. 292 (5520): 1319—25. PMID 11358999. Архів оригіналу (PDF) за 27 лютого 2012. Процитовано 11 листопада 2007.
- ↑ Zaher, Hani S.; Unrau, Peter J. (2007-07). Selection of an improved RNA polymerase ribozyme with superior extension and fidelity. RNA (New York, N.Y.). Т. 13, № 7. с. 1017—1026. doi:10.1261/rna.548807. ISSN 1355-8382. PMC 1894930. PMID 17586759. Процитовано 7 червня 2021.
- ↑ Definition of enzyme | Dictionary.com. www.dictionary.com (англ.). Процитовано 7 червня 2021.
- ↑ Woese, Carl (1967). The genetic code: the molecular basis for genetic expression. New York: Harper & Row.
- ↑ The Nobel Prize in Chemistry 1989. NobelPrize.org (амер.). Процитовано 7 червня 2021.
- ↑ Kruger, Kelly; Grabowski, Paula J.; Zaug, Arthur J.; Sands, Julie; Gottschling, Daniel E.; Cech, Thomas R. (1 листопада 1982). Self-splicing RNA: Autoexcision and autocyclization of the ribosomal RNA intervening sequence of tetrahymena. Cell (English) . Т. 31, № 1. с. 147—157. doi:10.1016/0092-8674(82)90414-7. ISSN 0092-8674. PMID 6297745. Процитовано 7 червня 2021.
- ↑ Knorre, Dmitrii Georgievitz (2002). Biologitcheskaya chimiya (вид. 3nd rev. ed). Moskva: Vischay schkola. с. 219—220. ISBN 5-06-003720-7. OCLC 641170749.
- ↑ Lilley, David M. J. (27 жовтня 2011). Mechanisms of RNA catalysis. Philosophical Transactions of the Royal Society B: Biological Sciences. Т. 366, № 1580. с. 2910—2917. doi:10.1098/rstb.2011.0132. ISSN 0962-8436. PMC 3158914. PMID 21930582. Процитовано 13 червня 2021.
- ↑ Жданкін, А. Є.; Ушакова, Г. О. (2014). Каталітичні властивості РНК – ключ до пізнання еволюційного процесу (огляд). Молодий вчений. № 12(1). с. 316—319. ISSN 2304-5809. Процитовано 13 червня 2021.
- ↑ Markov, A. V. (2010). Rozhdenie slozhnosti : ėvoli︠u︡t︠s︡ionnai︠a︡ biologii︠a︡ segodni︠a︡ : neozhidannye otkrytii︠a︡ i novye voprosy. Moskva: Astrelʹ. ISBN 978-5-271-24663-0. OCLC 713835517.
- ↑ Hartl, Daniela; Irmler, Martin; Römer, Irmgard; Mader, Michael T.; Mao, Lei; Zabel, Claus; Angelis, Martin Hrabé de; Beckers, Johannes; Klose, Joachim (2008). Transcriptome and proteome analysis of early embryonic mouse brain development. PROTEOMICS (англ.). Т. 8, № 6. с. 1257—1265. doi:10.1002/pmic.200700724. ISSN 1615-9861. Процитовано 13 червня 2021.
- ↑ Tang, Jin; Breaker, Ronald R. (23 травня 2000). Structural diversity of self-cleaving ribozymes. Proceedings of the National Academy of Sciences (англ.). Т. 97, № 11. с. 5784—5789. doi:10.1073/pnas.97.11.5784. ISSN 0027-8424. PMID 10823936. Процитовано 13 червня 2021.
- ↑ Johnston, W. K.; Unrau, P. J.; Lawrence, M. S.; Glasner, M. E.; Bartel, D. P. (18 травня 2001). RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension. Science (New York, N.Y.). Т. 292, № 5520. с. 1319—1325. doi:10.1126/science.1060786. ISSN 0036-8075. PMID 11358999. Процитовано 13 червня 2021.
- ↑ А.С. Спирин, "Рибонуклеиновые кислоты как центральное звено живой материи". vivovoco.astronet.ru. Процитовано 13 червня 2021.
- ↑ Walter, Nils G.; Burke, John M.; Millar, David P. (1999-06). Stability of hairpin ribozyme tertiary structure is governed by the interdomain junction. Nature Structural Biology (англ.). Т. 6, № 6. с. 544—549. doi:10.1038/9316. ISSN 1545-9985. Процитовано 13 червня 2021.
- ↑ Крицкий, М. С.; Телегина, Т. А. (2004). Коферменты и эволюция мира РНК. № 44. Успехи биологической химии. с. 341—364.
- ↑ Supattapone, Surachai (2004-06). Prion protein conversion in vitro. Journal of Molecular Medicine (Berlin, Germany). Т. 82, № 6. с. 348—356. doi:10.1007/s00109-004-0534-3. ISSN 0946-2716. PMID 15014886. Процитовано 13 червня 2021.
| Це незавершена стаття з молекулярної біології. Ви можете допомогти проєкту, виправивши або дописавши її. |