Strongyloides stercoralis

| Strongyloides stercoralis | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Eukaryota |
| Regno | Animalia |
| Sottoregno | Eumetazoa |
| Superphylum | Aschelmintae |
| Phylum | Nematoda |
| Classe | Secernentea |
| Ordine | Rhabditida |
| Famiglia | Strongyloididae |
| Genere | Strongyloides |
| Specie | S. stercoralis |
| Nomenclatura binomiale | |
| Strongyloides stercoralis | |
Lo Strongyloides stercoralis è un verme parassita nematode molto piccolo in grado di infestare l'uomo e altri animali penetrando nella cute intatta. Possiede un esofago capillare e si nutre dei fluidi dell'animale ospite.
Il ciclo biologico prevede larve che dalla cute umana (sono attratte dall'acido urocanico prodotto da questa) passano nel circolo ematico e giungono al cuore destro, poi ai polmoni, alveoli, laringe, faringe, intestino tenue dove diventano vermi adulti. Questi possono deporre uova che danno vita a larve rabditoidi (più piccole e non danno infezione) che diventano larve filariformi che attraversano la cute del perineo determinando la larva currens che può dare autoinfezione attraversando la mucosa intestinale e colonizzare encefalo, fegato e reni.
L'infezione interesserebbe tra i 30 ed i 200 milioni di persone in tutto il mondo.[1][2]Questi vermi hanno bisogno di caldo umido infatti vivono nelle aree tropicali e subtropicali in particolare nell'Africa sub-sahariana, nel Sud-est asiatico e nel Sud America.[3] Il parassita è endemico o ipoendemico anche in alcune zone europee, ad esempio nel sud della Spagna[4] e nel nord dell'Italia[5].
Storia
[modifica | modifica wikitesto]Il parassita è stato identificato per la prima volta nel 1876 dal medico francese Louis Alexis Normand, mentre lavorava all'ospedale navale di Tolone. Normand trovò un nuovo verme di circa 0,25 mm di lunghezza nei campioni di feci di truppe che erano state rimpatriate dalla Cochin-Cina (oggi Vietnam) con diarrea. Il parassita fu chiamato Anguillula stercoralis dal suo collega, Bavay. Alcuni mesi più tardi, durante l'autopsia di un altro soldato in missione in Cochin-Cina che era morto di diarrea, trovò un altro verme, lungo circa 2 mm. Pensò che si trattasse di una specie distinta, così come lo fece Bavay che lo chiamò Anguillula intestinalis.[6] Per complicare ulteriormente le cose, Bavay ha poi trovato un nuovo tipo di larva nelle colture che riteneva essere la forma larvale di A. intestinalis. Questi vermi erano larve rabditiformi, adulti e larve infettive al terzo stadio. Le diverse forme e stadi furono poi classificate, 2 anni dopo, da Grassi e Parona in Italia. A Grassi (1879) si deve il conio del nome Strongyloides attribuito a quello che si pensava fosse un genere di vermi. Nel 1883 il parassitologo tedesco Rudolf Leuckart fece delle osservazioni sul ciclo vitale del parassita e comprese che non si trattava di specie diverse ma di stadi vitali diversi di un'unica specie, chiamata poi definitivamente Strongyloides stercorulis da Stiles e Hassall, nel 1902. Il medico belga Paul Van Durme (lavorando su osservazioni del parassitologo tedesco Arthur Looss) descrisse le modalità di infezione attraverso la pelle integra. Il parassitologo tedesco Friedrich Fülleborn descrisse l'autoinfezione e il modo in cui la strongiloidosi coinvolgeva l'intestino. L'interesse per la malattia aumentò dopo la Seconda guerra mondiale con gli studi di Napier sui soldati inglesi rimpatriati affetti da strongoloidosi. Agli esperimenti su cani immunosoppressi eseguiti da Galliard si deve la comprensione della rilevanza clinica della strongoloidosi e della sindrome da iperinfestazione nei soggetti immunocompromessi.[1][7][8][9]
Ciclo vitale
[modifica | modifica wikitesto]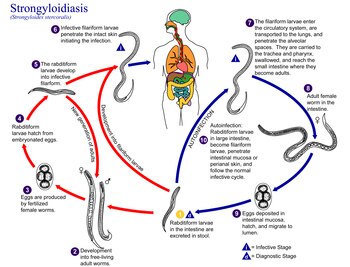
Il ciclo vitale dei vermi strongiloidi è più complesso di quello della maggior parte dei nematodi, con la sua alternanza tra cicli di vita libera e parassitaria ed il suo potenziale di autoinfezione e moltiplicazione all'interno dell'ospite. Il ciclo di vita libera è eterogonico mentre quello parassitario è omogonico, partenogenetico. Il ciclo di vita eterogonico è vantaggioso per il parassita perché consente la riproduzione per una o più generazioni in assenza di un ospite.
La femmina partenogenetica vive profondamente inserita nella mucosa duodeno-digiunale dell'intestino tenue. Le uova, simili a quelle del ancylostoma duodenale ma più piccole, maturano non appena posate e si evolvono molto rapidamente in larve. Dalle larve rabdidoidi, tutte cloni femmine, sono possibili 3 cicli evolutivi:
- un ciclo sessuale indiretto (ciclo lungo);
- un ciclo partenogenetico diretto (ciclo breve);
- un ciclo iperinfettivo endogeno (ciclo di autoinfestazione).
Nel ciclo di vita libera, le larve rabditiformi passate nelle feci possono mutare due volte e diventare larve filariformi infettive (sviluppo diretto) o mutare quattro volte e diventare maschi adulti e femmine che vivono liberi che si accoppiano producendo uova da cui si schiudono nuove larve rabditiformi che poi si trasformano in larve infettive filariformi. Nello sviluppo diretto, le larve di primo stadio si trasformano in larve infettive. La via diretta produce larve infettive più velocemente (tre giorni) rispetto alla via indiretta (da sette a 10 giorni). Tuttavia, la via indiretta comporta un aumento del numero di larve prodotte. I maschi e le femmine di S. stercoralis in vita libera muoiono dopo una generazione e non persistono nel terreno.
Caratteristiche
[modifica | modifica wikitesto]Lo Strongyloides stercoralis ha un complesso ciclo parassitario e di vita libera. Le uova, le larve, in vari stadi e forme, e gli adulti si susseguono in un rapporto con l'animale ospite e con l'ambiente non del tutto compreso. Oltre all'uomo Strongyloides stercoralis può infestare: cane , gatto, scimpanzé, babbuini, opossum. L'infestazione degli animali ospiti può avvenire anche per l'ingestione delle larve filariformi e la sua rilevanza nel propagare la zoonosi non è stata chiaramente definita.[10]
Le larve filariformi, entrando a contatto della pelle dell'ospite, la penetrano per iniziare il ciclo parassitario. Le larve localizzerebbero i loro ospiti e sarebbero attratte da diverse sostanze chimiche presenti nella pelle, alcune non specifiche, come il biossido di carbonio o il cloruro di sodio, altre specifiche come l'acido urocanico, un metabolita istidinico sullo strato più superficiale della pelle umana. Nell'uomo le concentrazioni di acido urocanico possono essere fino a cinque volte superiori nel piede rispetto a qualsiasi altra parte del corpo. Questo spiegherebbe il rischio specifico del camminare scalzi su terreni contaminati.
| Femmina parassitaria | Femmina vita libera | Maschio vita libera | Larva rabdiforme | Larva filariforme | |
| Lunghezza (μm) | 2 100-2 700 | 900-1 700 | 800-1 000 | 180-240 | 490-630 |
| Larghezza (μm) | 30-40 | 50-85 | 40-50 | 15 | 15-16 |
Le uova deposte dai vermi femminili che vivono liberi sono a guscio sottile, ellissoidali e misurano circa 40 × 70 μm.
Rilevanza clinica
[modifica | modifica wikitesto]Sebbene biologicamente affine alla anchilostomiasi e alla oncocercosi, la strongiloidosi o strongiloidiasi è ben distinta nella sua espressione clinica. Ad oggi, l'insorgenza di autoinfezione negli esseri umani con infezioni da elminti è riconosciuta solo nelle infezioni da Strongyloides stercoralis e da Capillaria philippinensis. L'auto-infezione da Strongyloides può spiegare la possibilità di infezioni persistenti per molti anni in persone che non vivono in un'area endemica e di iperinfezione in individui immunodepressi. Sebbene la strongiloidiasi abbia in genere manifestazioni lievi, l'infezione può essere grave e pericolosa per la vita dell'uomo in caso di immunodeficienza (malattie ematologiche, terapie immunosoppressive). La strongiloidosi può causare sintomi intermittenti che colpiscono principalmente l'intestino (dolore addominale e diarrea intermittente o persistente), i polmoni (tosse, respiro sibilante, bronchite cronica) o la pelle (prurito, orticaria). I casi asintomatici possono ospitare i parassiti anche per molti anni, ignari dell'infezione. Per questo motivo è estremamente importante sospettare, diagnosticare e curare l'infezione.
La strongiloidosi o strongiloidiasi è diagnosticabile tramite la ricerca di larve nelle feci e alla ricerca di anticorpi IgG nel sangue.[11][12]
La profilassi prevede il non venire a contatto con feci o terreno contaminato.
Note
[modifica | modifica wikitesto]- ^ a b Cox FE, History of Human Parasitology, in Clin. Microbiol. Rev., vol. 15, n. 4, October 2002, pp. 595–612, DOI:10.1128/CMR.15.4.595-612.2002, PMC 126866, PMID 12364371. URL consultato il 3 agosto 2018 (archiviato dall'url originale il 23 ottobre 2011).
- ^ (EN) Strongyloidiasis, su World Health Organization. URL consultato il 3 agosto 2018.
- ^ (EN) CDC - Centers for Disease Control and Prevention, CDC - Strongyloides - Biology, su cdc.gov, 2 maggio 2017. URL consultato il 3 agosto 2018.
- ^ Endemic strongyloidiasis on the Spanish Mediterranean coast
- ^ Endemic Strongyloidiasis in Northern Italy: Clinical and Immunological Aspects
- ^ Bavay, A. 1877. Sur l'Anguillule intestinalee (Anguillula intestinalis), nouveau ver nématode trouvé par le Dr. Normand chez les malades atteints de diarrhée de Cochinchine. C. R. Acad. Sci. 84: 266-268.
- ^ (EN) Mark E. Viney e James B. Lok, The biology of Strongyloides spp., WormBook, 2005. URL consultato il 28 luglio 2018.
- ^ David I. Grove, Advances in Parasitology (PDF), vol. 38, Elsevier, 1996, pp. 252–297, DOI:10.1016/s0065-308x(08)60036-6, ISBN 978-0-12-031738-7. URL consultato il 28 luglio 2018 (archiviato dall'url originale il 3 agosto 2018).
- ^ Richard L. Guerrant, David H. Walker e Peter F. Weller, Tropical Infectious Diseases, Elsevier, 2006, ISBN 978-0-443-06668-9. URL consultato il 28 luglio 2018.
- ^ (EN) Tegegn G. Jaleta, Siyu Zhou e Felix M. Bemm, Different but overlapping populations of Strongyloides stercoralis in dogs and humans—Dogs as a possible source for zoonotic strongyloidiasis, in PLOS Neglected Tropical Diseases, vol. 11, n. 8, 9 agosto 2017, pp. e0005752, DOI:10.1371/journal.pntd.0005752. URL consultato il 3 agosto 2018.
- ^ R. M. Genta e G. J. Weil, Antibodies to Strongyloides stercoralis larval surface antigens in chronic strongyloidiasis, in Laboratory Investigation; a Journal of Technical Methods and Pathology, vol. 47, n. 1, 1982-07, pp. 87–90. URL consultato il 19 maggio 2024.
- ^ (EN) CDC - DPDx - Strongyloidiasis, su www.cdc.gov, 30 luglio 2019. URL consultato il 19 maggio 2024.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Strongyloides stercoralis
Wikimedia Commons contiene immagini o altri file su Strongyloides stercoralis Wikispecies contiene informazioni su Strongyloides stercoralis
Wikispecies contiene informazioni su Strongyloides stercoralis
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) threadworm, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 7693841-4 |
|---|
