インスリン


インスリン(Insulin, 英語: [ˈɪn.sjʊ.lɪn, ˈɪnsəlɪn][5][6])とは、膵臓のβ細胞で産生されるペプチドホルモンである。血中グルコースの肝臓、脂肪細胞、骨格筋細胞への取り込みを促進し、炭水化物、タンパク質、脂肪の代謝を調節する[7]。
これらの細胞に取り込まれたグルコースは、グリコーゲンへ変換されるか、脂質生合成を経てトリグリセリドへ変換される。肝臓においては、グリコーゲンと脂肪の両方への合成が行われる[7]。肝臓におけるグルコース産生は、血中インスリン濃度が高いときには強力に阻害される[8]。血中を循環するインスリンは、身体のさまざまな組織におけるタンパク質合成にも影響を及ぼし、血液中の小分子から細胞内の大分子への変換も促進する。
血中のインスリン濃度が低いときには、広範囲での異化作用、特に体脂肪に対する異化作用が促進される。β細胞は血糖値に非常に敏感であり、高濃度のグルコースに反応する形でインスリンを分泌し、逆に血糖値が低いときにはインスリンの分泌を阻害する[9]。インスリンは細胞内へのグルコースの取り込みと代謝を促進し、それに伴って血糖値は低下する。β細胞に隣接するα細胞は、β細胞からのシグナルを受けて[9]グルカゴンを分泌し、血中へ放出する。血糖値が低いときには血中のグルカゴンの濃度は上昇し、血糖値が高いときにはグルカゴンの分泌は阻害される。分泌されたグルカゴンは、肝臓におけるグリコーゲンの分解および糖新生を刺激し、それによって血糖値が上昇する[7][9]。血糖値に反応する形でのインスリンとグルカゴンの分泌は、グルコースの恒常性維持機能における重要機構である[9]。インスリンは身体における同化作用を持つホルモンとみなされている[10]。インスリンはグルカゴンの分泌も抑制する[11]。
インスリンの活性の低下やインスリンの欠如は、血糖値の制御が不能となる糖尿病を惹き起こす。糖尿病には「1型」と「2型」の2種類がある。前者では自己免疫反応によってβ細胞が破壊されており、インスリンの合成機能は失われ、インスリンが血中に分泌されなくなる[12]。後者においては、β細胞の破壊は1型に比べると際立ってはおらず、また自己免疫反応を原因とするものではない。2型糖尿病では膵臓のランゲルハンス島の内部にアミロイドが蓄積していき、その形態や機能の破壊をもたらしている可能性がある[9]。糖尿病に関しては、膵臓のβ細胞数の減少、β細胞のホルモン分泌機能の低下、末梢組織でのインスリン抵抗性が関与していることが分かっている[10]。2型糖尿病は、血糖値の影響を受けず、血糖値に反応しない形でのグルカゴンの分泌の増加によって特徴づけられるが、インスリンは血糖値に反応して分泌される[9]。
ヒトのインスリンタンパク質は51個のアミノ酸から構成され、その分子量は5808である。インスリンタンパク質はA鎖とB鎖からなるヘテロ二量体であり、両者はジスルフィド結合で連結されている。インスリンの分子構造は、動物の種によってわずかに異なる。ヒト以外の動物種由来のインスリンの作用(炭水化物を代謝する効果)がヒトインスリンとはいくぶん異なるのは、こうした多様性のためである。ヒトのインスリンに近い性質を持つのはブタのものであり、DNA組み換え技術によってヒトのインスリンの大量生産が可能になるまでは、1型糖尿病患者の治療に用いられていた[13][14][15][16]。
ジョン・ジェイムス・リッカード・マクラウドの研究室で働いていたフレデリック・バンティングとチャールズ・ハーバート・ベストの2人が、インスリンを共同で発見し、これが初めて発見されたペプチドホルモンとなった[17]。マクラウドは1921年にイヌの膵臓からインスリンを単離した最初の人物でもあった。1951年、生化学者のフレデリック・サンガーはインスリンのアミノ酸配列を決定し、インスリンはアミノ酸配列が完全決定された最初のタンパク質となった[18]。インスリンの結晶構造は、1969年にドロシー・ホジキンによって決定された。
インスリンは化学合成によってされた最初のタンパク質であり、DNA組み換え技術を用いて生産された最初のタンパク質でもある[19]。インスリンは、医療体制において極めて重要とされる必須医薬品の1つとしてWHO必須医薬品モデル・リストの一覧表に掲載されている[20]。
日本語表記では「インスリン」のほかに、「インシュリン」とも呼ばれる。「インスリン」の名の由来は「島」を意味するラテン語『Insula』から。
物性
[編集]構造
[編集]インスリンはアミノ酸からなるペプチドで、A鎖とB鎖の二量体による構造である。プロセシングされる前のプリプロプロテインは、ロイシン(18%)、グリシン(11%)、アラニン(9%)で38%とその4割近くを占める。プリプロプロテインはプロセシングによって4つに切断され、そのうちの2つがA鎖とB鎖として切り出され、二量体を構成する。
- A鎖: GIVEQCCTSICSLYQLENYCN
- B鎖: FVNQHLCGSHLVEALYLVCGERGFFYTPKT
二量体のアミノ酸比率は、システイン(12%)とロイシン(12%)が最も多く、合計で1⁄4を占める。
生化学
[編集]インスリンの作用機序
[編集]- インスリンは細胞膜にあるインスリン受容体に結合する。
- インスリン受容体は、インスリンが結合するとチロシンキナーゼとして活性化し、細胞質内のIRS-1がリン酸化される。
- IRS-1→PI3キナーゼ(ホスファチジルイノシトール3キナーゼ)→PKB(プロテインキナーゼB)とシグナルが伝達され、GLUT-4が細胞膜へ送られる。
- GLUT-4はグルコースをカリウムとともに血中から細胞内へ取り込む。例えばGLUT-4が多く存在する脂肪細胞に取り込まれたグルコースは細胞中で中性脂肪へ変換、蓄積される。
- インスリンにより交感神経系が刺激され、Na+/H+交換輸送体機能が亢進し、尿細管でのNa+再吸収が増加して、体内のNa+量と水分量が増加して、高血圧や浮腫を来す。
- インスリンは腎の近位尿細管細胞にあるNa+依存性モノカルボン酸トランスポーター(SMCT1)に作用し、Na+の再吸収を亢進させる[21]。
インスリンの生化学振動
[編集]
食事後の1〜2時間ほどの消化の間、膵臓からのインスリンの放出は血中濃度が一定となるようには放出されてはおらず、3〜6分の周期で血中インスリン濃度をおおよそ100 ピコモル/Lから800 ピコモル/L以上へと変動するように放出されている。 これは細胞にあるインスリン受容体の(インスリンに対する感応度や細胞表面の受容体の数そのものを減少させる)脱感作を避け、インスリンの主要標的である肝臓の細胞に対してインスリンが十分に作用を果たせるようにするためではないかと考えられている[22]。
インスリン受容体の脱感作はインスリン抵抗性とも関連があると見られることから、インスリン療法の管理においては、このインスリン振動すなわち一定濃度ではなく理想的には血中濃度が周期的に変動するような投与についてその有効性を検討する必要があり、将来のインスリンポンプはこの点について考慮されることが望まれる。
歴史
[編集]
1869年にドイツ・ベルリンの医学生パウル・ランゲルハンスは、顕微鏡で観察される膵臓の構造を研究していた。後にランゲルハンス島として知られる「小さな枠の集合体」は当時まだ知られていなかったが、エドワール・ラゲス(Edouard Laguesse)は、それらが消化に関わる大きな役割を果たすものであり得ると主張した。
1889年、リトアニア出身のドイツの内科医オスカル・ミンコフスキ(Oskar Minkowski)とヨーゼフ・フォン・メーリング(Joseph von Mehring)は健康なイヌの膵臓を取り除く研究を行った。実験が始まって数日後、ミンコフスキーはハエがいつもこのイヌの尿に群がっていることに気づいた。尿を調べてみると、糖分が含まれており、ここで初めて膵臓と糖尿病との関係が実証された。
1901年、アメリカ合衆国の病理学者ユージン・オピー(Eugene Opie)によりランゲルハンス島と糖尿病との関連が明らかにされたとき、この研究は新たな段階を迎えた。つまり、糖尿病はランゲルハンス島の部分的あるいは全体的な破壊によって惹き起こされることが分かった。しかしながら、ランゲルハンス島が果たす特定の役割については、この時点ではまだ不明であった。
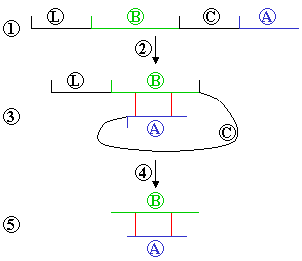
2. Spontaneous folding
3. A and B chains linked by sulphide bonds
4. Leader and C chain are cut off
5. Insulin molecule remains
それから20年、これに連なる数々の研究が科学者の間で行われた。1921年、カナダの整形外科医であるフレデリック・バンティング(ウィリアム・バンティングの遠縁の親戚)と、医学生のチャールズ・ハーバート・ベストの2人が、ジョン・ジェイムズ・リッカード・マクラウドの研究室で働いていたとき、インスリンを共同で発見した。
1922年1月11日、当時14歳であった1型糖尿病患者に世界で初めてインスリンの投与が、カナダのトロント総合病院で行われた[23]。これは、精製方法が未熟であったこともあり、患者にひどいアレルギー反応が出たため中断された。ジェームス・バートラム・コリップは、それから12日間投与量の改善に日夜努力し、23日に再び投与が行われた。今度は副作用を惹き起こすこともなく、糖尿病の症状を取り除くことにも成功した。しかしながら、バンティングとベストはコリップを一種の闖入者と見なしたようで不和を生じたため、その後すぐにコリップは去って行った。
1922年の春が過ぎ、ベストは大量の需要にも応えられるように抽出技術を工夫したが、精製は未熟であった。1921年の発表の直後、イーライリリー社から、彼らは支援の申し出を受けており、4月にこの申し出を受けた。11月にリリー社は技術の革新に成功し、非常に純粋なインスリンの生産に成功した。このインスリンは「アイレチン」という名ですぐ市場に出された。インスリンの発見は1923年のノーベル生理学・医学賞の対象となった[23](#ノーベル賞で詳述)。
1933年、ポーランドの精神医学者マンフレート・ザーケルにより、インスリンを大量投与することにより低血糖ショックを人為的に起こさせて精神病患者を治療するというインスリン・ショック療法(Insulin shock therapy)が考案されたが、これは死亡例が多かった。その後、電気痙攣療法、薬物療法(クロルプロマジンに代表される抗精神病薬)が登場すると、1950年代には廃れた。
2013年、カナダはフレデリック・バンティングらの研究論文や臨床データと、インスリン普及後の各国からの報告をユネスコ記憶遺産へ申請し、これが登録された[24]。
日本での歴史
[編集]大正13年(1924年)3月、現代之医学社から平川公行著『糖尿病のインスリン療法』という治療マニュアルが発売され、アメリカからの輸入も始まっている[25]。当時の価格は50単位4円50銭、100単位8円と極めて高価であり、絶対適用の患者の場合は薬代だけで当時の平均賃金の3倍近くも必要になる。このため「世界一の高貴薬」と呼ばれ、糖尿病は「金持病」と揶揄された[26]。
昭和10年(1935年)に帝国社臓器薬研究所(帝国臓器製薬→現あすか製薬株式会社)から国産初のインスリン製剤が発売されるが、ウシやブタの膵臓から抽出精製した物だったので非常に高価で生産量も少なく、輸入品と比べても安くは無かったため国産化は進まなかった。
昭和13年(1938年)に外交関係の悪化によりインスリンを初め医薬品の輸入が完全に停止し、日本国内は深刻なインスリン不足に陥る。
昭和16年(1941年)5月14日に魚のハラワタを原料とした魚インスリンを生産するために清水製薬(現EAファーマ)が設立され、同16年7月に出荷を開始している。魚の場合ランゲルハンス島が独立した臓器となっていることが多く、非熟練の女子工員でも容易に分離が行えたことに加え、ピクリン酸とアセトンを使いランゲルハンス島からインスリンを抽出する技術を確立したことで、第二次世界大戦中にもかかわらず国産インスリンの生産量は増え続けた[信頼性要検証][27]。国内需要を国産のみで満たせるようになると同時に十分の一以下にまで値下げされ、戦時中に値下げされた唯一の医薬品となる。
昭和20年(1945年)、太平洋戦争下の空襲により全てのインスリン工場が焼失し、国内生産は完全に停止した。
戦後まもなく清水製薬が生産を再開したことでインスリンの供給が再開され、また大洋漁業(現マルハ)がクジラの膵臓から抽出したインスリンを製造・販売した(1952年 - 1968年)[28]。ヒト・インスリンの登場まで日本は西洋とは異なる独自の魚インスリンの製造販売を続けた。
ノーベル賞
[編集]インスリンを発見したフレデリック・バンティングとジョン・ジェームズ・リッカード・マクラウドが1923年にノーベル生理学・医学賞を受賞。1951年にインスリンのアミノ酸構造を解明したフレデリック・サンガーが1958年にノーベル化学賞を受賞し、1964年にドロシー・ホジキンが、1977年にはロザリン・サスマン・ヤロウがラジオイムノアッセイをインスリンで開発したことでそれぞれノーベル賞を受賞している。
インスリン製剤とインスリン療法
[編集]インスリンの副作用
[編集]低血糖症
[編集]- 運動後遅発性低血糖症
- 無自覚性低血糖症
- 詐病性低血糖症
インスリン・アレルギー
[編集]インスリン自体とインスリン製剤に含まれる、添加物に対するアレルギーと考えられている[29]。まれにアナフィラキシーショックを生じる[30]。
インスリン抗体による低血糖および高血糖
[編集]ヒトが体内で産生するヒト・インスリンで抗体が作られることはないが、インスリンアナログを投与した際に特異的な抗体が産生される場合があり、これがアレルギー症状を示して血糖コントロールに支障をきたすことがある。この産生の条件はよく判っていない。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000254647 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000035804 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Insulin | Meaning of Insulin by Lexico”. Lexico Dictionaries | English. 11 January 2021閲覧。
- ^ “insulin - WordReference.com Dictionary of English”. www.wordreference.com. 11 January 2021閲覧。
- ^ a b c Stryer, Lubert (1995). Biochemistry. (Fourth ed.). New York: W.H. Freeman and Company. pp. 773–74. ISBN 0-7167-2009-4
- ^ Sonksen P, Sonksen J (July 2000). “Insulin: understanding its action in health and disease”. British Journal of Anaesthesia 85 (1): 69–79. doi:10.1093/bja/85.1.69. PMID 10927996.
- ^ a b c d e f Koeslag JH, Saunders PT, Terblanche E (June 2003). “A reappraisal of the blood glucose homeostat which comprehensively explains the type 2 diabetes mellitus-syndrome X complex”. The Journal of Physiology 549 (Pt 2): 333–46. 2003. doi:10.1113/jphysiol.2002.037895. PMC 2342944. PMID 12717005.
- ^ a b Voet D, Voet JG (2011). Biochemistry (4th ed.). New York: Wiley
- ^ Adkins, Aron; Basu, Rita; Persson, Mai; Dicke, Betty; Shah, Pankaj; Vella, Adrian; Schwenk, W. Frederick; Rizza, Robert (2003-09). “Higher insulin concentrations are required to suppress gluconeogenesis than glycogenolysis in nondiabetic humans”. Diabetes 52 (9): 2213–2220. doi:10.2337/diabetes.52.9.2213. ISSN 0012-1797. PMID 12941759.
- ^ American Society of Health-System Pharmacists (2009年2月1日). “Insulin Injection”. PubMed Health. National Center for Biotechnology Information, U.S. National Library of Medicine. 2012年10月12日閲覧。
- ^ Drug Information Portal NLM – Insulin human USAN http://druginfo.nlm.nih.gov/drugportal/
- ^ “First Successful Laboratory Production of Human Insulin Announced”. News Release. Genentech (1978年9月6日). 2016年9月26日閲覧。
- ^ Tof I (1994年). “Recombinant DNA technology in the synthesis of human insulin”. Little Tree Publishing. 2009年11月3日閲覧。
- ^ Aggarwal SR (December 2012). “What's fueling the biotech engine-2011 to 2012”. Nature Biotechnology 30 (12): 1191–7. doi:10.1038/nbt.2437. PMID 23222785.
- ^ Weiss M, Steiner DF, Philipson LH (2000). “Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships”. Endotext. MDText.com, Inc.. PMID 25905258 2020年2月18日閲覧。
- ^ Stretton AO (October 2002). “The first sequence. Fred Sanger and insulin”. Genetics 162 (2): 527–32. PMC 1462286. PMID 12399368.
- ^ “The discovery and development of insulin as a medical treatment can be traced back to the 19th century.” (英語). Diabetes (2019年1月15日). 2020年2月17日閲覧。
- ^ “19th WHO Model List of Essential Medicines (April 2015)”. WHO (April 2015). May 10, 2015閲覧。
- ^ 『Medical Tribune』2011年1月27日号 別刷
- ^ a b Hellman 2007.
- ^ a b 【古今東西あの出来事】世界初のインスリン投与(1922年)糖尿病患者の命救う『日本経済新聞』朝刊2020年1月10日(ニュースな科学面)2020年1月11日閲覧
- ^ UNESCO Memory of the World Archives
- ^ 平川公行『糖尿病のインスリン療法』(新治療叢書 大正13年 第1編、現代之医学社)
- ^ 昭和16年2月23日の『読売新聞』
- ^ 日本を「糖尿病」から救った男! インスリン研究の知られざる天才・福屋三郎と大日本帝国軍の闇 - TOCANA・2019年1月8日
- ^ 03.輸入が途絶えて魚インスリンが製品化 - 糖尿病ネットワーク
- ^ 吉野功二, 武田則之, 村松学 ほか「インスリン製剤中のヒトインスリンおよびプロタミンに対して全身性アレルギーを来した糖尿病の1例」『糖尿病』1999年 42巻 11号 p.927-930, doi:10.11213/tonyobyo1958.42.927, 日本糖尿病学会
- ^ 有好香子, 野田薫, 綾目秀夫「アナフィラキシーショックをきたしたインスリンアレルギーの1例」『糖尿病』2005年 48巻 8号 p.617-620, doi:10.11213/tonyobyo.48.617, 日本糖尿病学会
参考文献
[編集]- 病態生理に基づく臨床薬理学 ISBN 4895924610
- インスリン療法マニュアル第4版 ISBN 9784830613692
- 糖尿病治療ガイド2008-2009 ISBN 9784830613708
- 超速効! 糖尿病診療エクスプレス(上巻) ISBN 4903331032
- 超速効! 糖尿病診療エクスプレス(下巻)ISBN 4903331040
- Hellman B, Gylfe E, Grapengiesser E, Dansk H, Salehi A (2007). “[Insulin oscillations--clinically important rhythm. Antidiabetics should increase the pulsative component of the insulin release]” (Swedish). Lakartidningen 104 (32–33): 2236–9. PMID 17822201.
関連項目
[編集]- 経口血糖降下薬
- シックデイ
- インスリン抵抗性
- インスリン・ショック療法 - かつて統合失調症の治療法として用いられていた
- インクレチン - インスリンの分泌を促進する消化管ホルモン
- 高血糖症
- 低血糖症
- インスリノーマ
資料
[編集]- University of Toronto Libraries Collection: Discovery and Early Development of Insulin, 1920–1925
- Animations of insulin's action in the body at AboutKidsHealth.ca
- Insulin Resistance and Cancer Risk: An Overview of the Pathogenetic Mechanisms Biagio Arcidiacono, Stefania Iiritano, Aurora Nocera, Katiuscia Possidente, Maria T. Nevolo, Valeria Ventura, Daniela Foti, Eusebio Chiefari, and Antonio Brunetti. Exp Diabetes Res. 2012; 2012: 789174. Published online 2012 Jun 4. doi:10.1155/2012/789174 PMC 3372318 PMID 22701472
- The role of the insulin/IGF system in cancer: lessons learned from clinical trials and the energy balance-cancer link doi:10.3389/fendo.2015.00077
- Hyperinsulinemia in Obesity, Inflammation, and Cancer Anni M.Y. Zhang, Elizabeth A. Wellberg, Janel L. Kopp, and James D. Johnson. Diabetes Metab J. 2021 May; 45(3): 285–311. Published online 2021 Mar 29. doi:10.4093/dmj.2020.0250 PMC 8164941 PMID 33775061





