Chloraat

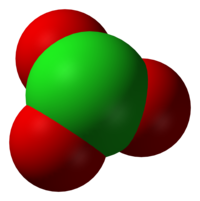
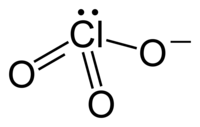
Het chloraat-ion is een oxoanion van chloor, met als brutoformule ClO3−. Chloraten zijn zouten en esters van waterstofchloraat. Bekende chloraten zijn natriumchloraat en kaliumchloraat.
Synthese
[bewerken | brontekst bewerken]Metaalchloraten kunnen worden bereid door chloor aan hete metaalhydroxides (MOH) toe te voegen.
In deze reactie ondergaat chloor een auto-redoxreactie. Chloor (oxidatiegetal 0) vormt chloride (Cl−) met oxidatiegetal -I, en chloraat (ClO3−) met oxidatiegetal +V. Reactie van een koud waterig metaalhydroxide met chloor levert geen chloraat. In plaats daarvan vormt zich het chloride en een hypochloriet.
Structuur
[bewerken | brontekst bewerken]In de meeste gevallen wordt slechts één resonantiestructuur van het chloraation weergegeven. In werkelijkheid zijn echter alle Cl-O-bindingen identiek, wat tot uitdrukking komt in de gelijke lengte van alle bindingen:
Het ion neemt een trigonaal piramidale structuur aan.
Eigenschappen
[bewerken | brontekst bewerken]Chloraten zijn krachtige oxidatoren. Mengsels van chloraten met reductoren werden daarom vroeger als explosief en ontstekingsmiddel gebruikt. Tegenwoordig gebruikt men de stoffen vanwege de wrijvingsgevoeligheid en de neiging tot spontane reactie niet meer voor deze doeleinden.
Chloraten zijn tamelijk toxisch. Dit in tegenstelling tot de doorgaans onschadelijke chloriden die voortkomen uit reductie van chloraten.

